Phosphonate de diméthyle
Le phosphonate de diméthyle (ou diméthylphosphonate, DMP, de l'anglais dimethyl phosphonate) est l'ester diméthylique de l'acide phosphoreux. Il est utilisé principalement comme intermédiaire en synthèse organique pour la production de retardeurs de flamme, de pesticides, de produits pharmaceutiques, de composés utilisés dans le traitement de l'eau (inhibiteur de corrosion) et des composés pour le traitement des textiles[2].
Pour les articles homonymes, voir DMP.
| Phosphonate de diméthyle | |
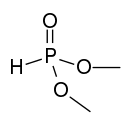
| |
| Structure du phosphonate de diméthyle | |
| Identification | |
|---|---|
| Nom UICPA | [méthoxyphosphoryl]oxyméthane |
| Synonymes |
diméthylphosphonate |
| No CAS | |
| No ECHA | 100.011.622 |
| No CE | 212-783-8 |
| InChI | |
| Propriétés chimiques | |
| Formule | C2H7O3P |
| Masse molaire[1] | 110,048 9 ± 0,003 g/mol C 21,83 %, H 6,41 %, O 43,62 %, P 28,15 %, |
| Propriétés physiques | |
| T° ébullition | 171,1 °C[2] |
| Masse volumique | 1,2 g·cm-3 à 20 °C[2] |
| Point d’éclair | ~70 °C[2] |
| Pression de vapeur saturante | 1,35 hPa à 20 °C[2] |
| Viscosité dynamique | 1,4 mPa·s à 20 °C[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Production et synthèse
Il est synthétisé par réaction entre le trichlorure de phosphore et du méthanol[2].
- PCl3 + 3 CH3OH → (CH3O)2P(O)H + CH3Cl + 2 HCl
Une autre voie de synthèse utilise du méthanolate de sodium à la place du méthanol. La réaction est exothermique et la purification se fait par distillation[2].
Réactivité
Le phosphonate de diméthyle s'hydrolyse pour former du méthanol et du phosphonate de méthyle. La réaction est favorisée en milieu basique.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Dimethyl phosphonate : SIDS Initial assessment report for SIAM 18, UNEP Publications, (lire en ligne).
- Portail de la chimie