Écorce
L'écorce ou cortex désigne un ensemble variable de couches externes des tiges et des racines des plantes vasculaires, responsable des fonctions nutritives et protectrices des tissus sous-jacents.
Pour les articles homonymes, voir Écorce (homonymie).

Plus spécifiquement, l'écorce correspond au revêtement extérieur du tronc, des branches et des racines des arbres, et plus généralement des plantes ligneuses. Elle est issue de la croissance secondaire (en) de la plante.


Il est souvent possible de reconnaître un arbre par son écorce (couleur, forme, consistance, épaisseur), dont l'aspect peut cependant fortement varier selon les régions (latitudes, altitudes), son âge, son exposition, et la présence éventuelle de lichens, mousses, algues ou d'autres épiphytes.
Les écorces fossilisées, dans les schistes miniers notamment, sont utilisées pour identifier les arbres et les paléopaysages. L'écorçage est l'action d'enlever l'écorce d'un arbre, il se pratique pour différentes raisons.
Définitions
Pour le promeneur du dimanche, l'écorce est une peau morte qui protège l'arbre contre différents stress (vent, feu, froid, agents phytopathogènes…). Dans le langage courant, on appelle ainsi écorce les tissus externes, morts, crevassés, qui parfois s'exfolient par plaques, et que les botanistes appellent rhytidome.
« Dans le langage des horticulteurs, des forestiers et des pépiniéristes (et en anglais), le terme écorce désigne tous les tissus situés à l'extérieur du cambium. Pour ces professionnels, écorcer un tronc, c'est mettre le bois à nu[2] ».
Pour les botanistes, l'écorce désigne un ensemble variable de couches externes des tiges et des racines des plantes vasculaires, responsable des fonctions nutritives protectrices des couches sous-jacentes. Elle correspond aux tissus extérieurs au cylindre central. Dans les organes jeunes des plantes à graines ligneuses et chez certaines Monocotylédones, l'écorce est réduite à un parenchyme, avec ou sans tissu de soutien (collenchyme et sclérenchyme), entouré et protégé par l'épiderme (tige) ou le rhizoderme (racine). Chez les plantes à graines ligneuses âgées (Gymnospermes, Angiospermes Magnoliidées, Eudicotylédones ligneuses), l'écorce est une structure secondaire (en) formée par le périderme (constitué du phellogène, du phelloderme et du suber) et le liber inclus. Le phellogène est un tissu méristématique secondaire qui produit du suber (tissu protecteur) vers l'extérieur du tronc et du phelloderme (tissu parenchymateux vivant de réserve) vers l'intérieur. Un nouveau périderme est produit chaque année par la plante à partir de cellules du liber qui se dédifférencient. Il reste donc des bandes de liber incluses entre les péridermes des différentes années, d'où leur nom de « liber inclus ». Ce liber n'est plus fonctionnel[3].
Fonctions
Protection de l'arbre
Certaines écorces génèrent des épines dures et protectrices pour l'arbre. L'écorce cicatrise et forme des bourrelets autour des blessures (recouvrant le bois si la blessure était de petite taille).
L'écorce des arbres est souvent riche en toxines (phénols) et principes amers (tanins) ce qui la rend plus protectrice, mais en fait aussi une source de principes médicinaux, que certains animaux ont aussi appris à exploiter (exemple : l'aspirine de l'écorce de saules broutée par des animaux).
Fonctions biomécaniques
L'écorce en s'épaississant de manière différentielle - en complément des forces internes du bois - participe aussi aux redressement d'une tige qui s'éloigne de la verticale (expérimentalement en laboratoire ou à la suite d'un mouvement de terrain ou à un mauvais encrage dans le sol, dans la nature)[4]. L'écorce joue, lentement, pour l'arbre un rôle qui a été comparé à celui des muscles chez les animaux, grâce à une organisation des fibres structurée en treillis[4].
Blessures de l'écorce


Les blessures superficielles ou de petites tailles qui n'intéressent que l'écorce au sens botanique du terme ne sont pas trop dommageables pour l'arbre. Quelques espèces y sont quasiment insensibles, tel le chêne-liège qui peut être écorcé tous les sept ans.
Il n'en est pas de même pour les blessures profondes, celles qui atteignent le bois.
Dès les premières minutes, l'arbre réagit en activant son système de défense : il émet des tanins (Polyphénols), de la résine (pour les résineux) ou du latex (pour certaines espèces tropicales telles que hevea, ficus... ) pour limiter les agressions extérieures, champignons et bactéries en particulier. Les vaisseaux sont rapidement et naturellement obstrués par les thylles (Thyllose) ou par la production de gomme.
Des cellules peu spécialisées situées près du cambium déchiré vont se dédifférencier puis se diviser pour produire un « cal ».
Ce n'est qu'à l'intérieur de ce « cal » que l'« anneau cambial » va tenter de se reformer (au plus tôt le dixième jour en cas d'une blessure étroite et en pleine période d'activité mitotique). Ce néo-cambium produira du bois vers l'intérieur et du liber vers l'extérieur.
Parallèlement un néo-phellogène va s'initier dans les couches moins profondes, ceci protègera, la blessure en cours de cicatrisation, de la déshydratation.
Ce processus permet de comprendre la réussite des greffes végétales puisque « greffer » nécessite de « blesser » deux portions de végétaux jusqu'au cambium.
Maladies
Elles peuvent être introduites via diverses blessures ou accidents (foudre, gel, casse de tempête…) ou parfois chez les très jeunes arbres par divers insectes suceurs de sève (pucerons, cochenilles, punaises).
Elles touchent plus souvent des arbres blessés ou stressés (manque d'eau, racines manquant d'oxygène…).
Elles sont dues à des champignons, bactéries (chancres bactériens) ou virus et parfois à la colonisation de l'écorce ou plus souvent de sa face interne, contre l'aubier par des parasites (scolytes par exemple). Souvent il ne s'agit pas d'une maladie de l'écorce mais de l'arbre, mais certains symptômes (craquelures, coulures, changements de couleurs, décollements, déshydratation…) sont visibles sur l'écorce.
Inclusions d'écorce
Certains arbres ont une forme extérieure non lisse devenant avec l'âge très festonnée (en coupe).
Au fur et à mesure de leur croissance, des invaginations de l'écorce (bark pockets, littéralement « poches d'écorce » pour les anglophones) peuvent se former, et être peu à peu entièrement incluse dans le bois. Ces inclusions colorées (plus foncées) peuvent être considérées comme des défauts du bois, ou au contraire être exploités par les artisans et ébénistes ou sculpteurs ou tourneurs comme motifs décoratifs ou naturels du bois, un peu comme les loupes.
Des chercheurs, sur la base d'analyse de métaux lourds de ces inclusions, ont eu l'idée de les exploiter comme archive témoignant de la qualité de l'air du passé[5] (voir paragraphe suivant)
Écorces, accumulatrices de pollution, et bioindicatrices ?
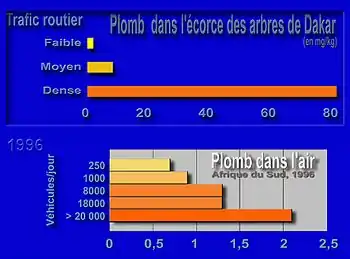
En zone urbaine et industrielle, ou près des routes, l'écorce des arbres est en contact direct avec la pollution de l'air, les éclaboussures, les embruns marins ou routiers, le sel de déneigement, la pollution particulaire et le ruissellement de la pluie parfois polluée.
Les arbres peuvent passivement accumuler ou activement bioaccumuler des métaux ou métalloïdes toxiques dont le plomb et l'arsenic, dans l'écorce. On les retrouve ensuite fixé dans les cernes. Et on en trouve d'autant plus que l'arbre est ou était proche d'une source de pollution (pollution routière notamment sur des zones de trafic dense et non fluide)[6]. Plusieurs études de monitoring de l'environnement ont ainsi utilisé l'écorce des arbres, dont aux Pays-Bas par exemple[7]. En 1994, 20 éléments-traces métalliques[7] avaient ainsi été mesurés dans de échantillons d'écorce sur 23 sites différents[7].
Concernant la pollution routière,
- on constate que les taux de plomb, zinc et cuivre dans l'écorce des arbres diminuent avec la distance à la route et la hauteur au-dessus du sol[6].
- À Vineland (New Jersey), dans une zone polluée[8] par l'industrie chimique (« Vineland Chemical Company », qui a produit des pesticides à base d'arsenic de 1950 à 1994, les taux d'arsenic ont été mesurées dans les cernes de croissance, la moelle, l'écorce et des feuilles de cinq essences d'arbres (appartenant à quatre genres botaniques différents) et c'est dans l'écorce qu'on a trouvé les concentrations les plus élevées (0,68 ± 0,89 mg/kg, n = 16), quatre fois plus que dans les feuilles (1,9 ± 1,8 mg / kg, n = 4) de la zone contaminée[9].
Les taux d'arsenic dans les cernes du bois de la zone contaminée étaient d'environ 0,15 mg/kg ( ± 0,28, n = 32), « considérablement (près de 50 fois) plus élevés que ceux des zones de contrôle (0,06 ± 0,06 mg/kg, n = 30) »., avec une relation plutôt positive entre le sol et les cernes) mais pas toujours nette, ce qui laisse penser que l'absorption par les feuilles et les écorces jouent aussi un rôle[9]. - On note cependant que les arbres semblent capable de se détoxiquer pour l'arsenic V (As(V)) en le stockant dans leur partie « morte » (bois de cœur). En effet, dans les sols aérés, cette forme de l'arsenic est considéré comme un analogue chimique du phosphore (P). Or, la concentration de l'aubier en phosphore est bien plus élevée que dans le bois de cœur, ce qui montre que le phosphore est continuellement exporté vers la partie vivante de l'arbre ; écorce et bois en formation (aubier), au contraire de l'arsenic qui est stocké dans le bois au fur et à mesure de sa production (avec des taux similaires dans l'aubier et le duramen). Ainsi du plomb de l'arsenic ou d'autres métaux peuvent être stocké pour des années ou siècles... Ils retourneront néanmoins dans l'environnement ou le réseau trophique, par exemple via la fumée et les cendres si le bois brûle (foyer domestique, barbecue, bois de chauffage, incendie de forêt...), ou encore via les communautés saproxylophages qui finiront par décomposer le bois[9] ou plus tardivement via les invertébrés qui se développeront dans l'humus issu de ce bois. Pour certains polluants, tant que la pollution est présente, l'écorce s'en imprègne. Elle peut donc, dans ces cas être utilisée pour des études géographiques et temporelles de pollution.
Étude des inclusions d'écorce
Une autre approche de « biomonitoring passif » et rétrospectif a consisté à analyser les inclusions ou poches d'écorce qu'on trouve couramment dans le bois de certains arbres[5]. Ces inclusions semblent être des indicateurs plus fiables de l'historique de pollution subie par l'arbre que la teneur en polluant des cernes eux-mêmes.
- Par exemple, en étudiant les teneurs en plomb de différentes parties d'un chêne japonais de 250 ans (Quercus crispula) prélevé dans le Parc national de Nikko, on a constaté que les cernes de croissance (échantillonnés par incréments de 5 ans) ne présentaient que des teneurs en plomb de 0,01 à 0,1 mg/kg, sans changement significatif de concentration avec le temps. Alors que les inclusions d'écorces montraient nettement - de 1875 à nos jours - une augmentation progressive de la teneur en Pb (qui augmente d'environ 100 fois, passant de 0,1 à 10 mg kg-1). Des échantillons de mousse épiphyte poussant sur le tronc de ce chêne contenaient 17 mg de plomb par kg de mousse. L'arbre a ainsi enregistré l'ouverture des frontières du Japon à partir de 1854 qui s'est ensuivi d'une forte croissance de la pollution par le plomb, non traduite dans les cernes annuels, mais mémorisée par les inclusions d'écorce. Comme ailleurs, les variations de rapport isotopique 206Pb/207Pb des poches d'écorce a traduit les changements de sources de plomb, passant d'environ 1,18 à 1,16 de 1964 à nos jours. Le rapport isotopique 206Pb/207Pb des pousses de mousse était semblable à celui de l'écorce actuelle (1,16). Pour le chêne, les inclusions d'écorces semblent donc un meilleur traceur de l'évolution historique de la pollution de l'air par le plomb[10]. Pour d'autres essences (Picea abies par exemple), les cernes semblent avoir fidèlement enregistré les variations de pollution extérieures[11].
- Au début des années 2000, des chercheurs ont ainsi collecté des échantillons d'écorce incluse dans le bois d'arbres locaux, en Norvège, à Røros près d'une ancienne zone de traitement de minerais sulfurés et d'activité minière, bien documentés de 1647 à 1977 (date de fermeture de la fonderie). Ils ont analysé les isotopes stables du plomb dans ces « inclusions d'écorces ».
Les signatures isotopiques du plomb trouvé dans les inclusions ont permis de différencier les sources successives et dominantes de pollution par le plomb, avec du XVIIe siècle jusque vers 1925 le plomb issu de la combustion du charbon et de la fusion du minerai (en Angleterre et sur le continent qui dominaient dans le sud-ouest Norvège), auquel s'est ajouté à partir de 1925 environ et jusque vers 1950 environ d'autres sources (dont l'incinération de déchets notamment) puis vers 1950 un mélange de sources associant principalement l'essence au plomb, avec le charbon, le coke et l'incinération des déchets[5].
Ces résultats ont aussi montré une bonne corrélation de ces données isotopiques concernant le Pb avec celles de carottages de tourbe et d'analyses de cernes. Ceci a fait conclure aux auteurs de cette étude que ces inclusions sont de bonnes candidates pour servir d' « archives historiques » de la pollution environnementale (locale et distante), au moins pour certains métaux et radionucléides (on a vu ci-dessus que l'arsenic ou le thallium semblent moins bien datés et suivis par cette méthode)[5]. Un intérêt particulier est la relation entre l'industrialisation de l'Europe et la pollution mondiale de l'environnement. La compréhension des évolutions passées sont par ailleurs selon eux « d'une valeur considérable pour l'évaluation de la situation actuelle »[5].
- Un peu de la même manière, en 1996, au Japon, le plomb avait été recherché dans des inclusions d’écorces d’arbres ayant poussé sur deux sites très différents ; 1) à Nikko, zone plus urbaine et rurale à environ 100 km au nord de Tokyo, et 2) dans une zone reculée et sauvage, a priori plus épargnée par la pollution, sur l'île de Yakushima. Les arbres choisis étaient des crypotomérias (Cryptomeria japonica ; des résineux pouvant facilement vivre plus de deux siècles. Les premiers poussent depuis 1760-1780 (235 à 255 ans) près de Nikko, et les autres depuis 1786 à 1809 (de 186 à 209 ans) dans la région plus reculée de Yakyshima.
Les teneurs en plomb mesurées dans ces « encapsulations d'écorce » ont été estimées correspondre au plomb accumulé en environ 20 ans pour chaque site.
Elles étaient autrefois de 0,10 μg/g de Pb à Nikko et du double environ (0,22 μg/g) à Yakushima. Mais au début des années 1990, pour l'écorce externe des mêmes C. japonica, les teneurs en plomb étaient passées à 150 μg/g à Nikko (1990) et 1,4 µg/g à Yakushima (1992) (le plomb dispersé dans l’air comme additif de l’essence a été la principale source de plomb dans l'atmosphère au Japon ; à partir de 1949, avec un maximum atteint vers 1960-1965, et une poursuite jusque 1987 (où la production d’essence au plomb a été interdite au Japon). La teneur en plomb de l'écorce externe représentant environ le total du plomb extérieur absorbé en 40 ans, les chercheurs ont estimé que la pollution par le plomb avait grandi d'environ trois ordres de grandeur à Nikko, et quand même d’un ordre de grandeur à Yakushima, zone pourtant a priori parmi les plus épargnées[12].
- Un travail similaire a été fait sur une inclusion d’écorce (formée et progressivement enfermée à la jonction de deux branches d’un hêtre ( Fagus sylvatica) dans une zone semi-rurale proche de Sheffield (Royaume-Uni). Les cernes de croissance ont montré que la poche s’est formée entre 1919 et 1998. La teneur en plomb a varié dans le temps de 7 à 78 mg kg-1 et le rapport isotopique 206Pb/207Pb 1,11 à 1,15. La surface actuelle de l’écorce contient 46 mg kg-1 Pb (avec un ratio de 1,11 206Pb/207Pb), qui traduit bien la diminution de la pollution de l’air par le plomb. C’était ici aussi le plomb de l'essence qui a été la première source de pollution (jusqu’à 50 % du plomb total pour la période 1986-1998, mais d'autres sources étaient généralement dominantes. La pollution globale par le plomb a connu son maximum entre 1951 et 1973, avant un renversement de la tendance, également retrouvé dans le ratio 206Pb/207Pb[13].
Décomposition des écorces
Chez l'arbre mort, l'écorce est décomposée par des communautés de bactéries et de champignons pionniers qui souvent préparent ou accompagnent le travail des invertébrés saproxylophages.
La composition de l'écorce est très différente de celle du bois. Il n'est donc pas surprenant que les champignons décomposeurs des écorces ne soient pas les mêmes que les champignons délignifiants et cellulolytiques (assurant respectivement la décomposition enzymatique de la lignine et de la cellulose du bois (qui sont essentiellement des basidiomycètes).
Les écorces mortes étaient autrefois réputées uniquement dégradées par des ascomycètes, et ces derniers n'étaient pas réputés décomposer le bois lui-même. Mais ce point de vue évolue. En effet, les ascomycètes (décomposeurs des écorces mortes) semblent aussi contribuer secondairement à la décomposition du bois-mort, par exemple chez le hêtre (En laboratoire, ils décomposent en quelques semaines jusqu'à 40 % du papier filtre de cellulose surlequel on les cultive, et qui était leur seule source de carbone. Et on a récemment (2010[14]) démontré chez diverses souches étudiées des capacités amylolytiques, pectinolytiques et mannanolytique ainsi que cellulolytique qui laissent penser que non seulement les ascomycètes peuvent décomposer le bois, mais qu'ils pourraient même jouer un rôle important dans la décomposition des arbres morts après délignification par basidiomycètes. Les analyses phylogénétiques des isolats étudiés les classait dans les genres Penicillium ou Amorphotheca.
Utilisation




Dans la production de bois d’œuvre, l'écorce est éliminée à différents stades du processus de façonnage des grumes, par des écorceuse, éliminée avec l'aubier par l’équarrissage, elle peut-être en dernier recours éliminée des plateaux de sciage, pour établir une rive droite, par sciage en long.
L'écorce de certaines plantes est exploitée par l'homme à des fins diverses :
- l'écorce du chêne-liège produit le liège ;
- usages alimentaires : l'écorce de la cannelle est utilisée depuis des siècles comme épice ;
- l'écorce déroulée du bouleau à canot (Betula papyrifera), le mâchecoui, était utilisée par les Amérindiens du Canada pour confectionner l'enveloppe de leurs canots cousue et étanchée avec de la résine. Possédant une haute teneur en molécules lipophiles comme la bétuline (en), l'écorce imperméable était aussi utilisée pour confectionner des raquettes, des paniers, des wigwams[15] ; le Bouleau est aussi utilisé en Europe du Nord comme sous-toiture sous les mottes de terre enherbées de maisons traditionnelles à toiture végétale ;
- usages en pharmacopée : de l'écorce de quinquina on extrait la quinine et la quinidine ;
- de l'écorce du saule blanc, on extrait l'aspirine ;
- l'écorce du tilleul produit par teillage des fibres textiles ;
- l'écorce du mûrier à papier (Broussonetia papyrifera) a servi à fabriquer du papier de même que celle du lokta (Daphne papyracea) toujours utilisée de manière artisanale au Népal ;
- les écorces résiduelles des usines de sciages sont utilisées pour produire de l'énergie et des panneaux de bois ;
- le tan, poudre utilisée pour la préparation des cuirs, est fabriqué à partir de l'écorce de chêne.
Certains arbres et arbustes sont cultivés en raison de l'aspect décoratif de leur écorce.
En horticulture, on utilise souvent des écorces de pin pour réaliser des paillis isolants (mulch).
Références
- Marc-André Selosse, Les Goûts et les couleurs du monde. Une histoire naturelle des tannins, de l'écologie à la santé, Actes Sud Nature, , p. 222
- enis-Jacques Chevalier, « La structure secondaire des tiges », sur ens.fr, .
- Romaric Forêt, Dictionnaire des sciences de la vie, De Boeck Supérieur, , p. 527.
- CNRS (2018), communiqué intitulé L'écorce fait la force, publié le lundi 6 août 2018
- Gøran Åberg, Gunnar Abrahamsen, Eiliv Steinnes et Harry Hjelmseth, Utilization of bark pockets as time capsules of atmospheric-lead pollution in Norway ; Atmospheric Environment Volume 38, Issue 36, November 2004, Pages 6231-6237 doi:10.1016/j.atmosenv.2004.06.041
- D. Barnes, M.A. Hamadah et J.M. Ottaway, The lead, copper and zinc content of tree rings and bark A measurement of local metallic pollution ; Science of The Total Environment Volume 5, Issue 1, January 1976, Pages 63-67 doi:10.1016/0048-9697(76)90024-3 (Résumé, en anglais)
- P. Kuik and H. Th. Wolterbeek Factor analysis of trace-element data from tree-bark samples in The Netherlands ; Environmental Monitoring and Assessment, 1994, Volume 32, Number 3, Pages 207-226 (résumé)
- EPA, Superfund Program Implements the Recovery Act / Vineland Chemical Company
- Zhongqi Cheng, Brendan M. Buckley, Beth Katz, William Wright, Richard Bailey, Kevin T. Smith, Jingbo Li, Ashley Curtis et Alexander van Geen ; Arsenic in tree rings at a highly contaminated site ; Science of The Total Environment Volume 376, Issues 1-3, 15 April 2007, Pages 324-334 doi:10.1016/j.scitotenv.2007.01.074
- David J. Bellis, Kenichi Satake, Masato Noda, Naoki Nishimura et Cameron W. McLeod, Evaluation of the historical records of lead pollution in the annual growth rings and bark pockets of a 250-year-old Quercus crispula in Nikko, Japan ; The Science of The Total Environment Volume 295, Issues 1-3, 5 August 2002, Pages 91-100 doi:10.1016/S0048-9697(02)00054-2 ([Résumé], en anglais)
- Martin Novak, Jitka Mikova, Michael Krachler, Jan Kosler, Lucie Erbanova, Eva Prechova, Iva Jackova and Daniela Fottova, Radial distribution of lead and leadnext term isotopes in stem previous termwoodnext term of Norway spruce: A reliable archive of pollution trends in Central Europe ;Geochimica et Cosmochimica Acta Volume 74, Issue 15, 1 August 2010, Pages 4207-4218 doi:10.1016/j.gca.2010.04.059 (Résumé, en anglais)
- Kenichi Satake, Atushi Tanaka et Katsuhiko Kimura, 1996, Accumulation of lead in tree trunk bark pockets as pollution time capsules ; Science of The Total Environment Volume 181, Issue 1, 1 March 1996, Pages 25-30 doi:10.1016/0048-9697(95)04955-X (Résumé)
- David J. Bellis, Cameron W. McLeod et Kenichi Satake, Pb and 206Pb/207Pb isotopic analysis of a tree bark pocket near Sheffield, UK recording historical change in airborne pollution during the 20th Century ; The Science of The Total Environment Volume 289, Issues 1-3, 22 April 2002, Pages 169-176 doi:10.1016/S0048-9697(01)01037-3 (Résumé, en anglais)
- K. Fujii, T. Sugimura and K. Nakatake, Ascomycetes with cellulolytic, amylolytic, pectinolytic, and mannanolytic activities inhabiting dead beech (Fagus crenata) trees ; Folia Microbiologica Volume 55, Number 1, 29-34, DOI: 10.1007/s12223-010-0005-x, 2010 (résumé)
- (en) Nancy R. Morin, Flora of North America, vol. 3: Magnoliophyta: Magnoliidae and Hamamelidae 1993, OUP USA, , p. 522.
Voir aussi
Articles connexes
- Écorçage
- Arbre
- Bois
- Forêt
- Bois raméal fragmenté
- Mulch
- Tanin
- Rhytidome
- Documents sur écorce de bouleau
- Éclatement de l'écorce
- Annélation
- Portail de la botanique