Lichen
Les lichens (/li.kɛn/), appelés aussi champignons lichénisés ou champignons lichénisants, résultent d'une symbiose permanente entre au moins un champignon hétérotrophe appelé mycobionte, et des cellules microscopiques photoautotrophes, possédant de la chlorophylle, nommées photobiontes. Ce sont des organismes composites. Le mycobionte est prépondérant dans la plupart des genres. Le photobionte s'appelle phycobionte lorsque le partenaire est une algue verte, cyanobionte ou bactériobionte lorsqu'il est une cyanobactérie. Les lichens sont classés dans le phylum des Fungi.
Ne doit pas être confondu avec Lychen.
Pour les articles homonymes, voir Lichen (homonymie).

 |
2.jpg.webp) |
 | ||
Les cladonies composent avec leurs thalles des « micro-paysages » variés : forêts de baobabs, podétions en forme de trompette, buissons en boules, etc. Ils ont une importance significative en Scandinavie (nourriture des rennes, emploi pour les décorations florales, les couronnes funéraires…)[4]. | ||||
.jpg.webp)
_(8558627918).jpg.webp)





La symbiose résulte d'une association, appelée lichénification ou lichénisation. L'inverse, c'est-à-dire une algue macroscopique hébergeant un champignon microscopique, est une mycophycobiose.
Les lichens génèrent un appareil végétatif composé à 90 % par le champignon, le thalle, qui se développe lentement à la surface de supports variés, y compris dans des milieux souvent hostiles (exposition à la sécheresse, à de fortes températures, etc.).
L'étude des lichens est appelée « lichénologie ».
On estime à 6 % la proportion de la surface terrestre recouverte de lichens[6],[7]. Les lichénologues ont inventorié 20 000 espèces[8]. Près de 100 nouvelles espèces sont découvertes chaque année et il en resterait 8 000 à découvrir[9]. Les plus vieux fossiles de lichens datent du Cambrien[10].
Étymologie
Le mot « lichen » vient du grec λειχἠν / leikhḗn, « dartre, cal, plante parasite ». Il désignait autrefois toutes les structures épiphytes dont les lichens encroûtants, présentés comme des dartres.
Historique
Au IIIe siècle av. J.-C. Théophraste, au Livre III de son Histoire des plantes, dit que le lichen naît de l'écorce, et non d'un œil, et les compare à des guenilles[11]. Jusqu'au milieu du XIXe siècle, les naturalistes les classaient soit dans la catégorie des mousses, soit dans celle des algues, et considéraient les lichens du sol souvent comme des « excréments de la terre »[12]. L'avènement de microscopes performants a permis de mettre en évidence les interactions biologiques dans cet organisme. Mais il a fallu attendre 1867 pour que le botaniste suisse Simon Schwendener considère qu'il a une double nature, sous forme de parasitisme[13]. Beaucoup de lichénologistes reconnus rejetèrent d'abord cette hypothèse, car le consensus était alors partagé sur le fait que tous les organismes vivants étaient autonomes. Mais d'autres éminents biologistes, comme Anton de Bary ou Albert Bernhard Frank, furent moins prompts à repousser les idées de Schwendener, et ce concept s'étendit bientôt à d'autres domaines d'étude, comme les agents pathogènes. Albert Bernhard Frank propose le terme de symbiotismus en 1877[14], terme peu à peu accepté par la communauté scientifique à la suite des travaux d'Anton de Bary qui donne la définition la plus large de la symbiose[15]. Au XXe siècle, la systématique moderne les classe dans le phylum des Fungi car seul le mycobionte assure la reproduction sexuée.
Symbioses
Généralités sur les partenaires
Les lichens font partie de la biodiversité négligée ; bien qu'ils soient peu recherchés lors des inventaires fongiques, une centaine de nouvelles espèces sont décrites chaque année. En 2007, 18 882 espèces de lichens sont décrites[16]. En Europe occidentale, le nombre d'espèces est compris entre 50 et 75 % du nombre de phanérogames. En France, on compte environ 2 500 lichens pour 4 500 phanérogames[17].
La spécificité d'association entre photobionte et mycobionte(s) peut être étroite ou large mais la plupart des lichens sont modérément spécifiques : un même mycobionte peut s'associer à différentes espèces de phytobionte. Les différentes associations sont[18] :
- dans 85 % des cas, une (ou des) algue(s) associée(s) à un ou plusieurs champignons ;
- dans 10 % des cas, une cyanobactérie associée à un champignon ;
- dans 5 % des cas, les 3 types de partenaires sont associés : dans cette symbiose tripartite, la cyanobactérie fixatrice d'azote est généralement confinée dans des compartiments fongiques appelés céphalodies (en)[19].
Mycobiontes
Les mycobiontes impliqués dans la symbiose lichénique (ascomycète, basidiomycète ou deutéromycète) représentent environ un cinquième de l'ensemble des champignons actuellement connus. On rencontre le plus souvent des « ascolichens » dans lesquels l'ascomycète est toujours un symbiote obligatoire : 40 % des espèces d'ascomycètes ont adopté ce type de symbiose[20].
Après plus de 140 ans durant lesquels on a cru que l'association était binaire (1 champignon + 1 algue), des chercheurs ont montré en 2016 qu'il faut en réalité dans la plupart des lichens un troisième partenaire (qu'on avait d'abord cru être un parasite des lichens) pour que l'association soit pérenne ; il s'agit d'une levure basidiomycète ; c'est elle qui est responsable de la forme du thalle du lichen et en partie de sa forme générale[21]. La découverte de ce troisième partenaire (la levure basidiomycète) est entre autres due à Toby Spribille assistant professeur à la faculté des sciences de l'Alberta et à l'équipe de McCutcheon[22]. Ces travaux furent initiés par la comparaison entre deux espèces de lichens , B. tortuosa et B. fremontii séparées par la production d'acide vulpinique. Après plusieurs tests effectués, l'hypothèse d'une différence d'expression de gènes à l'origine de l'acide vulpinique fut écartée. Ils ont fini par découvrir que cette production d'acide vulpinique jusqu'alors inexpliquée était en réalité due à la présence de levure dans le thalle du lichen[21],[22]. Cette association est durable, reproductible (elle donne naissance à de nouveaux individus, à la formation d'une nouvelle unité fonctionnelle) avec des bénéfices réciproques pour les partenaires, et entraîne des modifications morphologiques et physiologiques (ces dernières liées à des interactions génétiques entre les trois partenaires)[21]. Les levures sont intégrées dans le cortex lichénique. Il y a une corrélation entre leur abondance et des variations autrefois inexpliquées du phénotype[21]. Certaines lignées de basidiomycètes vivent en lien étroit avec certains lichens sur de vastes zones géographiques, souvent retrouvés sur les six continents[21]. Le cortex lichénique est structurellement plus important qu'on ne le pensait ; il ne s'agit pas d'une simple zone de cellules différenciées d'ascomycètes, mais semble-t-il du lieu d'une symbiose (entre deux types différents de champignons) dans la symbiose (champignon-plante)[21].
Photobiontes
Seuls 2 % des photobiontes sont clairement identifiés, car les caractères morphologiques et les structures sexuées sont considérablement modifiés par la symbiose. Il s'agit souvent d'algues vertes (phycobionte de type chlorophytes), symbiotes facultatifs, qui appartiennent dans de nombreux cas aux genres Trebouxia (lichen souvent vert) ou Trentepohlia (lichen souvent orange, en raison des gouttelettes de caroténoïdes de ces algues). Sur deux cents espèces au total, une seule espèce d'algue non verte existe (une xanthophycée chez des lichens aquatiques du genre Verrucaria).
L'algue est formée de cellules chlorophylliennes qui portent le nom de gonidie.
Lorsque le photobionte est une cyanobactérie (cyanobionte), elle est aussi un symbiote facultatif. Il s'agit d'une bactérie de forme unicellulaire ou filamenteuse, avec contenu cellulaire vert bleuâtre ou vert brunâtre, très souvent du genre Nostoc, moins fréquemment Sigonema, Gloeocapsa ou Scytonema.
Les microalgues des lichens ne sont pas les seuls organismes photosynthétiques à entrer dans un schéma de symbiose, des macroalgues le peuvent également (mycophycobioses).
Bactériobiontes
Les bactériobiontes sont des communautés bactériennes associées aux deux partenaires symbiotiques (photobionte et mycobionte). Ces espèces épiphytiques (biofilms sur le thalle) et endophytiques synthétisent des métabolites spécialisés bioactifs qui ont un rôle de protection vis-à-vis d'autres organismes pathogènes ou parasitiques[23].
Anatomie et structure des thalles
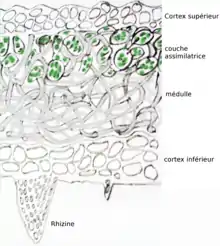
Deux types d'anatomie du thalle caractérisent le lichen[24] :
- lichen homomère dont les cellules du photobionte sont réparties uniformément dans le thalle (cas des genres Leptogium et Collema) ;
- lichen hétéromère dont les cellules du photobionte sont regroupées dans une couche assimilatrice.
La structure d'un lichen hétéromère est typiquement formée :
- d'un cortex supérieur constitué d'un synenchyme (tissu compact formé par les hyphes resserrés du champignon) ;
- d'une couche assimilatrice constitué des cellules du photobionte réparties dans le prosenchyme (tissu fibreux formé par les hyphes biens séparés du champignon)
- d'un médulle, prosenchyme très lâche sans photobionte ;
- d'un cortex inférieur lui aussi constitué d'un synenchyme.
Cette structure peut considérablement varier chez une même espèce de lichen selon son substrat, l'humidité.
Les lichénologues distinguent six types de lichens selon l'aspect global de leur thalle[25] :
- « lichen crustacé ou incrustant » (90 % des lichens[26]) présentant un thalle hétéromère fortement plaqué[alpha 1] au support, formant une croûte[27] :
- lichen crustacé lobé au pourtour : thalle placodiomorphe (ex. : Fulgensia fulgens, Solenopsora candicans) ;
- lichen crustacé non lobé au pourtour : thalle continu, lisse, rugueux ou plissé, fendillé-aréolé, granuleux ou verruqueux, pulvérulent ou lépreux[alpha 2] (ex. : Rhizocarpon geographicum, Acrocordia conoidea, Aspicilia farinosa, Rinodina confragosa, Lecidella carpathica) ;
- « lichen foliacé » présentant un thalle hétéromère non soudé sur toute sa surface (se détachant facilement du substrat), formant des lames souvent lobées comme de petites feuilles qui s'écartent un peu du support, présence d'haptères (crampons) ou de rhizines (fausses radicelles) sur leur face inférieure pour adhérer au substrat :
- lichen foliacé ombiliqué : dépression dénommée ombilic sur la face supérieure (ex : Umbilicaria grisea, Umbilicaria polyphylla) ;
- lichen foliacé non ombiliqué : pas d'ombilic, lobes à disposition radiée (ex : les Xanthoria, les Parmeliaceae comme Punctelia borreri, Parmelia omphalodes).
- « lichen fruticuleux » (du latin frutex, « arbrisseau ou buisson ») présentant un thalle adhérent au substrat par une surface réduite et formant des prolongements redressés, pendants ou étalés. Ces prolongements plus ou moins longs présentent trois formes :
- tiges rondes plus ou moins ramifiées (ex : Alectoria ochroleuca, Usnea florida, Thamnolia vermicularis) ;
- lanières plates parcourues par des cannelures (ex : Ramalina fraxinea) ;
- « lichen squamuleux » : squamules (petits compartiments ressemblant à des écailles) à la surface supérieure (ex : genres Lecanora, Toninia, Rhizoplaca) ;
- « lichen complexe » ou « lichen composite » présentant un thalle primaire plus ou moins foliacé étalé sur le substrat, et sur lequel se développe un thalle secondaire fruticuleux, formé d'éléments (ramifiés, en forme de corne, d'entonnoir ou de trompette, type podétions (en)) se développant perpendiculairement au substrat (genre Cladonia et Stereocaulon vulcani) ;
- « lichen gélatineux » présentant un thalle à cyanobactérie (thalle foliacé, squamuleux, crustacé ou fruticuleux), noir et cassant à l'état sec, devenant gélatineux sous l'action de l'eau (ex. : genres Thyrea et Leptogium, Collema subnigrescens).
Les lichénologues distinguent parfois les « macrolichens » (forme des lichens squamuleux, foliacés ou fruticuleux), des « microlichens » (lichens crustacés granuleux, verruqueux, pulvérulents ou lépreux)[28] ; les préfixes « macro » et « micro » ne se réfèrent donc pas ici à la taille du lichen, mais à la hauteur de son thalle et à la forme de croissance du lichen[29].
En ce qui concerne les relations entre le mycobionte et le phytobionte, on distingue trois cas de figure :
- L'hyphe du champignon se propage entre les cellules du nostoc (algue bleue, genre cyanobactérie) et dans son mucilage.
- La formation d'un appressorium où les deux partenaires ont leurs parois en apposition, accolées l'une à l'autre avec une légère modification. Le contact est plus étroit et plus sophistiqué.
- La formation d'un haustorium où le phytobionte finit par se trouver inclus dans la paroi du mycobionte. Ici, les modifications cytologiques sont grandes.

.jpg.webp) Lecidea laboriosa (en), endolithe dont seules sont visibles les apothécies noires suivant des lignes de rupture de la roche.
Lecidea laboriosa (en), endolithe dont seules sont visibles les apothécies noires suivant des lignes de rupture de la roche..jpg.webp) Protoparmeliopsis muralis, lichen crustacé saxicole couvrant de nombreux substrats artificiels[alpha 3].
Protoparmeliopsis muralis, lichen crustacé saxicole couvrant de nombreux substrats artificiels[alpha 3]..jpg.webp) Ramalina fastigiata, lichen fruticuleux, corticole sur arbres à feuilles caduques.
Ramalina fastigiata, lichen fruticuleux, corticole sur arbres à feuilles caduques..JPG.webp) Lichen foliacé de Physcia.
Lichen foliacé de Physcia.
Reproduction et nutrition
Reproduction
Le lichen a plusieurs modes de reproduction : reproduction végétative ou reproduction asexuée, et reproduction sexuée.
La reproduction végétative se fait par simple fragmentation du thalle (phénomène du bouturage) ou à l'aide d'organes spécialisés[30] qui s'en détachent.
- des isidies, protubérances de formes variées sur le cortex supérieur, contenant les deux symbiotes densément associés
- des soralies, fissures du thalle permettant l'apparition de sorédies (amas de cellules algales entourées d'hyphes)
- des sorédies (sans formation de soralies)
- des pycnides (conceptacles à spores)
La reproduction asexuée est assurée par le mycobionte seul qui produit des conidies à l'extrémité des hyphes toujours enfoncés dans le thalle.
La reproduction sexuée, assurée aussi par le mycobionte, forme deux types d'organes spécialisés : les apothécies (forme de cupules à la surface du cortex) ou les périthèces (forme d'outres enfoncées superficiellement dans le thalle).
Ces organes forment un ensemble de caractères très utilisés pour la détermination des espèces.
 Isidies à la surface du thalle de Parmelia saxatilis.
Isidies à la surface du thalle de Parmelia saxatilis. Thalle de Phaeophyscia orbicularis couvert de soralies.
Thalle de Phaeophyscia orbicularis couvert de soralies. Cladonia macilenta, lichen muscicole avec ses apothécies au sommet des podétions.
Cladonia macilenta, lichen muscicole avec ses apothécies au sommet des podétions.
Nutrition et croissance


Le mycobionte fournit le support et la protection, les sels minéraux, la réserve d'humidité (une pression osmotique élevée, assurée par l'arabitol et le mannitol, limite la dessiccation du thalle) et facilite probablement l'alimentation du photobionte en CO2 ; le photobionte fournit les nutriments issus de la photosynthèse chlorophyllienne (amidon chez la plupart des espèces, réserve lipidique chez les Trentepohliales), 20 à 30 % des nutriments étant en moyenne rétrocédés au mycobionte[33].
Les besoins en sels minéraux des lichens sont assez limités, car ce sont de faibles consommateurs qui peuvent provisoirement stopper leur croissance.
Ils se nourrissent à partir de l'atmosphère (minéraux sous forme de solutés dans les eaux de pluie). Les lichens ont aussi la possibilité de dissoudre des éléments minéraux du substrat en excrétant, par l'intermédiaire du champignon, des acides organiques.
Certains sont fixateurs de l'azote atmosphérique (espèces nitrophiles), notamment les cyanolichens.
Ils sont de croissance très lente. En moyenne, la croissance annuelle est de 0,5 à 2 mm pour les lichens crustacés, de 0,5 à 4 mm pour les lichens foliacés et de 1,5 à 5 mm pour les lichens fruticuleux. Une même espèce peut cependant présenter des taux de croissance très différents en fonction des facteurs environnementaux (climat, nature du substrat, pollution…). Les lichénologues considèrent qu'une croissance de 1 cm/an est élevée[34]. Cette caractéristique explique que les lichens résistent peu à la compétition avec des végétaux à développement plus rapide, lesquels inhibent la croissance des espèces pionnières. Elle rend compte aussi de la longévité des lichens qui vivent souvent très longtemps. S'il existe quelques espèces qualifiées d'éphémères (plusieurs du genre Vezdaea (en) ne vivent pas plus d'une année), beaucoup sont capables de survivre plus de 1 000 ans[35], par exemple des alpins[36]. L'espèce Rhizocarpon geographicum vit jusqu'à 4 500 ans dans des zones froides et arides[37]. Cette croissance lente et cette longévité sont utilisées par la lichénométrie.
Écologie
Répartition et habitats


Cosmopolites et ubiquistes, les lichens recouvrent près de 8 % de la surface terrestre de la planète[39]. Ils forment les communautés d'espèces autotrophes dominantes dans les écosystèmes polaires et subpolaires[40], où la photosynthèse de certains lichens comme Cladonia alcicornis est toujours effectuée à des températures avoisinant −20 °C[41]. Plusieurs espèces sont pionnières, capables de coloniser des milieux extrêmes. Elles peuvent s'installer sur des roches qu'elles corrodent en sécrétant des acides lichéniques. Leur action favorise la succession par des bryophytes, puis par d'autres plantes supérieures[42].
Les lichens ont colonisé pratiquement tous les milieux, « depuis les rochers maritimes jusqu'au sommet des montagnes, en passant par les déserts arides. Il n'y a guère que la haute mer, les zones fortement polluées et les tissus animaux où ils font défaut[43] ». Ils sont décrits en fonction de leur substrat[44] :
- épiphytes (sur les arbres/branches, voire sur le bois mort : espèces lignicoles) et même follicoles (vivant par exemple sur des feuilles persistantes de buis) ;
- saxicoles : épilithes vivant sur les rochers siliceux ou calcaires (notamment sur les blocs erratiques[45]), mais qu'on retrouvera sur les vieux murs, les tuiles, ardoises, lauzes ou tôles amiante-ciment, voire sur des supports plastiques ou métalliques (localisation selon la nature et la cohérence de la roche, la pente du rocher, les parois d'orientation, l'exposition aux pluies et écoulements d'eau, l'humidité de la surface déterminée par des suintements — roche très fissurée ou poreuse — ou des condensations atmosphériques, la position relative de l'arbre selon qu'il soit isolé ou en massif, en situation ouverte ou fermée...)[46] ; endolithes vivant dans les rochers ; crypto-endolithes vivant sous les rochers ;
- corticoles (espèce qui se développe sur les écorces des troncs, des branches, mais ne les parasite pas). De nombreux facteurs conditionnent l'installation de l'espèce : l'âge de l'arbre et le type d'essence qui influent sur la nature chimique de l'écorce, la texture de l'écorce (crevassée, rugueuse ou lisse) et sa capacité à s'exfolier qui déterminent le pouvoir de rétention de l'eau ;
- terricoles et humicoles (qui poussent dans pelouses, landes, bois clairs, à l'abri de la compétition des plantes à fleurs[47]) ;
- muscicoles (sur les mousses) ;
- foliicoles (sur les feuilles, particulièrement des plantes sempervirentes)
- lichénicoles (commensaux ou parasites sur d'autres lichens) ;
- préférence pour les substrats enrichis en dépôts de poussières atmosphériques (espèces coniophiles qui trouvent dans cette source l'azote ou le phosphate dont elles ont plus besoin que d'autres) apportées notamment sur les bords des routes, dans le bas des arbres, sur les toitures (espèces stégophiles) ;
- et même des micro-lichens sur les coquilles de patelle[20].
Successions de peuplement
Les successions de peuplement typiques de lichens peuvent se résumer schématiquement ainsi : colonisation du substrat (rocher, écorce) par des lichens à thalle crustacé très réduit (endolithique des roches calcaires, épilithique des roches siliceuses, endophléode dans le cas des écorces), puis substitution par des lichens crustacés à thalle plus développé (épilithique ou épiphléode) auxquels succèdent des thalles placodiomorphes (lobés au pourtour) ou squamuleux. Ces derniers sont relayés par de petits lichens foliacés qui, à leur tour sont évincés par de grands foliacés, puis par des fruticuleux et enfin par des bryophytes[48].

 Lecanora carpinea sur rhytidome lisse de troncs, branches et branchettes de feuillus
Lecanora carpinea sur rhytidome lisse de troncs, branches et branchettes de feuillus Xanthoria parietina est un lichen nitrophile[alpha 5] qui a tendance à recouvrir Caloplaca marina (en) et Verrucaria maura, ce qui témoigne d'une croissance plus rapide.
Xanthoria parietina est un lichen nitrophile[alpha 5] qui a tendance à recouvrir Caloplaca marina (en) et Verrucaria maura, ce qui témoigne d'une croissance plus rapide.
Résistance aux conditions extrêmes

Les lichens ont la capacité de résister à de très fortes dessiccations (phénomène de poïkilohydrie). Certains lichens peuvent vivre avec une teneur en eau de 15 %[49]. Ils sont aussi capables de se réhydrater (faculté de reviviscence)[50], l'absorption hydrique pouvant être telle que les phycolichens renferment jusqu'à 250 à 400 % d'eau, 600 à 2500 % (voire plus) chez les cyanolichens[49].
La résistance hydrique des lichens provient surtout du mycobionte qui sécrète des polysaccharides autour de l'hyphe, créant ainsi une zone qui piège l'eau sous forme colloïdale. De plus, les lichens accumulent des polyols, qui servent de réserve d'eau. La reprise du métabolisme après une sécheresse est très rapide. Le lichen retrouve ses capacités métaboliques de cinq à trente minutes après une réhydratation[51].
Les lichens peuvent également survivre à des variations de température importantes : des tests en laboratoire montrent leur résistance à de hautes températures (90 °C), à l'azote liquide (−196 °C)[52]. Ils sont ainsi des constituants majeurs des déserts froids de l'Antarctique[53].
En 2005, deux espèces de lichens ont été envoyées dans l'espace et exposées au vide durant deux semaines. Les résultats montrent que, de retour sur Terre et après réhydratation, les lichens survivent à ces conditions extrêmes (dessiccation, températures très basses, rayons UV intenses et rayonnements ionisants) et qu'ils ne présentent quasiment aucune altération de leur structure par rapport à des lichens témoins restés sur Terre[54].
Cette résistance à certains stress biotiques et abiotiques (défense contre les agents pathogènes, capacité de supporter de grands écarts de températures ou d'humidité, capacité de bioaccumuler certains métaux lourds et radioéléments dans leur thalle, capacité de dégrader des parties vieillissantes du thalle…), associée à leur autotrophie, fait des lichens des organismes pionniers par excellence[55].
Consommateurs de lichens
Les chenilles des papillons suivants se nourrissent de lichens :
- la Lithosie aplatie (Eilema complana, Erebidae),
- la Lithosie plombée (Eilema lurideola, Erebidae),
- le Manteau jaune (Eilema sororcula, Erebidae),
- la Ménagère (Dysauxes punctata, Erebidae),
- la Rosette (Miltochrista miniata, Erebidae),
- la Boarmie des lichens (Cleorodes lichenaria, Geometridae),
- la Bryophile vert-mousse (Cryphia algae, Noctuidae).
D'autres animaux, des mammifères tels le yack ou le renne, consomment des lichens[56].
Parasites de lichens
Certains champignons ne vivent que sur les lichens en tant que parasites obligatoires. Ceux-ci sont appelés champignons lichénicoles et sont une espèce différente du champignon vivant à l'intérieur du lichen ; ils ne sont donc pas considérés comme faisant partie du lichen[57].
Intérêt écologique
Dans l'écosystème, les lichens sont une des composantes parfois importante de la biodiversité[58].
Ils sont aussi une source importante de nourriture pour de nombreuses espèces, notamment les rennes. Certaines chenilles de papillons nocturnes, par exemple Noctua promissa, Noctua sponsa, Noctua nupta et Catocala nupta, étaient autrefois dites « lichenées » ou « likenées » parce qu'elles se nourrissent des lichens qui poussent sur les arbres[59].
Ils jouent aussi un rôle important en captant les particules de l'air et des pluies, contribuant à l'épuration permanente des milieux et au recyclage des éléments. Ils se nourrissent de ce que leur apportent l'air et les eaux météoriques et les particules, excréments, pollens, etc., qu'ils peuvent intercepter et capter. Ils sont capables de faire des réserves et d'accumuler des composés minéraux, bien au-delà des besoins de leur organisme. Cette bioaccumulation est extracellulaire et se fait par le mycobionte. Cela présente des avantages (ex. : réserve d'éléments comme le phosphore), mais également des inconvénients, comme l'accumulation d'éléments toxiques, voire de radionucléides (par exemple après les essais nucléaires dans l'air ou après la catastrophe de Tchernobyl).
Ils permettent, dans certaines conditions, d'évaluer la chimie et la stabilité des sols, la hauteur moyenne de l'enneigement, l'âge des moraines et le recul des glaciers (datation par lichénométrie), le type de gestion forestière, la durée de la continuité d'un état forestier[alpha 6] ; la quantité de polluants dans un milieu donné (les lichens concentrent notamment les métaux lourds — plomb, fluor — et certains radioéléments ou acides dissous dans l'humidité atmosphérique, ce qui peut entraîner leur mort), et surtout le degré de pureté de l'atmosphère (évalué par l'IAP — index of atmospheric purity, indice de pureté de l'air — prenant en compte le nombre, la polluotolérance et la fréquence des lichens sur un site donné, et l'ILD — index of lichen diversity, indice de diversité lichénique — relevant les lichens épiphytes sur les quatre faces des arbres à l'aide d'une grille d'observations)[61].
Cette dernière propriété a été mise en évidence pour la première fois par le lichénologue William Nylander, qui a décrit 3 000 espèces et remarqué que plusieurs d'entre elles régressaient à l'approche des villes. Il a donc mis en place des bioindicateurs de la qualité de l'air. Depuis, de nombreux lichens sont utilisés en biosurveillance comme indicateurs de pollution[62] ou comme informant sur l'origine des certaines pollutions[63].
Une carte de répartition des lichens et des associations lichéniques (technique de phytosociologie) apporte des éléments sur la localisation de zones plus ou moins polluées. La disparition actuelle en ville de certains lichens sensibles notamment au dioxyde de soufre montre que la pollution acide a diminué; des espèces nitrophiles (lichens orange ou gris sur les arbres) se développent au détriment des espèces neutrophiles ou acidophiles (nitrophobes), montrant l'augmentation de la pollution par les oxydes d'azote. En zone très polluée, on trouve surtout des lichens crustacés, alors qu'en zone moyennement polluée on a surtout des fruticuleux et en zone peu polluée, essentiellement des foliacés et des fruticuleux[20]. Des corrélations ont été observées entre le taux d'azote dans les lichens nitrophiles et l'incidence du trafic routier ou la distance à une usine polluante[64].
.JPG.webp) Protoparmeliopsis muralis très commune même en zone urbaine, cette espèce étant poluotolérante.
Protoparmeliopsis muralis très commune même en zone urbaine, cette espèce étant poluotolérante. Ramalina farinacea, espèce toxicotolérante dont les spécimens de zones polluées sont plus courts et vert foncé.
Ramalina farinacea, espèce toxicotolérante dont les spécimens de zones polluées sont plus courts et vert foncé. Parmelia sulcata utilisée en biosurveillance pour ses capacités accumulatrices de métaux, de radioéléments et de polluants organiques.
Parmelia sulcata utilisée en biosurveillance pour ses capacités accumulatrices de métaux, de radioéléments et de polluants organiques.
Services écosystémiques
Alimentaires


Certains lichens contiennent des macromolécules de lichénine pouvant être dégradées en glucose au cours de la digestion[réf. nécessaire].
- Alimentation animale : les lichens des rennes (Cladonia rangiferina, Cladonia stellaris…) sont la nourriture essentielle du renne et du caribou[65]. Au Canada, d'immenses troupeaux de caribous lui doivent leur survie, durant les longs mois d'hiver. En toundra ou en forêt tempérée du Nord (où les espèces de lichens sont dix fois plus nombreuses que les plantes[réf. souhaitée]), c'est une nourriture appréciée du caribou, de l'élan d'Amérique (orignal) et de certains bétails à l'occasion. Plusieurs variétés de lichens sont comestibles pour eux (notamment Cetraria islandica qui contient 60 % de glucides[réf. souhaitée]), juste un choix de préférence, souvent dû pour certains aux choix de pâturage, aux saisons.
En Suisse, Evernia divaricata a été longtemps utilisé pour nourrir les chèvres en mauvaise saison. - Alimentation humaine : certains peuples nordiques consomment la mousse d'Islande (Cetraria islandica) en farine pour en faire des pains ou gâteaux. Divers Umbilicaria sont également consommés au Canada (les « tripes de roche »); Lasallia pustulata est également appelée « tripe de roche », ce lichen saxicole calcifuge ayant longtemps été utilisé comme aliment de famine[66]. Au Japon, Umbilicaria esculenta est consommé en soupe, en tenpura et en salade sous le nom de Iwatake イワタケ (岩竹, « bambou des roches »). En Asie (Crimée[Quoi ?], Iran…), Lecanora esculenta ou Rhizoplaca esculenta est couramment consommée par les paysans comme par les animaux. Parmotrema perlatum est utilisé comme épice dans la cuisine de certaines régions de l'Inde, en particulier la cuisine chettinad du Tamil Nadu. La plupart des espèces de lichens sont considérées comme « comestibles » à condition de les faire macérer et bouillir pour en retirer les composés acides et amers. Quelques espèces (Cetraria pinastri, Letharia vulpina, Xanthoparmelia chlorochroa dont le simple contact peut entraîner des réactions allergiques) sont très toxiques car elles contiennent de l'acide vulpinique, toxine qui agit en stoppant l'activité respiratoire. L'ébullition ne permet d'extraire qu'une partie de cette toxine[67].
- Enfin, quelques espèces sont utilisées comme émulsifiant et épaississant dans l'industrie agroalimentaire.
Médicinaux

La médecine traditionnelle, se basant sur la théorie des signatures, utilisait des espèces comme le lichen d'Islande (Cetraria islandica), la pulmonaire (Lobaria pulmonaria), le lichen pyxidé (Cladonia pyxidata) autrefois réputés pour la toux, et le lichen du chien (Peltigera canina). L'usnée du crâne humain (Usnea plicata) récoltée sur le crâne des pendus, se payait à prix d'or pour guérir, croyait-on, l'épilepsie.

Si cette pharmacopée est aujourd'hui tombée dans l'oubli et certaines croyances des anciens font désormais sourire, la recherche médicale moderne (notamment en industrie pharmaceutique et en microbiologie) ne tarit plus d'éloges et nourrit des espoirs thérapeutiques[réf. nécessaire]. Les lichens contiennent 1 000 métabolites lichéniques, molécules à 90 % originales ayant lors des tests des scores d'activité du même ordre que ceux des médicaments phytothérapeutiques[réf. souhaitée]. On teste actuellement ses propriétés antibiotiques, anti-inflammatoires, insecticides, photoprotectrices (cas de l'Usnea longissima) ou photostimulatrices[68].
Exemples d'applications :
- L'herbe aux poumons (Lobaria pulmonaria) dont le thalle a la forme de poumons et est très sensible à la présence de dioxyde de soufre. Espèce souvent présente sur les érables, dans des forêts où la qualité de l'air est bonne, elle soignait les infections respiratoires et la pharmacognosie a montré son efficacité actuelle dans un sirop antitussif[réf. nécessaire].
- Des extraits d'Umbilicaria esculenta se sont révélés fortement inhibiteurs de la β-glucosidase, les enzymes qui hydrolysent les disaccharides chez les moisissures et les cellules de mammifères, ainsi que la glucoamylase et de la laminarinase. Elle a des propriétés thrombolytiques[réf. nécessaire].
Une étude de 2011 met en évidence et compare l'activité antioxidante, antimicrobiale and anticancéreuse des lichens Cladonia furcata, Lecanora atra et Protoparmeliopsis muralis[69].
Les lichens renferment une substance amylacée mucilagineuse, la lichénine[réf. souhaitée], à laquelle on a reconnu des propriétés nutritives et médicamenteuses[réf. nécessaire]. Ce mucilage a la faculté de se gorger d'eau, facilitant le transit intestinal et augmentant la sensation de satiété [réf. nécessaire].
Industrie teinturière

Les lichens sont utilisés en teinture végétale[71]. On tire des acides lichéniques des colorants de nuances assez riches. De belles teintes de bleu, pourpre (rouge violacé) et violet sont données par la parelle d'Auvergne, Ochrolechia parella, l'orseille des Canaries (Roccella tinctoria qui, extrait en poudre, produit le papier de tournesol ou le colorant alimentaire orcéine). D'autres espèces sont utilisées traditionnellement, notamment en Scandinavie :Candelaria, Rocella phycopsis, Rocella fuciformis, Ochrolechia tartarea, Pertusaria dealbescens, Parmelia glabratula subsp. fuliginosa et Lasallia pustulata. Les Xanthoria pilés et mélangés à de l'urine servaient à teindre la laine en rose, notamment du kilt écossais[72]. La teinture traditionnelle de ces kilts obtient encore aujourd'hui différentes teintes selon l'espèce de lichen et le temps de décoction dans l'eau bouillante[73].
Parfumerie

Certains lichens sont utilisés pour produire des huiles essentielles de parfum. L'industrie parfumière tire notamment parti de deux lichens fruticuleux récoltés sur les arbres : la mousse des arbres (Pseudevernia furfuracea, corticole des conifères, que l'on trouve souvent au sol, détachée par le vent) qui apporte des notes boisées variées en fonction de son arbre support, et la mousse de Chêne (Evernia prunastri) qui apporte des notes marines utilisées dans les parfums féminins. On extrait de ces lichens un produit fondamental en parfumerie, l'absolue mousse considérée comme une note de fond, capable de produire des notes boisées avec des nuances de champignons et d'algues[74]. Près de 9 000 t de ces deux espèces étaient récoltées annuellement dans la région de Grasse, des Balkans et au Maroc[75]. Cependant, cette récolte décline en raison de la présence dans ces extraits de composés allergènes, notamment l'atranorine[76]. Ces composés bioactifs sont ainsi de plus en plus remplacés par des produits synthétiques[77].
Iconographie

En raison de leur taille réduite, de leur discrétion et de leur abondance, les lichens sont rarement représentés dans les arts[78].
Autres
Durant la préhistoire, les mèches utilisées pour l'allumage des lampes à graisse sont des champignons (amadouvier), des algues, des mousses séchées, mais aussi des lichens fruticuleux séchés prélevés le plus souvent sur des branches d'arbres ou d'arbustes (tel qu'Evernia prunastri) ou au sol[79].
Toxicité
On a prétendu jadis qu'aucun lichen n'était vraiment vénéneux[80], à l'exception de quelques troubles intestinaux provoqués par les espèces très amères. Par la suite, on a rapporté l'utilisation de Letharia vulpina (corticole des mélèzes ou pins alpins, sa couleur vert-jaunâtre est due à l'acide vulpinique, toxique utilisé comme appât pour tuer les loups et renards) et Cetraria pinastri en Scandinavie pour empoisonner les loups. Le principe toxique agirait par inhibition de la respiration, entraînant la mort[81].
L'orseille extraite (voir au chapitre précédent) a été interdite comme colorant alimentaire à cause de sa toxicité.
Depuis, comme pour les champignons, la liste des lichens toxiques ne cesse de s'allonger, parmi lesquels :
- Letharia vulpina, Cetraria pinastri, Xanthoparmelia chlorochroa.
Histoire évolutive

Les partenaires de la symbiose ont d'abord existé sous forme d'espèces libres dans le milieu marin : bactéries, algues cellulaires à la superficie des eaux et microchampignons aquatiques. La conquête des terres émergées par des bactéries au cours de l'Archéen, puis par des algues et des champignons microscopiques au Protérozoïque, se traduit initialement par la colonisation des pentes marécageuses puis par la terre ferme. Au cours de l'évolution, des espèces fongiques exploitent des ressources fournies par un autre individu non apparenté (algues ou cyanobactéries), au détriment de celui-ci, développant un parasitisme nécrotrophe : des champignons surexploitent les ressources de leur partenaire au point de le faire mourir, se nourrissant de ses restes avant de capturer de nouveaux individus. Ces espèces ont pu aussi établir un autre mode de relation trophique, le parasitisme biotrophe, interaction biologique stable lorsque l'individu parasité élabore des mécanismes de défense suffisamment puissants pour éviter sa mort mais pas assez pour éliminer le parasite. Cette symbiose parasitaire a pu évoluer en symbiose mutualiste qui, de facultative devient obligatoire à mesure que le degré de dépendance entre les deux partenaires augmente[82]. En effet, une vraie conversion parasitisme-mutualisme est possible si des mutations favorables à la symbiose se produisent dans le génome de l'espèce parasite ou parasitée. L'exemple typique est la mutation délétère de gènes fabriquant des protéines produites par le partenaire, ce qui permet une économie métabolique. L'inactivation de ces gènes devenus inutiles, entraîne leur disparition du génome à l'occasion de délétions ou leur transformation en pseudogènes, et engage les deux partenaires sur une voie évolutive sans retour, la dépendance[83].
Ainsi, selon Marc-André Selosse, « Les lichens sont un succès évolutif, en raison de leur réussite en conditions hostiles, mais représentent probablement une impasse évolutive sur le plan morphogénétique. La stratégie poïkilohydrique adoptée par ces organismes, et peut-être les faux tissus du partenaire fongique, limitent la complexification morphologique, en sorte que le plan d'organisation reste peu élaboré[84] ».
Systématique
On donne des noms scientifiques séparés à chaque champignon et à chaque algue qui constituent un lichen, mais pas de nom unique à la combinaison particulière de ces espèces, en tout cas en 2011. Quand on dit qu'un lichen appartient à une espèce, c'est en fait l'espèce du principal champignon qui le constitue, même si celui-ci forme des lichens d'apparences différentes avec plusieurs espèces d'algues séparément[85],[86].
La classification d'Alexander Zahlbruckner (1860-1938) (1907, 1926), malgré son ancienneté, garde une valeur pratique face aux classifications récentes souvent incomplètes. Elle décompose la classe des lichens selon le schéma suivant :
- Sous-classe des Ascolichenes : spores produites dans des asques.
- Série des Pyrenocarpeae : ascocarpes ne s'ouvrant que par un pore, thalles en général crustacés (environ dix-sept familles).
- Série des Gymnocarpeae : ascocarpes plus ou moins largement ouverts, thalles de tous les types.
- Sous-série des Graphidineae : asques et paraphyses se détruisant et formant avec les spores, dans l'ascocarpe, un amas pulvérulent. Le thalle est en majorité crustacé, ou fruticuleux. Il existe trois familles.
- Sous-série des Cyclocarpineae : ascocarpes de forme arrondie. C'est le groupe le plus nombreux, où se trouvent tous les types de thalles. Il existe vingt-neuf familles.
- Sous-classe des Basidiolichenes (ou Hymenolichenes) : spores produites sur des basides. Il existe trois genres en tout avec moins de vingt espèces, qui sont tropicales.
Une autre classification est basée sur le composant fongique qui joue le rôle principal dans la détermination de la forme générale du lichen :
|éditeur= Académie de Lyon / Ressources pour l'enseignement de la biologie
Les lichens comme les autres espèces sont identifiés au moyen de clés de détermination (Exemple[87]), mais des analyses chimiques ou génétiques, ou l'utilisation d'indicateurs colorés peuvent être nécessaires pour identifier avec certitude certaines espèces ou leur composantes fongiques et algales.
Dans la culture
Dans le calendrier républicain, le Lichen est le 17e jour du mois de pluviôse[88].
Les lichens inspirent de nombreux artistes romantiques ou naturalistes, écrivains (Marcel Proust, Rousseau, George Sand), poètes (Henry David Thoreau, Francis Ponge), peintres (Christian Dotremont, Jasper Johns), plasticiens (Robert Rauschenberg, John Cage)[89]…
Notes et références
Notes
- On ne peut le détacher de son substrat qu'en l'abîmant fortement.
- Les thalles lépreux (exemples : Lepraria, Chrysothrix (en)) considérés comme primitifs, parviennent à constituer de grandes surfaces farineuses, surtout sur des substrats ombragés et protégés des eaux de ruissellement pour éviter leur lessivage.
- Murs, béton, mortier, tuiles…
- Lepraria incana se développe dans des endroits ombragés (sciaphile) et abrités des précipitations directes (ombrophobe), sous des rochers acides en surplomb ou à la base des arbres âgés, dans les cavités non directement exposées à l'écoulement des pluies.
- La pollution azotée d'origine automobile et agricole modifie la composition spécifique des communautés lichéniques, en favorisant le développement de quelques espèces nitrophiles résistantes à la pollution (de), sans valeur patrimoniale (Xanthoria sp., Physcia sp.). Voir Haluwyn, Asta & Boissière 2012, Lichens des arbres, p. 231.
- En Suède, l'étude de 150 placettes de hêtraies a montré que, si les mousses se montrent assez peu affectées par une interruption de la continuité temporelle de l'état forestier, les lichens y sont sensibles : ils sont nettement plus diversifiés dans les forêts anciennes (350 ans ou plus dans cette étude) que récentes (moins de 160 ans)[60].
Références
- Haluwyn & Asta 2012, Lichens des sols, p. 172-195.
- Haluwyn & Asta 2012, Lichens des sols, p. 172-195.
- Haluwyn & Asta 2012, Lichens des sols, p. 172-195.
- Haluwyn & Asta 2012, Lichens des sols, p. 172-195.
- [Hock et al. 2012] (en) Bertold Hock (éd.) et al., Fungal Associations, Springer Science, (ISBN 978-3-662-07334-6), p. 318.
- [Gadd 2010] (en) Geoffrey Michael Gadd, « Metals, minerals and microbes: geomicrobiology and bioremediation », Microbiology, vol. 156, no 3, , p. 609-643 (PMID 20019082, DOI 10.1099/mic.0.037143-0).
- [McCune et al. 2007] (en) Bruce McCune, Jill Grenon, Linda S. Mutch et Erin P. Martin, « Lichens in relation to management issues in the Sierra Nevada national parks », Pacific Northwest Fungi, vol. 2, no 3, , p. 1-29 (DOI 10.2509/pnwf.2007.002.003, lire en ligne [sur openjournals.wsu.edu]).
- (en) « Lichens: Systematics », sur ucmp.berkeley.edu, University of California Museum of Paleontology (consulté en ).
- [Feuerer & Hawksworth 2007] (en) Tassilo Feuerer et David L. Hawksworth, « Biodiversity of lichens, including a world-wide analysis of checklist data based on Takhtajan floristic regions », Biodiversity Conservation, , p. 85-98.
- [Le Tacon & Selosse 1997] François Le Tacon et Marc-André Selosse, « Le rôle des mycorhizes dans la colonisation des continents et dans la diversification des écosystèmes terrestres », Revue Forestière Française, vol. 49, no spécial, , p. 15-24 (lire en ligne [PDF] sur documents.irevues.inist.fr, consulté en ).
- Théophraste, Histoire des plantes, Livre III, chap. 11 Des signes du temps.
- Haluwyn & Lerond 1993.
- [Schwendener 1868] Simon Schwendener, « Untersuchungen über den Flechtenthallus », Beiträge zur wissenschaftliche Botanik, vol. VI, , p. 195-207 (lire en ligne [sur gallica], consulté en ).
- [Frank 1877] (de) Albert-Bernhardt Frank, « Über die biologischen Verhältnisse des Thallus einiger Krustenflechten », Beiträge zur Biologie der Pflanzen, vol. 2, , p. 123-200 (lire en ligne [PDF] sur zobodat.at, consulté en ).
- [Bary 1879] Anton de Bary, « Ueber Symbiose » [« De la symbiose »], Tageblatt für die Versammlung deutscher Naturforscher und Aerzte (in Cassel) [Compte-rendu journalier de la Conférence des physiciens et scientifiques allemands à Cassel], Revue internationale des sciences, vol. 3, , p. 301-309 (lire en ligne [sur babel.hathitrust.org]).
- [Feuerer & Hawksworth 2007] (en) Tassilo Feuerer, David L. Hawksworth, « Biodiversity of lichens, including a world-wide analysis of checklist data based on Takhtajan's floristic regions », Biodiversity and Conservation, vol. 16, no 1, , p. 85 (lire en ligne [sur researchgate.net]).
- Haluwyn & Lerond 1993, p. 113.
- [Högnabba et al. 2009] (en) Filip Högnabba, Soili Stenroos, Arne Thell et Leena Myllys, « Evolution of cyanobacterial symbioses in Ascomycota », dans André Aptroot, Mark R.D. Seaward & Laurens B. Sparrius, Biodiversity and Ecology of Lichens. Liber Amicorum Harrie Sipman, J. Cramer Verlag, coll. « Bibliotheca Lichenologica » (no 99), , 439 p. (ISBN 978-3-443-58078-0, ISSN 1436-1698, résumé, présentation en ligne), p. 163-184.
- [Honegger 2012] Rosmarie Honegger, « Differential gene expression within the cyanobacterial cell population of a lichen thallus », New Phytol., no 196, , p. 657–660 (lire en ligne [sur nph.onlinelibrary.wiley.com]).
- Haluwyn, Asta & Boissière 2012, Lichens des arbres.
- [Spribille et al. 2016] Toby Spribille, Veera Tuovinen, Philipp Res, Dan Vanderpool, Heimo Wolinski, M. Catherine Aime, Kevin Schneider, Edith Stabentheiner, Merje Toome-Heller, Göran Thor, Helmut Mayrhofer, Hanna Johannesson et John P. McCutcheon, « Basidiomycete yeasts in the cortex of ascomycete macrolichens », Science, vol. 353, no 6298, , p. 488-492 (ISSN 0036-8075 et 1095-9203, PMID 27445309, DOI 10.1126/science.aaf8287, résumé, lire en ligne [sur science.sciencemag.org], consulté en ).
- « Un troisième joueur surprise dans l'association symbiotique du lichen ? », sur CIFAR, (consulté en ).
- [Grube et al. 2009] (en) Martin Grube, Massimiliano Cardinale, João Vieira De Castro, Jr., Henry Müller et Gabriele Berg, « Species specific structural and functional diversity of bacterial communities in lichen symbioses », The ISME Journal (International sociéty for Microbial Ecology, vol. 3, no 9, , p. 1105–1115 (DOI 10.1038/ismej.2009.63, lire en ligne [sur academia.edu]).
- Haluwyn & Lerond 1993, p. 15.
- Haluwyn & Lerond 1993, p. 11.
- Haluwyn, Asta & Boissière 2012, Lichens des arbres, p. 10.
- [Clauzade & Eondon 1966] Georges Clauzade et Yves Rondon, « Types morphologiques et types biologiques chez les Lichens », Bulletin de la Société Botanique de France, vol. 113, , p. 63 (DOI 10.1080/00378941.1966.10838474).
- [McCune & Goward 1995] (en) Bruce McCune et Trevor Goward, Macrolichens of the Northern Rocky Mountains, Mad River Press, , 208 p. (ISBN 0916422828 et 978-0916422820), p. 93.
- What is a lichen?, Australian National Botanical Garden.
- Haluwyn & Lerond 1993, p. 65-66.
- [Awasthi 2000] (en) Dharani Dhar Awasthi, A Hand Book Of Lichens, éd. Bishen Singh Mahendra Pal Singh, , 146 p. (ISBN 8121101816 et 9788121101813), p. 25.
- [Sérusiaux, Diederich & Lambinon 2004] Emmanuël Sérusiaux, Paul Diederich et Jacques Lambinon, « Les macrolichens de Belgique, du Luxembourg et du nord de la France », Ferrantia, Musée national d'histoire naturelle Luxembourg, no 40, , p. 84 (ISSN 1682-5519, lire en ligne [PDF] sur orbi.uliege.be).
- [Martin] Francis Martin, « Plantes et champignons, des associations à bénéfice réciproque », conférence à la Cité des Sciences et de l'Industrie [vidéo, 1h 54'], sur youtube.com, éd. Cité des Sciences et de l'Industrie, (présentation en ligne, consulté en ).
- (en) Vertika Shukla, Geeta Pant Joshi et M.S.M. Rawat, « Lichens as a potential natural source of bioactive compounds: A review », Phytochemistry Reviews, vol. 9, no 2, , p. 304 (DOI 10.1007/s11101-010-9189-6).
- [Nash 1996] (en) Thomas H. Nash (en), Lichen Biology, Cambridge University Press, , p. 5.
- Aline Raynal-Roques, La botanique redécouverte, Musée national d'histoire naturelle Luxembourg, coll. « Humensis », p. 17.
- [Matthews et al. 2012] (en) John A Matthews, The SAGE Handbook of Environmental Change (2 vol. : vol. 1: Approaches, Evidences and Causes ; vol. 2 : Human Impacts and Responses), SAGE, (ISBN 9780857029386 et 9780857029393), p. 105.
- Haluwyn, Asta & Boissière 2012, Lichens des arbres, p. 181.
- [Ahmadjian 1995] (en) Vernon Ahmadjian, « Lichens are more important than you think », BioScience, vol. 45, no 3, , p. 124 (DOI 10.1093/bioscience/45.3.124).
- [Longton 1988] (en) Royce E. Longton, Biology of Polar Bryophytes and Lichens, CUP Archive, (ISBN 9780511565212, DOI 10.1017/CBO9780511565212), p. 391.
- [Lange & Kappen 2013] Otto L. Lange et Ludger Kappen, « Photosynthesis of lichens from Antarctica », dans George A. Llano (éd.), Antarctic Terrestrial Biology, Washington, D. C., American Geophysical Union, Antarctic research series (vol. 20), , 322 p. (ISBN 978-1-118-66466-7, présentation en ligne), p. 83–95.
- [Roux 1981] Claude Roux, Étude écologique et phytosociologique des peuplements lichéniques saxicoles-calcicoles du sud-est de la France, Vaduz, éd. J. Cramer, coll. « Bibliotheca lichenologica » (no 15), , 557 p. (ISBN 3-7682-1301-3, présentation en ligne), p. 202.
- Haluwyn, Asta & Boissière 2012, Lichens des arbres, p. 17.
- Haluwyn & Lerond 1993, p. 103.
- [Epard, Gex & Vust 2020] Jean-Luc Epard, Pierre Gex et Mathias Vust, « Les blocs erratiques propriété de la société vaudoise des Sciences Naturelles », Bulletin de la Société vaudoise des Sciences Naturelles, vol. 99, , p. 29-66 (ISSN 0037-9603). On y a notamment mis en évidence 16 lichens signalés pour la première fois dans le canton de Vaud en 2020.
- .
- [Vust 2011] Mathias Vust, Lichens terricoles de Suisse : diversité, écologie, répartition et précarité (thèse de doctorat de 2002, université de Genève), coll. « Mémoire de la Société vaudoise des Sciences naturelles » (no 24), , 352 p. (présentation en ligne).
- [Klement 1955] (de) Oscar Klement, « Prodromus der mitteleuropäischen Flechtengesellschaften », Feddes Rep. Beih., vol. 135, no 1, , p. 5–194 (présentation en ligne).
- Nash 1996, p. 92.
- Haluwyn & Lerond 1993, p. 119.
- [Grube & Berg 2009] (en) Martin Grube et Gabriele Berg, « Microbial consortia of bacteria and fungi with focus on the lichen symbiosis », Planta, vol. 23, , p. 1287-1297 (lire en ligne [sur bashanfoundation.org]).
- [Aubert et al. 2007] (en) Serge Aubert, Christine Juge, Anne-Marie Boisson, Elisabeth Gout et Richard Bligny, « Metabolic processes sustaining the reviviscence of lichen Xanthoria elegans in high mountain environments », Planta, vol. 226, no 5, , p. 76 (résumé, lire en ligne [PDF] sur hal.archives-ouvertes.fr).
- Selosse et Le Tacon 2001, p. 5.
- [Sancho et al. 2007] Leopoldo G. Sancho, Rosa de la Torre Noetzel, Gerda Horneck, Carmen Ascaso, Asunción De los Ríos, Ana Pintado, J. Wierzchos et Martin Schuster, « Lichens survive in space: results from the 2005 LICHENS experiment », Astrobiology, vol. 7, no 3, , p. 443-454 (lire en ligne [sur researchgate.net]).
- [Seaward et al. 1977] (en) Mark R.D. Seaward (dir.), Lichen Ecology, Londres / New York / San Francisco, Academic Press, , X pl. + 550 (ISBN 0126343500 et 9780126343502, présentation en ligne), p. 25-55.
- [Lawrey 1983] (en) James D. Lawrey, « Lichen Herbivore Preference: A Test of Two Hypotheses », American Journal of Botany, vol. 70, no 8, , p. 1188-1194 (résumé).
- [Lawrey & Diederich 2003] (en) James D. Lawrey et Paul Diederich, « Lichenicolous Fungi: Interactions, Evolution, and Biodiversity », The Bryologist, vol. 106, no 1, , p. 80-120 (DOI 10.1639/0007-2745(2003)106[0080:LFIEAB]2.0.CO;2, lire en ligne [PDF] sur lichenology.info, consulté en ).
- [Ellis 2012] Christopher J. Ellis, « Lichen epiphyte diversity: A species, community and trait-based review », Perspectives in Plant Ecology, Evolution and Systematics, vol. 14, no 2, , p. 131-152 (ISSN 1433-8319, résumé).
- Nouveau dictionnaire d'histoire naturelle appliquée aux arts, à l'agriculture, à l'économie rurale et domestique, à la médecine, etc., t. 17 : KAA-LIG, Paris, libr. Deterville, , sur books.google.fr (lire en ligne), p. 561.
- [Fritz, Gustafsson & Larsson 2008] Örjan Fritz, Lena Gustafsson et Krister Larsson, « Does forest continuity matter in conservation? - A study of epiphytic lichens and bryophytes in beech forests of Southern Sweden », Biological Conservation, no 141, , p. 655–668 (résumé, lire en ligne [sur ur.booksc.eu], consulté en ).
- [Upreti et al. 2015] (en) Dalip Kumar Upreti, Pradeep K. Divakar, Vertika Shukla, Rajesh Bajpai et al., Recent Advances in Lichenology (2 vol. : Vol. 1 : Modern Methods and Approaches in Biomonitoring and Bioprospection ; vol. 2 : Modern Methods and Approaches in Lichen Systematics and Culture Techniques), Springer, , p. 89-91.
- [Kirschbaum & Wirth 1997] Ulrich Kirschbaum et Volkmar Wirth, Les lichens bio-indicateurs : les reconnaître, évaluer la qualité de l'air, éd. Ulmer, , 128 p. (ISBN 2-84138-080-7, présentation en ligne).
- (en) Liqin Wu, Cynthia Faye Isley, Heather K. Handley et Mark Patrick Taylor, « Atmospheric sources of anthropogenic and geogenic trace metals in Australian lichen and fungi », Anthropocene, vol. 33, , p. 100279 (ISSN 2213-3054, DOI 10.1016/j.ancene.2021.100279, lire en ligne, consulté le )
- [et al. 2006] Luisa Frati, E. Caprasecca, Sylvain Santoni, C. Gaggi, Anna Guttova, S. Gaudino, A. Pati, Silvia Rosamilia, S.A. Pirintsos et Stefano Loppi, « Effects of NO2 and NH3 from road traffic on epiphytic lichens », Environmental Pollution, no 142, , p. 58-64 (lire en ligne [sur academia.edu], consulté en ).
- [Aagnes, Sørmo & Mathiesen 1995] Tove Aagnes Utsi, Wenche Sørmo et Svein D. Mathiesen, « Ruminal microbial digestion in free-living, in captive lichen-fed, and in starved reindeer (Rangifer tarandus tarandus) in winter », Applied and Environmental Microbiology, vol. 61, no 2, , p. 583-591 (lire en ligne [sur researchgate.net]).
- [Allaby 2015] (en) Michael Allaby, The Dictionary of Science for Gardeners. 6000 Scientific Terms Explored and Explained, Timber Press, , 556 p. (ISBN 1604694831 et 978-1604694833), p. 434.
- Haluwyn, Asta & Boissière 2012, Lichens des arbres, p. 113.
- [Muggia, Schmitt & Grube 2009] (en) Lucia Muggia, Imke Schmitt et Martin Grube, « Lichens as treasure chests of natural products », SIM News, vol. 59, no 3, , p. 85-97.
- [Ranković, Kosanić & Stanojković 2011] (en) Branislav R Ranković, Marijana M Kosanić et Tatjana P Stanojković, « Antioxidant, antimicrobial and anticancer activity of the lichens Cladonia furcata, Lecanora atra and Lecanora muralis », BMC Complementary and Alternative Medicine, vol. 11, no 97, (lire en ligne [sur d-nb.info], consulté en ).
- Bolton 1991, p. 9.
- [Bolton 1991] (en) Eileen Bolton, Lichens for Vegetable Dyeing, Julia Bolton Holloway, , 43 p. (lire en ligne).
- [Gudin 2013] Claude Gudin, Histoire naturelle des microalgues, Odile Jacob, (ISBN 978-2-7381-2956-7), p. 87.
- [Lacoux & Engler 2010] Danièle Lacoux et Robert Engler, Regard sur les Lichens en Languedoc-Roussillon, Photobim, , 95 p. (ISBN 2917430044 et 9782917430040), p. 28.
- Haluwyn & Lerond 1993, p. 148.
- [Joulain & Guillamon 2002] (en) Daniel Joulain et José Manuel Guillamon, « Pseudevernia furfuracea ("treemoss") resinoid in fragrance compounding: Analytical issues », Annales du 46e Congrès sur les terpènes, huiles esentielles et la chimie aromatique (« Terpenes, Essential Oils and Aromatic Chemistry » ou TEAC), Tokushima (Koryo, Terupen oyobi Seiyu Kagaku ni kansuru Toronkai Koen Yoshishu), vol. 46, , p. 16–18.
- [Andraud-Dieu 2015] Amandine Andraud-Dieu, Recherche de molécules antimicrobiennes d'origine lichénique : Étude phytochimique de trois lichens & approche synthétique de deux composés actifs (thèse de doctorat en Chimie des substances naturelles, dir. Vincent Gloaguen, Vincent Chaleix et Marion Millot. Biologie moléculaire), Université de Limoges, , 299 p., sur tel.archives-ouvertes.fr (lire en ligne), p. 18.
- [Joulain & Tabacchi 2009] (en) Daniel Joulain et Raphaël Tabacchi, « Lichen extracts as raw materials in perfumery. Part 1: oakmoss », Flavor and Fragance Journal, vol. 24, no 2, , p. 49-61 (DOI 10.1002/ffj.1916, lire en ligne [PDF] sur onlinelibrary.wiley.com).
- [Pacini 1995] Ettore Pacini, « Purposes and manners of representation of plants in the European art of XIV - XVII centuries », dans D. Moe, J. H. Dickson & P. M. Jørgensen (éds.), Garden plants, species, forms and varieties from Pompei to 1800 (Symposium de Ravello, juin 1991), coll. « PACT Journal » (no 42), , 199 p. (présentation en ligne), p. 172.
- [Beaune 1987] Sophie A. de Beaune, « Lampes et godets au Paléolithique » (monographie), Gallia Préhistoire, no 23, supplément, (lire en ligne [sur persee]).
- [Malbranche 1870] Alexandre François Malbranche (en), Catalogue descriptif des lichens de la Normandie, Rouen, impr. de Lecointe frères, L. Deshays, (réimpr. 1882, impr. E. Cagniard), 2 planches + suppl. de 64 p. + 283, sur babel.hathitrust.org (lire en ligne).
- Henry des Abbayes (1931) - Traité de lichénologie, p. 185
- [Ahmadijian, Hale et al. 1967] (en) Vernon Ahmadijian, Mason E. Hale et al., The Lichens, Elsevier, (1re éd. 1967), 697 p. (présentation en ligne), p. 584-585.
- [Combes 1995] Claude Combes, Interactions durables. Écologie et évolution du parasitisme, Dunod, , 524 p. (ISBN 2100057537, présentation en ligne), p. 463.
- Marc-André Selosse et François Le Tacon, « Les stratégies symbiotiques de conquête du milieu terrestre par les végétaux », L'Année biologique, vol. 40, , p. 6 (lire en ligne [PDF] sur isyeb.mnhn.fr).
- [Kirk et al. 2008] (en) Paul M. Kirk, Paul F. Cannon, David W. Minter et Joost A. Stalpers, Dictionary of the Fungi, Wallingford, CABI, , 10e éd., 771 p., sur books.googe.com (ISBN 978-0-85199-826-8, lire en ligne), p. 378–381.
- [Lepp 2011] Heino Lepp, « Form and structure – Sticta and Dendriscocaulon », Australian lichens, sur anbg.gov.au, Australian National Botanic Gardens, (consulté en ).
- « Exemple de clé de détermination »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur ac-lyon.fr.
- [Fabre d'Églantine 1793] Ph[ilippe Fr[ançois] Na[zaire] Fabre d'Églantine, Rapport fait à la Convention nationale dans la séance du 3 du second mois de la seconde année de la République française, Paris, imprimé sur ordre de la Convention Nationale, , sur books.google.fr (lire en ligne), p. 23 (planche « Pluviose, cinquième mois »).
- [Zonca 2021] Vincent Zonca (préf. Emanuele Coccia), Lichens : Pour une résistance minimale, éditions Le Pommier, coll. « Symbiose », , 324 p., p. 11.
Voir aussi
Bibliographie
- [Clauzade & Roux 1985] Georges Clauzade et Claude Roux, « Likenoj de okcidenta europo », Société Botanique du Centre-Ouest, no 7 spécial, .
- [Haluwyn & Lerond 1993] Chantal Delzenne-Van Haluwyn et Michel Lerond, Guide des lichens, Lechevalier, , 344 p..

- [Haluwyn, Asta & Gavériaux 2010] Chantal Van Haluwyn, Juliette Asta et Jean-Pierre Gavériaux, « Compléments au Guide des Lichens de France. Tableaux d'aide à la détermination », Bulletin de l'Association française de Lichénologie, vol. 35, no 1, (lire en ligne [PDF] sur afl-lichenologie.fr, consulté en ).
- [Haluwyn, Asta & Boissière 2012] Chantal Van Haluwyn, Juliette Asta et Jean-Claude Boissière (en collaboration avec Jean-Claude Gavériaux), Guide des lichens de France. Lichens des arbres, Paris, Belin, coll. « Les Fous de Nature / Guide des lichens de France », , 239 p. (ISBN 978-2-7011-4700-0).

- [Haluwyn & Asta 2012] Chantal Van Haluwyn et Juliette Asta (en collaboration avec Jean-Claude Gavériaux), Guide des lichens de France. Lichens des sols, Paris, Belin, coll. « Les Fous de Nature / Guide des lichens de France », , 223 p. (ISBN 978-2-7011-5426-8).

- [Lawrey 1983] James D. Lawrey, « Vulpinic and Pinastric Acids as Lichen Antiherbivore Compounds: Contrary Evidence », The Bryologist, vol. 86, no 4, , p. 365-369 (résumé).
- [Roux et al. 2014] Claude Roux et al., Catalogue des lichens et champignons lichénicoles de France métropolitaine, t. 1 (texte), 2e édition 2017 revue et augmentée, Association française de lichénologie, (réimpr. 2017), 1171 p. (lire en ligne [PDF] sur afl-lichenologie.fr).
- [Souchon 1971] Christian Souchon, Les lichens, Paris, PUF, coll. « Que sais-je ? », .
- Marc-André Selosse et François Le Tacon, « Les stratégies symbiotiques de conquête du milieu terrestre par les végétaux », Année Biol., Institut de systématique moléculaire (IFR CNRS 1541), Muséum national d'histoire naturelle, Équipe de microbiologie forestière, UR 349 INRA, Centre de recherches forestières de Nancy, vol. 40, , p. 3-20 (lire en ligne)
Articles connexes
- Ethnolichénologie (en)
- Lichénologues
- Prototaxites
Liens externes
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- « Liste des lichens et des champignons lichénicoles de France » (consulté en ).
- « Association Française de Lichénologie » (consulté en ).
- (en) « Photos de lichens (illustrant les différents thalles, fructiculeux, foliacés ou crustacés) »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- « Lichens de Belgique, du Luxembourg et du nord de la France » (consulté en ).
- « Des centaines de photos de lichens », sur uklichens.co.uk (consulté en ).
- Portail de la mycologie