Ectomycorhize
Les ectomycorhizes sont une forme de symbiose mycorhizienne entre des champignons ascomycètes dont les truffes et surtout basidiomycètes dont les Bolets, les Amanites et les Russules et environ 10 % des espèces végétales vasculaires, essentiellement des arbres de l'hémisphère nord.

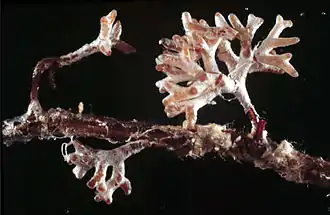
Dans cette association, le champignon forme un manchon cotoneux bien visible et souvent coloré autour de la racine. Il rentre légèrement à l'intérieur des premières cellules pour y former un réseau dense. En sa présence, la plante répond par la production de racines secondaires, ce qui augmente la surface de contact. Les deux partenaires s'échangent des nutriments : de l'eau et de sels minéraux pour la plante ; des sucres, des lipides et des vitamines pour le champignon.
Contexte évolutif
Au Dévonien, il y a 380 millions d'années, la lignine fait son apparition, permettant à certaines espèces végétales en possédant d'atteindre de grandes tailles[1]. En se décomposant, les tissus de ces végétaux produisirent d'importantes quantités de déchets ligneux.
À peu près à la même époque[2], les basidiomycètes et les ascomycètes, champignons capables de décomposer la lignine, divergent des gloméromycètes, qui forment déjà des mycorhizes arbusculaires. Les espèces végétales qui ont évolué de manière à former une symbiose avec les champignons décomposeurs de lignine, ont ainsi pu coloniser des substrats peu favorables aux mycorhizes arbusculaires, c'est-à-dire des substrats dont la richesse en phénols et en tannins permet l'accumulation de matière organique en préservant cette dernière des bactéries. De plus, grâce à leur capacité à altérer les minéraux, les champignons ectomycorhiziens ont permis la colonisation de certaines assises rocheuses[3].
Il semble que l'apparition des ectomycorhizes se soit faite indépendamment à plusieurs reprises au fil du temps[4].
Espèces de mycètes concernés


La majorité des espèces de champignons faisant des associations ectomycorhiziennes font partie de la division des basidiomycètes, mais on en trouve aussi plusieurs parmi les ascomycètes[3], et quelques-unes parmi les zygomycètes[5]. Malgré le fait que les mycorhizes arbusculaires soient la forme la plus répandue de symbiose mycorhizienne, le nombre d'espèces de champignons concernés demeure restreint (environ 200) par rapport au nombre d'espèces de champignons ectomycorhiziens, qui s'élève, selon certains auteurs, à des dizaines de milliers, réparties dans quelques centaines de genres[5],[3]. Le nombre exact demeure cependant difficile à mesurer, donc largement incertain[5],[6].
Contrairement aux champignons arbusculaires, que l'on n'a pas encore réussi à mettre en culture axénique, certaines espèces de champignons ectomycorhiziens s'avèrent faciles à cultiver. C'est notamment le cas des bolets, des amanites et des laccaires. D'autres espèces comme les truffes et les lactaires sont plus difficiles à cultiver, alors que d'autres demeurent impossible de culture[3].
Espèces végétales concernées

.png.webp)
La plupart des espèces végétales dont les racines forment des associations ectomycorhiziennes sont des plantes ligneuses, principalement des arbres et des arbustes gymnospermes et angiospermes vivant sur des sols assez pauvres et acides, où la minéralisation est lente. 80 % des associations mycorhiziennes correspondent à des endomycorhizes à arbuscules entre les plantes non ligneuses de l'hémisphère nord et la plupart des plantes des Tropiques et le groupe de champignon des Gloméromycètes, les ectomycorhizes ne représentant que 2 % des espèces végétales (on en dénombre environ 8 000), mais constituent 60 % de tous les arbres de la planète, ce qui montre leur succès évolutif[5],[7]. La plupart d'entre elles sont réparties parmi les Pinacées, les Araucariacées, les Cupressacées, les Gnétacées, les Polygonacées, les Nyctaginacées, les Myrtacées, les Salicacées, les Fabacées, les Fagales et les Malvales[4].
Beaucoup de ces associations ectomycorhiziennes seraient apparues lors de la Grande Coupure Éocène-Oligocène, caractérisée par un refroidissement climatique qui met en place les climats tempérés et boréaux actuels. Sous ces climats, l'altération et la minéralisation sont ralenties par les variations climatiques annuelles, ce qui crée des sols où les éléments biogènes sont piégés sous forme organique et minérale insoluble, favorisant ainsi ces types mycorhiziens[8].
Caractéristiques physionomiques


Comme l'indique son nom, la symbiose ectomycorhizienne ne présente pas de mycélium à l'intérieur des cellules des racines du végétal. Les hyphes du champignon forment plutôt le manchon, ou manteau, autour des radicelles et pénètrent entre les cellules du cortex de ces dernières pour former le réseau de Hartig. Ce réseau constitue le lieu d'échanges entre la plante, qui fournit du carbone organique, et le champignon, qui fournit divers nutriments tels l'azote et le phosphore[3],[9].
Au contraire des hyphes des champignons arbusculaires, qui sont des siphons cénocytiques (cytoplasme commun à de nombreux noyaux cellulaires n'étant pas séparés), les hyphes des champignons ectomycorhiziens sont cloisonnés[3]. Cette caractéristique offre des avantages dont il est question plus bas, dans la section Caractéristiques physiologiques.
Les racines ectomycorhizées sont morphologiquement différentes des racines non-ectomycorhizées. Premièrement, la production de poils absorbants est inhibée[10]. L'efficacité de ces structures est largement dépassée par celle du mycélium extraracinaire. Deuxièmement, le cortex s'hypertrophie, ce qui augmente l'espace disponible au réseau de Hartig. Troisièmement, comme cela est visible sur la photo ci-contre, les racines se ramifient davantage et leur croissance en longueur est moindre[3].
Écologie
La nature et composition du sol influent sur la mycorhization[11], qui peut aussi contribuer à la mobilisation et à des transferts horizontaux et verticaux de radionucléides (dont césium-137 des retombées de Tchernobyl[12]).
Alors que les endomycorhizes améliorent le prélèvement dans le milieu extérieur des nutriments minéraux qu'elles apportent à leur partenaire, les ectomycorhizes sont capables de mobiliser et de transférer vers la plante hôte les nutriments (carbone, mais aussi azote, notamment celui de la chitine, les ectomycorhizes participant à la décomposition de la nécromasse fongique et de leur paroi cellulaire) piégés dans la matière organique du sol (en) en utilisant principalement des mécanismes oxydatifs (par voie enzymatique telle que la manganèse peroxydase, ou non enzymatique telle que la réaction de Fenton)[13],[14]. Elle accélèrent la photosynthèse en réponse à l’augmentation des concentrations de CO2 atmosphérique lorsque l’azote du sol est un facteur limitant, augmentant l'entrée de carbone dans les écosystèmes. Elles inhibent la respiration dans les sols par les micro-organismes décomposeurs, réduisant la sortie de carbone des écosystèmes. Enfin, la litière des arbres ectomycorhizés se décompose lentement du fait de la présence de composés secondaires inhibant la dégradation de la matière organique, ce qui contribue à séquestrer du carbone dans le sol. Ces symbioses ectomycorhiziennes jouent donc un rôle clé dans la régulation du climat[15].
Caractéristiques physiologiques

Les ectomycorhizes remplissent plusieurs fonctions au sein des racines, et sont pour ces raisons primordiales dans de nombreux écosystèmes. En sécrétant toute une gamme de composés, la matrice extraracinaire des champignons ectomycorhiziens modifient les caractéristiques physicochimiques dans la région du sol nommée ectomycorhizosphère[16]. Ces modifications influencent notamment l'absorption des nutriments et la résistance aux pathogènes. Les effets sur la plante peuvent aussi être indirects. En effet, certaines mycorhizes jouent un rôle sélectif dans la composition de la flore rhizosphérienne, c'est-à-dire les micro-organismes vivant dans la zone d'influence de la racine[17],[16]. Ces micro-organismes peuvent jouer certains rôles, comme contribuer à la dissolution de la roche par la sécrétion d'acides organiques.
Absorption des nutriments
Les champignons ectomycorhiziens sont capables de dégrader directement la matière organique pour en tirer de l'azote sous forme d'acides aminés. Cela est possible grâce à la sécrétion de diverses enzymes ayant des cibles précises. Par exemple, les glycosidases contribuent à l'hydrolyse de la cellulose et de l'hémicellulose, les phosphatases acides contribuent à la dégradation de composés renfermant du phosphore et la chitinase contribue à l'hydrolyse de la chitine.
Les ectomycorhizes jouent aussi un rôle majeur dans l'absorption de minéraux comme le phosphore et le potassium. Il a été démontré que des champignons ectomycorhiziens arrivent à dissoudre la roche pour en extraire les minéraux et les rendre accessibles aux racines. En sécrétant des acides organiques comme l'acide oxalique[18], l'acide citrique[19] et l'acide succinique[20], il serait possible à plusieurs espèces de champignons ectomycorhiziens de solubiliser des minéraux à partir du quartz[21], de l'apatite[18], de la biotite[19] et du feldspath, notamment.
Apport en eau
Dans les forêts, les hyphes des champignons ectomycorhiziens forment un imposant réseau reliant ensemble plusieurs arbres. Non seulement ce réseau, extrêmement ramifié, possède-t-il un important rapport surface-volume, mais il permet des échanges entre les individus. L'eau peut ainsi voyager des régions du sols humides aux régions sèches pour être absorbée par les plantes mycorhizées s'y trouvant[22].
De plus, et c'est aussi le cas avec les endomycorhizes, la fermeture des stomates est plus rapides chez les plantes mycorhizées[23],[24], ce qui permet une meilleure résistance aux stress hydriques.
Résistance aux stress environnementaux
Plusieurs espèces végétales formant des ectomycorhizes vivent dans des sols acides peu favorables au développement de racines non-mycorhizées. En effet, à un pH acide, l'aluminium, le fer et le manganèse, peuvent devenir très solubles et s'avérer toxiques aux végétaux. Il a été démontré que certains champignons ectomycorhiziens sécrètent des sidérophores (acides hydroxamiques: ferricrocine[25],[26],[27], ferrichrome[26], et catécholates[20]). Ces molécules ont la capacité de chélater certains métaux, dont les trois mentionnés plus haut, c'est-à-dire le fer, l'aluminium[28],[29],[30] et le manganèse[29]. Non seulement cette séquestration protégerait-elle les plantes ectomycorhizées d'une intoxication par ces métaux, mais elle empêcherait également le lessivage de ces derniers[3],[6]. Cela est important puisque le fer et le manganèse sont des éléments essentiels à la croissance des végétaux.
Classification morphologique
Voiry, de la Station de Recherches sur les Sols Forestiers et la Fertilisation (C.N.R.F) de Champenoux a en 1981 a proposé une classification morphologique des ectomycorhizes (pour le chêne et le hêtre dans son cas) en trois types, qui semblent correspondre à des groupes d'espèces et qui pourrait avoir des importances trophiques différentes[31].
Distribution
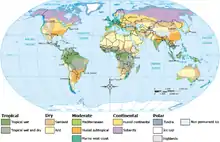
Les ectomycorhizes sont présentes sur tous les continents[32], principalement dans l'hémisphère nord dans les zones climatiques subarctiques, tempérées et méditerranéennes[6], au sein des forêts boréales et mixtes[33],[34] Mais il se trouve aussi, çà et là, des associations ectomycorhiziennes sous les tropiques Sud-américaines et africaines.
Il apparaît que les conditions édaphiques sont un facteur important pour la distribution des champignons ectomycorhiziens, en plus du climat[32],[33],[35],[36].
Notes et références
- B. Meyer-Berthaud, S. E. Scheckler & J. Wendt (1999) Archaeopteris is the earliest known modern tree. Nature 446: 904-907
- (en) Taylor JW, Berbee ML., « Dating divergences in the Fungal Tree of Life: review and new analyses », Mycologia, vol. 98, no 6, , p. 838–49 (PMID 17486961, DOI 10.3852/mycologia.98.6.838)
- J. André Fortin, Christian Plenchette & Yves Piché, Les mycorhizes, la nouvelle révolution verte, Éditions MultiMondes, Éditions Quae, 2008, 131 p. (ISBN 978-2-89544-124-3)
- B. Wang & Y.L. Qiu (2006) Phylogenetic distribution and evolution of mycorrhizas in land plants. Mycorrhiza 16:299-363.
- A.C. Rinaldi, O. Comandini & T.W. Kuyper. (2008). Ectomycorrhizal fungal diversity: separating the wheat from the chaff. Fungal Diversity 33: 1-45.
- P.-E. Courty et al. (2010) The role of ectomycorrhizal communities in forest ecosystem processes: New perspectives and emerging concepts. Soil Biology and Biochemistry 42: 679-698.
- (en) van der Heijden MG1, Martin FM, Selosse MA, Sanders IR, « Mycorrhizal ecology and evolution: the past, the present, and the future », New Phytol, vol. 205, no 4, , p. 1406-1423 (DOI 10.1111/nph.13288).
- Marc-André Selosse, François Le Tacon, « Les stratégies symbiotiques de conquête du milieu terrestre », Année Biol., vol. 2001, , p. 14.
- Simon Egli & Ivano Brunner. Les mycorhizes, une fascinante biocénose en forêt. Not. prat. 35 (2002). Institut fédéral de recherches WSL, Birmensdorf. 8 p. (ISSN 1012-6554)
- Mika Tarkka, Uwe Nehls & Rüdiger Hampp (2005). Physiology of ectomycorrhiza (ECM). Progress in Botany. Volume 66, Part 3, 247-276. DOI:10.1007/3-540-27043-4_11
- Pål Axel Olsson, Håkan Wallander, Interactions between ectomycorrhizal fungi and the bacterial community in soils amended with various primary minerals Original Research Article FEMS Microbiology Ecology, Volume 27, Issue 2, October 1998, Pages 195-205
- Ivanka Nikolova, Karl J. Johanson, Anders Dahlberg, Radiocaesium in fruitbodies and mycorrhizae in ectomycorrhizal fungi ; Journal of Environmental Radioactivity ; Volume 37, Issue 1, 1997, Pages 115-125 (résumé)
- (en) B.D Lindahl & A. Tunlid, A, « Ectomycorrhizal fungi - potential organic matter decomposers, yet not saprotrophs. », New Phytol, vol. 205, no 4, , p. 1443-1447 (DOI 10.1111/nph.13201).
- (en) F. Shah et al., « Ectomycorrhizal fungi decompose soil organic matter using oxidative mechanisms adapted from saprotrophic ancestors », New Phytol, vol. 209, no 4, , p. 1705-1719 (DOI 10.1111/nph.13722).
- (en) B. S. Steidinger, T. W. Crowther, J. Liang, M. E. Van Nuland, G. D. A. Werner, P. B. Reich, G. Nabuurs, S. de-Miguel, M. Zhou, N. Picard, B. Herault, X. Zhao, C. Zhang, D. Routh, K. G. Peay & GFBI consortium, « Climatic controls of decomposition drive the global biogeography of forest-tree symbioses », Nature, vol. 569, , p. 404–408 (DOI 10.1038/s41586-019-1128-0).
- C. Calvaruso, MP Turpault, E. Leclerc, P. Frey-Klett (2007). Impact of ectomycorrhizosphere on the functional diversity of soil bacterial and fungal communities from a forest stand in relation to nutrient mobilization processes. Microbial Ecology 54(3):567-577.
- P. Frey-Klett, J. Garbaye & M. Tarkka (2007). The mycorrhiza helper bacteria revisited. New Phytologist 176: 22-36. « http://www.aseanbiodiversity.info/Abstract/51012405.pdf »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- Hakan Wallander (2000). Uptake of P from apatite by Pinus sylvestris seedlings colonised by different ectomycorrhizal fungi. Plant and Soil 218: 249-256.
- Hakan Wallander & Tonnie Wickman (1999). Biotite and microcline as potassium sources in ectomycorrhizal and non-mycorrhizal Pinus sylvestris seedlings. Mycorrhiza 9:25-32.
- A. Machuca, G. Pereira, A. Aguiar, AMF Milagres (2007). Metal-chelating compounds produced by ectomycorrhizal fungi collected from pine plantations. Letters in applied microbiology 44(1):7-12.
- A. Rosling & R. D. Finlay (2005). Response of different ectomycorrhizal fungi to mineral substrate. Geochimica et Cosmopolita acta 69:222-232.
- L.M. Egerton-Warburton, J.I. Querejeta, M.F. Allen (2007). Common mycorrhizal networks provide a potential pathway for the transfer of hydraulically lifted water between plants. Journal of experimental botany 58(6):1473-1483.
- M. B. Oyun, S. A. Adeduntan & S. A. Suberu (2010). Influence of watering regime and mycorrhizae inoculations on the physiology and early growth of Acacia senegal (L.) Wild.. African Journal of Plant Science 4(7):210-216
- M.S. Lamhamedi, P.Y. Bernier et J.A. Fortin (1992). Hydraulic conductance and soil water potentialat the soil-root interface of Pinus pinaster seedlings inoculated with different dikaryions of Pisolithus sp.. Tree Physiol. 10:231-244.
- L. Yuan, J.G. Huang, X.L. Li & P. Christie (2004). Biological mobilization of potassium from clay minerals by ectomycorrhizal fungi and eucalypt seedling roots. Plant and Soil 262:351-361.
- S.J.M. Holmström, U.S. Lundström, R.D. Finlay & P.A.W. van Hees (2004). Siderophores in forest soil solution. Biogeochemistry 71:247-258.
- K. Haselwandter & G. Winkelmann (2002). Ferricrocin - an ectomycorrhizal siderophore of Cenococcum geophilum. Biometals 15:73-77.
- (en) J. B. Neilands, « Siderophores: Structure and Function of Microbial Iron Transport Compounds », J. Biol. Chem., vol. 270, no 45, , p. 26723–26726 (PMID 7592901, DOI 10.1074/jbc.270.45.26723)
- (en) A. del Olmo, C. Caramelo, and C. SanJose, « Fluorescent complex of pyoverdin with aluminum », Journal of Inorganic Biochemistry, vol. 97, no 4, , p. 384–387 (PMID 14568244, DOI 10.1016/S0162-0134(03)00316-7)
- (en) G. Carrillo-Castañeda, J. Juárez Muños, J. R. Peralta-Videa, E. Gomez, K. J. Tiemannb, M. Duarte-Gardea and J. L. Gardea-Torresdey, « Alfalfa growth promotion by bacteria grown under iron limiting conditions », Advances in Environmental Research, vol. 6, no 3, , p. 391–399 (DOI 10.1016/S1093-0191(02)00054-0)
- Voiry H (1981) Classification morphologique des ectomycorhizes du chêne et du hêtre dans le nord‐est de la France. European Journal of Forest Pathology, 11(5‐6), 284-299. (fr) (résumé en anglais)
- D.J. Read (1991). Mycorrhizas in ecosystems. Experientia 47(4):376-391.
- E.B. Allen, M.F. Allen, D.J. Helm, J.M. Trappe, R.M. Molina & M. Rincon (1995). Patterns and regulation of mycorrhizal plant and fungal diversity. Plant and Soil 170:47–62.
- A. Dahlberg (2001). Community ecology of ectomycorrhizal fungi: an advancing interdiciplinary field. New Phytologist 150:555–562.
- N. Villeneuve, M.M. Grandtner & J.A. FORTIN (1991). The coenological organization of ectomycorrhizal macrofungi in the Laurentide Mountains of Quebec. Can. J. Bot. 69:2215-2224.
- M. Brundrett (1991). Mycrorrhizas in natural ecosystems. Advances in Ecological Research 21:173-313.
Voir aussi
Articles connexes
Liens externes
- (fr) INRA, MycorWiki : un wiki sur les mycorhizes (INRA de Nancy)
- (en) Une revue de littérature sur les mycorhizes
- (fr) Muséum national d'Histoire Naturelle, Littérature sur les mycorhizes(Institut de Systématique, Évolution, Biodiversité)
Bibliographie
- Selosse M.-A. (2000) La symbiose : structures et fonctions, rôle écologique et évolutif. Vuibert (fr)
- Horton Tr & Bruns TD (2001) The molecular revolution in ectomycorrhizal ecology : peeking into the black box. Mol Ecol 10: 1855–1871 (en)
- Garbaye J. (2013) La symbiose mycorhizienne. Une association entre les plantes et les champignons. Quae
- Selosse M.-A. (2017) Jamais seul. Ces microbes qui construisent les plantes, les animaux et les civilisations. Actes Sud
- Portail de la botanique
- Portail de la mycologie
- Portail du bois et de la forêt