Césium 137
Le césium 137, noté 137Cs, est l'un des 40 isotopes du césium connus, élément qui a le plus grand nombre d'isotopes après le francium. Son nombre de masse est égal à 137, son noyau atomique ayant 55 protons et 82 neutrons, avec un spin +7/2 dans son état fondamental, pour une masse atomique de 136,907 089 g/mol. Sa période est de 30,08 ans. Il est caractérisé par un excès de masse de −86 545 keV et une énergie de liaison nucléaire par nucléon de 8 388,96 keV[1].

| Nom | Césium 137 |
|---|---|
| Symbole |
137 55Cs 82 |
| Neutrons | 82 |
| Protons | 55 |
| Demi-vie | 30,08 ± 0,09 ans[1] |
|---|---|
| Produit de désintégration | 137Ba, 137mBa |
| Masse atomique | 136,9070893(3) u |
| Spin | 7/2+ |
| Excès d'énergie | −86 545,8 ± 0,3 keV[1] |
| Énergie de liaison par nucléon | 8 388,958 ± 0,002 keV[1] |
| Isotope parent | Désintégration | Demi-vie |
|---|---|---|
| 137 54Xe | β− | 3,818(13) min |
| Désintégration | Produit | Énergie (MeV) |
|---|---|---|
| β− | 137m 56Ba à 95,4 % | 0,5120 |
| 137 56Ba à 4,6 % | 1,174 |
Il a été découvert par Glenn T. Seaborg et Margaret Melhase[2].
Origine
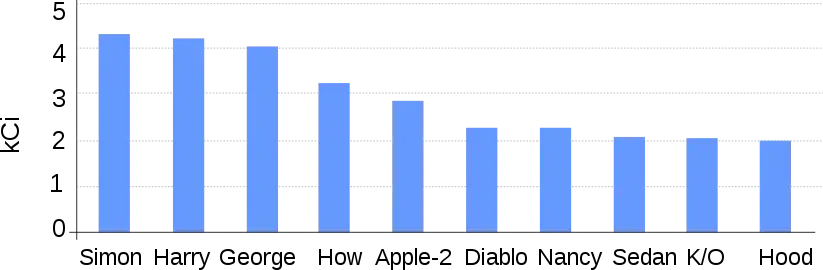
Diagramme présentant les retombées des 10 principaux essais nucléaires qui ont le plus exposés la population nord américaine au césium 137.
C’est l'un des nombreux produits de fission de l'uranium et sans doute le plus connu pour avoir été utilisé dans les études hydrologiques et écologiques à la suite d'une contamination générale de l'atmosphère induite, à partir de 1945, par l'utilisation des bombes atomiques et des essais nucléaires (puis l'accident de Tchernobyl), et, dans une moindre mesure, à cause des rejets de centrales nucléaires ou de sites de retraitement, d'entreposage nucléaire (provisoire) ou de stockage durable des déchets radioactifs, etc.
Son suivi a par exemple permis de mesurer à quelle vitesse l'eau des nappes se renouvelait, la cinétique environnementale du césium (notamment dans la chaîne alimentaire) ou si une grotte était isolée du monde extérieur ou non.
Apparence
Quand il est pur, il se présente comme un métal alcalin argent-doré. Son point de fusion est assez proche de la température ambiante (CNTP) pour qu'il soit possible de l'obtenir à l'état liquide à cette température grâce à la surfusion (comme pour le gallium et rubidium)
Radioactivité
| Propriété : Unité : |
t½ a |
Rendement % |
Q * keV |
βγ * |
|---|---|---|---|---|
| 155Eu | 4,76 | 0,0803 | 252 | βγ |
| 85Kr | 10,76 | 0,2180 | 687 | βγ |
| 113mCd | 14,1 | 0,0008 | 316 | β |
| 90Sr | 28,9 | 4,505 | 2826 | β |
| 137Cs | 30,23 | 6,337 | 1176 | βγ |
| 121mSn | 43,9 | 0,00005 | 390 | βγ |
| 151Sm | 88,8 | 0,5314 | 77 | β |
Un gramme de césium 137 pur présente une radioactivité de 3,204 TBq. Le césium 137 se désintègre en baryum 137m, métastable (de courte durée produit de la dégradation), puis en baryum 137 stable non radioactif.
Dans l'environnement, on le trouve rarement seul. Les déchets radioactifs, ou les retombées d'essais nucléaires atmosphériques ou de l'accident de Tchernobyl ainsi que de celui de la centrale nucléaire de Fukushima Daiichi peuvent également contenir du césium 135 (à très longue période radioactive) et du césium 134 (période de 2 ans). Les isotopes 134 et 137 sont initialement présents à parité dans les produits de fission libérés à ces occasions[3], mais la décroissance plus rapide du césium 134 fait que le césium 137 (demi-vie de 30 ans) représente rapidement l'essentiel des formes du césium présentes.
Désintégration
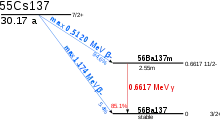
Dans 94,6 % des cas, il donne l’isomère 137mBa du baryum 137 par désintégration β− avec une énergie de désintégration de 512 keV et une période radioactive de 30,08 ans, lequel retombe à son état fondamental par transition isomérique émettant un rayonnement γ de 661,7 keV avec une période de 2,552 min :
Dans les 5,4 % des cas restants, il se désintègre directement en 137Ba avec une énergie de désintégration de 1 174 keV.
Le rayonnement γ émis par le 137mBa peut être utilisé à des fins médicales ou industrielles, par exemple pour l’irradiation des aliments, mais le césium 137 n’est en fait que très peu utilisé en raison de son instabilité chimique bien plus grande que celle du cobalt 60, isotope bien meilleur pour ce type d’applications car chimiquement plus simple à contrôler et émettant un rayonnement plus puissant. On le trouve dans certains appareils de mesure de densité ou d’humidité, des débitmètres et divers détecteurs. En revanche il est très utilisé pour la datation de vins élaborés après 1952[alpha 1], le rayonnement γ émis permettant d'effectuer des mesures sans avoir à ouvrir la bouteille[4],[5].
Le césium 137 est facilement mesuré dans l'environnement par spectrométrie gamma à partir de la raie d'émission gamma de son fils le 137mBa
Sources de contamination, normes alimentaires en situation normale ou de crise nucléaire
C’est un produit de fission de l’uranium et, comme tel, des quantités plus ou moins importantes de cet isotope ont été relâchées dans l’atmosphère d'abord dans les années 1940 et 1950 lors des essais nucléaires à l’air libre, puis lors d’accidents nucléaires (Voir la Liste des accidents nucléaires). Les dernières contaminations générales ou importantes de la biosphère ont été induites par la catastrophe de Tchernobyl, le , qui reste aujourd’hui la principale contamination radioactive de la zone interdite et de certaines zones contaminées par le passage du nuage, puis par la catastrophe de Fukushima. La contamination des organismes végétaux, fongiques, animaux et humains se fait via l'eau, l'air et le sol, et chez l'homme via l'alimentation (nourriture, boisson), la respiration ou le contact avec des produits contaminés. Le gibier, les baies sauvages, les champignons sauvages, les produits laitiers et certaines épices, condiments ou plante médicinales sont aussi des sources possibles[6],[7].
Normes : elles ont varié selon les pays, les époques et les produits (plus sévères pour le lait que la viande, car le lait est davantage consommé par les enfants, qui sont plus vulnérables au césium 134 ou 137). À titre d'exemple, pour la viande :
- 600 Bq/kg est la norme européenne actuellement en vigueur[8] à ne pas dépasser pour la venaison et la viande d'animaux d'élevage ;
- 500 Bq/kg est la norme pour le Japon[9];
- 3 700 Bq/kg est la norme, beaucoup plus laxiste, édictée en URSS à la suite de l'accident de Tchernobyl[10] avant d'être redescendue à 740 Bq/kg en Russie en 1990[10];
- 592 Bq/kg est la norme actuelle pour les pommes de terre et la viande en Biélorussie, décidée par le gouvernement, une fois la république devenue indépendante.
Cinétique dans l'organisme humain
Sur le long terme, la contamination se fait surtout par ingestion et absorption gastro-intestinale, mais en cas d'inhalation il y a aussi un passage direct dans le sang[11].
Le césium est ensuite transporté par le sang et se distribue de la même manière que son analogue chimique, le potassium, principalement dans les muscles[11]. Le césium est absorbé par les cellules animales et végétales en compétition avec le potassium, mais le césium n'a pas de fonction bénéfique connue; cependant, à des concentrations élevées, il peut entraîner une toxicité chez les plantes considérées comme des inhibiteurs de croissance. En effet, au cours de leur évolution, les mammifères ont commencé à distinguer le césium non radioactif inutile du potassium, qui est essentiel dans la pompe Na + / K + des membranes cellulaires animales. Ceci est clairement visible dans la faible absorption et sélectivité du césium dans le foie et les fœtus dans les autoradiographies de Nelson[12]. Le corps humain excrète le césium par le rein (86%) et l'intestin (14%) via les glandes salivaires et le pancréas exocrine qui sont de puissants accumulateurs de césium. Ils le filtrent et l'éliminent avec de la salive et du suc pancréatique dans l'intestin. Selon Venturi (2020), le pancréas est plus sujet au cancer. En effet, le "bleu de Prusse" (ferrocyanure ferrique) dans l'intestin est capable de chélater le césium absorbé, empêchant sa réabsorption, et de l'éliminer dans les fèces[13],[14].
Toxicité et écotoxicité
Le césium 137 présente une toxicité chimique considérée comme très faible par l'IRSN[15].
En tant que radioélément[16], le césium 137 est par contre radiotoxique et écotoxique, essentiellement en raison de ses propriétés radiologiques[17].
Chez les bovins comme chez l'Homme, on a constaté qu'il est très faiblement présent dans la graisse et les os[18], alors que chez le poisson, l'accumulation dans les os peut représenter jusqu'à 10 à 20 % du total[19].
Toxicité externe
La toxicité radiative externe du césium 137 est liée à l'exposition à son rayonnement ionisant. Ce risque est relativement faible, car le rayonnement bêta externe est absorbé par une couche d'air d'un ou deux mètres d’épaisseur, ou est en partie bloqué par l'épaisseur des vêtements, de l'épiderme et du derme.
L'effet toxique externe requiert donc une exposition élevée, or le césium 137 présent dans l'atmosphère est négligeable face a d'autre radioéléments comme le radon 222, le débit de dose globale en France est de 100nSv/h[20].
Un cas particulier est la « toxicité de contact » (contact direct plus ou moins long avec la peau), qui se manifeste alors par des brûlures. Ce cas concerne surtout des expositions accidentelles (le cas de Goiânia au Brésil, par exemple).
Toxicité interne et effets biologiques
« Les conséquences sanitaires d'une exposition chronique à ce radionucléide restent mal connues »[17]. Le degré d'exposition de diverses populations est également mal connu. Il a fait l'objet d'études avec des évaluations de la capacité de divers milieux (prairies, champs[21]) et de divers aliments végétaux et animaux ou fongiques à bioassimiler et éventuellement bioconcentrer ce radioélément (ex : tomates[22]).
La radiotoxicité du césium 137 est principalement liée à l'exposition interne de certains organes et de l'organisme, quand et parce que le rayonnement bêta du césium 137 est exprimé à l'intérieur de l'organisme, voire dans certaines cellules. Ce type de toxicité apparait quand il y a eu inhalation ou ingestion de césium 137 (par des aliments ou la boisson).
Chez de nombreux animaux dont les mammifères, cette radiotoxicité est exacerbée par le fait qu'une grande partie du césium est assimilée dans l’organisme en tant qu'analogue du potassium. Il n'en est alors éliminé qu’avec une période biologique de 20 jours pour les enfants, 100 jours pour les femmes, 150 jours pour les hommes[11]. Certaines sources américaines donnent plutôt une période de 70 jours[23]. Quand le césium 137 est ingéré par l'enfant, il se distribue d'abord comme chez l'adulte de manière homogène dans l'organisme, mais avec une charge plus importante chez l’enfant que chez l’adulte[17]
De plus, dans un même environnement, en raison d'un métabolisme osseux plus actif que chez l'adulte (sous contrôle d'hormones thyroïdiennes et de la vitamine D et A notamment), l'enfant a des besoins en potassium plus élevés que l'adulte[24] ; et il en absorbe et en fixe plus que ce dernier[24].
On cherche aussi à mieux connaitre le taux de transfert placentaire et les risques pour le fœtus quand la mère a subi une contamination interne[25], ainsi qu'un éventuel effet mutagène sur les graines de plantes cultivées[26]
En cas d'exposition chronique, la période radioactive de ce radioélément a pour effet une bioaccumulation jusqu'à homéostasie (quand la dose quotidiennement absorbée est égale à la dose excrétée, au bout d'un an environ)[11].
L'ingestion d'un becquerel correspond à une dose d'exposition radioactive d'approximativement 12 nSv[27]).
Effets
Les effets des faibles doses d'irradiation sont discutés, mais chez l'Homme, les effets avérés des « fortes » doses sont :
- insuffisance médullaire et atteinte du système immunitaire[17];
- délétion de la fonction de reproduction[17];
- effets hépatotoxiques[17] avec notamment une modification du métabolisme du cholestérol dans le foie[28], dès le stade fœtal chez le rat de laboratoire[29];
- affections rénales[17];
- troubles de la minéralisation osseuse[17];
- modification du métabolisme du cholestérol dans le cerveau[28];
- lésions cérébrales, éventuellement associées à des troubles neurologiques[17];
À doses plus faibles, selon les études faites sur le modèle animal, et à plus long terme, on lui reconnait aussi les effets suivants :
- perturbations du cycle veille-sommeil (qui peut suggérer un effet de perturbation hormonale du cycle nycthéméral), sans troubles comportementaux[17];
- atteinte du système cardiovasculaire[17], arythmie cardiaque[30];
- troubles du métabolismes de la vitamine D, du cholestérol et des hormones stéroïdiennes, sans symptomatologie clinique[17];
- malformations congénitales et fœtales[17];
- risque accru de cancers de la thyroïde[17];
- risque accru de malformations congénitales et fœtales[17];
- risque accru d'anomalies du cristallin et de cataractes (notamment infantiles)[30];
Les enfants semblent plus vulnérables à la toxicité du césium que les adultes[17].
D'autres effets, à plus long terme (en cas d'exposition chronique) sont suspectés sur le cœur, la paroi stomacale.
Un effet mutagène semble exister pour l'embryon, avec un risque accru suspecté de trisomie 21. Un nombre statistiquement anormalement élevé de trisomies 21 a en effet été constaté en janvier 1987[31] dans des pays très touchés et pour les bébés conçus au moment du passage du nuage. Une nette augmentation (plus que le double) a été constatée en Biélorussie, avec 26 cas observés par le registre national des malformations congénitales pour 9,84 cas attendus[32],[33] (pays le plus touché par les retombées), mais aussi à Berlin-Ouest, où la quasi-intégralité des trisomies signalées à la naissance mais aussi en diagnostiquées avant, est consignée dans un registre, avec la distribution de l'âge maternel. Ce registre montre une augmentation significative du nombre de cas en janvier 1987, soit neuf mois exactement après la catastrophe de Tchernobyl. Mais dans les deux cas, ce phénomène ne s'est pas prolongé dans le temps. Il pourrait donc aussi être dû à l'iode radioactif (dont la décroissance radioactive est très rapide). Ce type de statistiques est par ailleurs d'utilisation délicate depuis, en raison du manque de registres précis et homogènes dans de nombreux pays, en raison du fait que de nombreux avortements volontaires ont suivi l'accident dans certains pays (par exemple, en Biélorussie) ou l'ont précédé (comme en Suède[34]), que les populations des zones contaminées on fait beaucoup moins d'enfants (la Biélorussie est l'un des pays où la natalité a le plus décliné dans le monde, etc. ; aux environs de Tchernobyl, la première naissance déclarée a eu lieu 17 ans après l'explosion) et enfin parce que les moyens de détecter la trisomie précocement et la possibilité d'alors déclencher un avortement médical ont beaucoup évolué. La présence d'un pic de trisomies en janvier 1987, neuf mois après le passage du panache, ainsi que des données expérimentales montrant une phase radiosensible de l'ovogenèse autour du temps de conception chez les mammifères, suggèrent que ce « pic de janvier » peut être lié au panache de Tchernobyl, mais pas nécessairement au seul césium 137[31].
Prise en charge médicale (et vétérinaire)
Durant la période des essais nucléaires atmosphériques, pour limiter l'absorption du césium ou d'autres radionucléides, on a testé comme additif alimentaire chez des animaux d'élevage des hexacyanoferrates (ferrocyanure de sodium et de potassium) et des minéraux (argiles) susceptibles d'adsorber le radiocésium en limitant son passage de l'intestin vers le sang, mais on a montré après la catastrophe de Tchernobyl que l'utilisation régulière d'argile pouvait induire des carences alimentaires en certains oligoéléments[35] et posait des problèmes d'approvisionnement quand il fallait supplémenter la nourriture de millions d'animaux[35]. Un autre produit s'est avéré plus efficace ; une forme colloïdale du « Bleu de Prusse » (analogue Ammonium-ferrique-cyanoferrate ou AFCF) est évaluée comme étant 88 à 266 fois plus efficace que la bentonite ou Bolus alba à poids égal[35]. Chez l'homme, il est le seul traitement médicamenteux reconnu de la médecine nucléaire qui existe, basé sur le bleu de Prusse (administré sous forme d'un médicament (Radiogardase) pour « décorporer le 137Cs après ingestion ». Après le passage d’une partie du nuage de Tchernobyl au-dessus de l'Allemagne de l'Ouest et de l'Autriche, il a été reconnu et autorisé comme additif alimentaire par les autorités sanitaires.
L'ingestion de pectine a été testée après Tchernobyl comme chélateur non toxique et peu couteux chez des enfants victimes de contamination interne au 137Cs dans les zones touchées par les retombées de Tchernobyl, mais il n'y a pas encore de consensus quant à son efficacité[17].
Par ailleurs dans les zones les plus touchées d'Ukraine et de Biélorussie on a tué le bétail déjà très contaminé après l'accident, et on a ensuite cherché à alimenter ces animaux avec des aliments naturellement pauvre en radiocésium[35].
Thérapies
En cas d'absorption importante de 137Cs, le traitement chélateur préconisé par la médecine nucléaire est le bleu de Prusse (Radiogardase) qui permet de décorporer le 137Cs ingéré et disponible. L’administration interne de pectine est également testée, notamment chez les enfants et sur le long terme dans certaines zones contaminées, mais son degré d'efficacité est encore discuté. Le bleu de Prusse, même s'il est efficace, est très toxique, et à déconseiller pour l'alimentation humaine.
Contamination de l'environnement
Les essais nucléaires atmosphériques et certaines catastrophes (dont celles de Tchernobyl et de Fukushima) ont été sources d'importantes contamination de l'environnement. Le césium peut être bio-accumulé, par exemple par les mousses et lichens dans un premier temps, et éventuellement localement (concentré par le réseau trophique)[36]. Les poissons le bioaccumulent aussi (dans leur squelette en particulier) et de manière plus marquée chez les poissons prédateurs[36]. La contamination est d'autant plus importante que le potassium est rare dans le sédiment ou sous forme dissoute dans l'eau ; Les poissons d’eau douce de ruissellement sont donc plus contaminés que ceux d’eaux dures sédimentaires et les poissons océaniques en contiennent encore moins (effet dilution)[36]).
Les champignons jouent à ce propos un rôle particulier, et en particulier certaines espèces trouvées en surface ou sous le sol tels que les champignons à fructification hypogée (sous le sol) (ex : truffes, dont la truffe du cerf (Elaphomyces granulatus), très consommée par les sangliers et les écureuils). Grâce à leur vaste zone de prospection dans les 30 premiers cm du sol, via leur réseau mycélien souterrain ou capable de coloniser le bois mort (lui-même éventuellement contaminé), ces champignons peuvent concentrer le césium retombé avec les pluies ou dépôts secs ayant suivi les essais nucléaires ou certains accidents.
Par exemple, après le passage du nuage de Tchernobyl, leur contamination a en France varié de 15 à 50 000 Bq/kg, selon les sources officielles[37]. D'autres (ex : Suillus variegatus et Lactarius rufus[38]) remontent le césium en surface via leur chapeau, ou pourraient le transférer aux plantes via la mycorhisation[38].
En cas d'accident nucléaire suivi de redéposition importante de césium 137, les seuils à ne pas dépasser dits « niveaux d'intervention » (activité massique des produits alimentaires, doses individuelles pour les populations ne dépassant pas 1 mSv/a) pourraient ils être respectés ? C'est la question posée en 1993 par un exercice de crise franco-russe qui s'est déroulé à Saint-Pétersbourg (21-25 juin 1993)[39], avec un scénario de radioactivité surfacique maximale de 3.700 kBq/m2 (100 Ci/km2). Les résultats ont montré que 5 ans après, avec une agriculture limitée aux zones à moindre risque, et pour les produits les plus consommés ; c'est pour la viande de porc et de bœuf et pour les champignons qu'il serait le plus difficile (impossibilité même) de respecter les normes européennes.
Cinétique environnementale
La demi-vie du césium 137 étant de 30 ans, sa décroissance radioactive n'affecte sa cinétique environnementale qu'à long terme. Après dépôt du césium 137 au sol (pluie, neige, dépôts secs…), il y percole lentement ou circule horizontalement plus ou moins vite selon la nature du sol, la présence d'eau et l'acidité (pH) de cette eau, et selon qu'il reste à l’état libre ou qu'il soit plus ou moins durablement piégé dans les complexes argilo-humiques, les mousses ou lichens ou les tourbes (qui peuvent, en zone contaminée, brûler comme on l'a vu lors des incendies de forêt et de tourbières en Russie en 2010). Après Tchernobyl, en Biélorussie la plus grande partie des matières radioactives s'est d'abord concentrée dans la couche superficielle du sol. « Aujourd'hui, 90 % de la radioactivité a migré vers la litière et les horizons supérieurs. La strate herbacée, la litière et les couches de sol les plus superficielles forment conjointement le « champ d'absorption »[40] ou « couverture d'absorption »[41] le plus intense »[42].
Selon l'IRSN[43]« Dans les sols non labourés, et plus particulièrement en forêt, cette couche peut encore contenir, 20 ans après, 70 % de l’activité en césium 137 déposée en 1986. Ceci explique que la contamination des champignons est aujourd’hui (en 2004) 100 à 10 000 fois plus élevée que celle des produits agricoles. En fonction de la contamination du sol et de l’espèce, elle varie de moins de 1 Bq/kg à quelques centaines de Bq/kg ». Les sangliers et écureuils ou d'autres mycophages peuvent ainsi se contaminer (toujours selon l'IRSN[43], en 1996, 10 ans après l'accident, « des activités en césium 137 de quelques centaines à 2 000 Bq/kg étaient mesurées dans de la viande de sanglier des Vosges »). par le jeu de la bioconcentration, les doses de radioactivité de champignons et du sol (dans les creux, en montagne et forêt pour des zones où il a plu lors du passage du nuage) la radioactivité a même pu continuer à localement s'accroître dans les 15 ans ayant suivi le passage du nuage.
La richesse du sol en vers de terre, en champignons ou son remaniement influent sur les mouvements de ce radionucléide dans le sol[44]. En moyenne, il s'enfonce dans la couche humique à raison de 1 cm par an environ et une partie peut périodiquement être extraite du sol par les racines de plantes, puis y revenir via les feuilles mortes, le bois mort, les excréments des animaux, etc. Ce n'est donc qu'après un certain temps (15 à 25 ans ?) que les champignons le collecteront probablement le plus facilement.
Lysikov a montré (en 1995) près de la centrale de Tchernobyl que les activités de fouissage du sanglier interféraient avec la circulation des radionucléides (dont le césium) dans l'environnement[45]. Le césium est un cation chimiquement toxique[46], très soluble dans le bol alimentaire et qui traverse facilement la barrière intestinale au niveau du petit intestin[47]. d'où il gagne facilement toutes les parties du corps (comme s'il avait été inhalé)[48],[49]. L'excrétion du césium via l'urine (des sangliers, écureuils) devient alors une source de recontamination de l'environnement, en surface. Les vers de terre peuvent aussi en remonter une certaine quantité.
L'INRA de Montpellier a tenté de modéliser la circulation du césium via les plantes et le sol dans les années 1990, sur la base de données montrant que le taux et la vitesse d'absorption par les plantes dépendaient des espèces considérées, mais aussi comme on pouvait s'y attendre de la concentration en potassium du sol, de la densité racinaire et de la distribution profonde des racines.
La présence de matière organique dans l'argile diminue la fixation du césium dans le sol et favorise son transfert vers la plante (jusqu'à 90 % en plus). Siobhan Staunton de l'INRA (ENSAM) notait néanmoins en 1996[50] qu'une grande part du césium pompé par la plante est excrétée et non transférée vers les parties supérieures.
Peu après une pollution de surface, ce sont les plantes à racines superficielles qui sont contaminées, puis 20 ans après en moyenne, ce sont les plantes se nourrissant plus profondément ou certains champignons.
On ignore encore si les symbioses arbre-champignons peuvent via la mycorhization faciliter la pénétration du césium dans les arbres quand le césium sera le plus accessible à la couche racinaire et à la zone la plus explorée par les mycéliums d'espèces symbiotes des arbres (truffes en particulier, symbiotes du chêne et du noisetier).
Contamination de l'alimentation du bétail
Depuis la catastrophe de Tchernobyl, en Finlande (pays fortement touché par le passage du nuage de Tchernobyl et où il a fallu abattre de nombreux rennes contaminés), on a efficacement testé chez le renne[51] l'adjonction de bentonite puis de plusieurs formes d'hexacyanoferrates (dont l'hexacyanoferrate ferreux d'ammonium ou l'hexacyanoferrate ferrique d'ammonium (AFCF, un dérivé du Bleu de Prusse)) dans l’alimentation animale (ex. : lichens donnés à manger aux rennes en Finlande), comme agent complexant (mais non chélateur, présentant une certaine toxicité, mais limitant les transferts de la nourriture vers l'organisme de l'animal qui la mange ; ex. : le lait est alors jusqu'à 5 fois moins radioactif). Le taux de césium des globules rouges des rennes a diminué de 50 % avec une dose quotidienne de 1 mg/kg d'hexacyanoferrate ferreux d'ammonium par kilogramme (selon le poids de l'animal), soit le même résultat qu'avec 500 mg/kg de bentonite[51], 3 mg/kg d'AFCF ou 2 g/kg de bentonite réduisent à la fois l'excrétion urinaire et les taux RBC de plus de 80 %[51]. Des zéolites[52] et de la vermiculite a aussi été testé comme contre mesure, avec le ferricyanure d'ammonium, en supplément alimentaire du bétail[53]. Au début des années 1960, on avait déjà identifié la capacité de complexation du cyanoferrate ferrique pour le césium[54].
Le cas particulier des forêts et produits forestiers
En raison de leur richesse en champignons, parce qu'elles ont mieux capté le césium lors du passage du nuage, et parce qu'elles protègent les sols de l'érosion, les forêts sont devenues des « réservoirs et sources de radiations »[42].
En effet, elles ont stocké et localement même reconcentré le césium, ce qui fait que les aliments d'origine forestière (champignons, fruits, gibier) sont beaucoup plus contaminés que ceux provenant des champs cultivés. par exemple, après la catastrophe de Tchernobyl, on a estimé que les forêts biélorusses ont « capturé plus de 80 % des radionucléides dispersés par la centrale de Tchernobyl (ceux dont la durée de vie est la plus longue étant le césium 137, le strontium 90 et le plutonium 239, 240 et 241) ». Une grande partie de ces radionucléides sont ensuite intégrés dans le cycle forestier (ligneux → bois mort + feuilles mortes → champignons → humus → plantes ligneuses, etc[42]. Dans un cycle parallèle, la faune en capte une partie, qu'elle rend au sol via ses excréments et les cadavres[40]. Seuls les oiseaux et poissons migrateurs contribuent à exporter (et/ou à importer ce césium radiotoxique).
Ceci explique les très fortes teneurs en césium 137 des aliments forestiers (baies, champignons et gibier, régulièrement consommés par les villageois en Biélorussie et en Ukraine), qui était de 20 à 50 fois supérieure à celle des produits agricoles des mêmes régions[42].
Le monde scientifique cherche depuis plus de 20 ans à réduire les risques et dangers liés à ce fait, « mais aucune solution à ce problème n'a encore été trouvée » selon Victor A. Ipatyev (directeur de l'Institut forestier de l'Académie nationale des sciences de Biélorussie, à Gomel, relayé par la FAO[42].
les forêts humides (écologiquement très riches) semblent les plus vulnérables.
Le cas particulier des tourbières et marais
Les tourbières alcalines sont des zones de stockage de radionucléides. Les tourbières acides sont supposées au contraire favoriser la circulation des métaux dans l'eau.
À titre d'exemple, le tableau ci-dessous rapporte la radioactivité de fruits (mûres, myrtilles, airelles) et champignons (Paxillus et Russula) récoltés en Biélorussie à environ à 120 km de la centrale nucléaire de Tchernobyl, en zone expérimentale (zone humide eutrophe-mésotrophe, comprenant une zone drainée (nappe à -56 cm) et non drainée (nappe à -27 cm)). Ceux-ci étaient, en 2000, beaucoup moins contaminés (2 à 3 fois moins) dans les zones où ces marais avaient été drainées[42]. Le tableau montre que le drainage a limité l'accès de ces plantes aux radionucléides, mais comme on l'a vu en 2010, le drainage rend néanmoins les tourbières et forêts plus vulnérables aux incendies et peut-être à la fuite de radionucléides vers les nappes ou cours d'eau, qui reçoivent les exutoires de drains et fossés de drainage.
| Aliment | Avec nappe phréatique (à −27 cm) |
Nappe phréatique drainée (à −56 cm) |
|---|---|---|
| Mûres | 617 000 Bq/m² | 312 000 Bq/m² |
| Myrtilles | 709 000 Bq/m² | 205 000 Bq/m² |
| Airelles (fruit) | 888 000 Bq/m² | 234 000 Bq/m² |
| Airelles (plante) | 6 724 000 Bq/m² | 630 000 Bq/m² |
| Champignons Paxillus | 29 680 000 Bq/m² | 10 640 000 Bq/m² |
| Champignons Russula | 7 509 000 Bq/m² | 3 683 000 Bq/m² |
Notes et références
Notes
- Le procédé est d'autant plus intéressant que la présence de césium 137 même à l'état de traces ne peut survenir dans des vins antérieurs aux premières explosions nucléaires, ce qui permet d'identifier des fraudes.
Références
-
(en) « Live Chart of Nuclides: 137
55Cs
82 », sur https://www-nds.iaea.org/, AIEA, (consulté le ). - « Federal Register, Volume 68 Issue 23 (Tuesday, February 4, 2003) », sur www.govinfo.gov (consulté le )
- IRSN - Fukushima, un an après - Premières analyses de l’accident et de ses conséquences, page 48 les rejets de césiums radioactifs […] sont majoritairement constitués de césium 137 et de césium 134, à parts égales
- Philippe Hubert, Centre d'Études Nucléaires de Bordeaux Gradignan, « Datation du vin par la détection du 137Cs », sur cenbg.in2p3.fr, (consulté le ).
- (en) Rami Tzabar, « Wine makers crack open hi-tech tricks », sur bbc.co.uk, (consulté le ).
- Castro J. Sancho A, Veiga E, Doas Yubero J & Murias B (1989) Transfert de Cs-134 et Cs-137 dans les infusions d'herboristerie. In Radioactivity Transfer during Food Processing and Culinary Preparation (Proc. Seminar Cadarache), CEC, Luxembourg (pp. 205-218)
- Pourcelot L, Renaud P, Louvat D, Gurriaran R & Richon P (2003) http://www.jle.com/e-docs/00/03/FB/1F/article.phtml Influence des points de concentration en césium‐137 sur la contamination d'une chaîne alimentaire de type alpin et estimation des doses associées] Environnement, Risques & Santé, 2(2), 112-120 (http://www.jle.com/e-docs/00/03/FB/1F/article.phtml résumé])
- Selon l'IRSN, au Japon comme en Europe, les niveaux maximaux de césiums radioactifs admissibles dans les denrées alimentaires sont de 500 Bq.kg-1 pour les légumes, les céréales, la viande, les œufs et le poisson, et de 200 Bq.kg-1 pour le lait, les produits laitiers et les aliments liquides (Source : IRSN, Synthèse des informations disponibles sur la contamination radioactive de l’environnement terrestre japonais provoquée par l’accident de Fukushima Dai-ichi ; 27 septembre 2011, voir note page 8/11)
- Voir chapitre REPERE 1 : les normes de contamination des aliments en vigueur au JAPON, in Japon : chronique d’une contamination annoncée, CRIIRAD, Comm. Dimanche 20 mars 2011, consulté 2011-10-08
- ASN, Les normes de consommation et de commercialisation des produits alimentaires, page mise à jour le 10 décembre 2009, consultée 2011-19-08
- IRSN, Fiche Sanitaire, Chap V.3 Exposition interne, p. 4
- Nelson A, Ullberg S, Kristoffersson H, Ronnback C, « Distribution of Radiocesium in Mice. », Acta Radiologica, vol. 55, 5,, , p. 374-384, (DOI 10.3109 / 00016926109175132)
- Venturi, Sebastiano, « Is there a correlation between radioactive cesium and the increase of pancreatic cancer? », Reseachgate, , p. 1-13 (DOI 10.13140 / RG.2.2.27682.86728)
- (en) Y. I. Bandazhevsky, « Chronic Cs-137 incorporation in children's organs. », Swiss Medical Weekly, vol. 133, nos 35-36, , p. 488-490 (PMID 14652805, lire en ligne)
- IRSN, Fiche Environnementale, p. 10
- M.J. Martin, P.H. Blichert-toft (1970), Radioactive atoms: Auger-Electron, α-, β, γ-, and X-Ray Data ; Atomic Data and Nuclear Data Tables, Volume 8, Issues 1–2, octobre 1970 (résumé)
- P. Lestaevel, R. Racine, H. Bensoussan, C. Rouas, Y. Gueguen, I. Dublineau, J.-M. Bertho, P. Gourmelon, J.-R. Jourdain and M. Souidi (2010) Mise au point : Césium 137 : propriétés et effets biologiques après contamination interne Caesium 137: Properties and biological effects resulting of an internal contamination] ; Médecine Nucléaire Volume 34, Issue 2, February 2010, Pages 108-118 doi:10.1016/j.mednuc.2009.12.003 (résumé/abstract)
- IRSN, Fiche Environnementale, p. 8
- IRSN, Fiche Environnementale, p. 11
- « Bilan de l’état radiologique de l’environnement français en 2010-2011 » [PDF], p. 48.
- Lionel Mabit, Claude Bernard (1998), Relationship between soil 137Cs inventories and chemical properties in a small intensively cropped watershed; Comptes Rendus de l'Académie des Sciences - Series IIA - Earth and Planetary Science, Volume 327, Issue 8, octobre 1998, Pages 527-532 (résumé)
- Myttenaere, P. Guillot, J.M. Mousny (1974)Radiocesium retention in tomato plants (Lycopersicum esculentum) as a function of the stable cesium and radioactive 137Cs concentrations of the nutrient solutions ; Radiation Botany, Volume 14, Issue 1, April 1974, Pages 29-36 C. (résumé)
- (en) « Biological Half-life »
- M Garabédian, A Linglart, E Mallet, Anne Lienhardt-Roussie (2011), Métabolisme phosphocalcique et osseux de l'enfant; Lavoisier Coll. Médecine Sciences publications (2e éd.) (ISBN 978-2-257-00036-1) (voir notamment pages 37 (pour le fœtus) et pages 8, 39, 138 et 149 pour l'enfant ou l'adulte)
- Sternberg (1966), Radiocontamination of the environment and its effects on the mother and fetus: I—Classification of fission products and neutron-activated elements according to their rate of placental transfer ; The International Journal of Applied Radiation and Isotopes, Volume 17, Issue 1, janvier 1966, Pages 29-32 J. (résumé)
- J.P. Witherspoon(1968), Effects of internal 137Cs radiation on seeds of Liriodendron tulipifera ; Radiation Botany, Volume 8, Issue 1, 1968, Pages 45-48
- IRSN, Fiche Sanitaire, Coefficients de dose, p. 5
- Racine, R., Grandcolas, L., Grison, S., Gourmelon, P., Gueguen, Y., Veyssiere, G., & Souidi, M. (2009). Molecular modifications of cholesterol metabolism in the liver and the brain after chronic contamination with cesium 137. Food and Chemical Toxicology, 47(7), 1642-1647
- Racine, R., Grandcolas, L., Blanchardon, E., Gourmelon, P., Veyssiere, G., & Souidi, M. (2010). Hepatic cholesterol metabolism following a chronic ingestion of cesium-137 starting at fetal stage in rats. Journal of radiation research, 51(1), 37-45.
- Landon, G. (2008). Non cancerous diseases following a chronic intern contamination by caesium 137: cataracts and cardiac arrhythmias ; thèse de doctorat, Université de paris V, PDF, 182 pages
- K Sperling, J Pelz, RD Wegner, I Schulzke and E Struck ; Frequency of trisomy 21 in Germany before and after the Chernobyl accident ; Biomedecine & Pharmacotherapy Volume 45, Issue 6, 1991, Pages 255-262 ; doi:10.1016/0753-3322(91)90026-P
- Ivan Zatsepina, Pierre Vergerb, Elisabeth Robert-Gnansiac, Corresponding Author Contact Information, E-mail The Corresponding Author, Bertrand Gagnièred, Margot Tirmarchee, Rostislav Khmela, Irina Babichevaa and Gennady Lazjukf ; Down syndrome time-clustering in January 1987 in Belarus: Link with the Chernobyl accident? ; in Reproductive Toxicology, Volume 24, Issues 3-4, Nov-Decr 2007, Pages 289-295 ; doi:10.1016/j.reprotox.2007.06.003
- Registre national de Biélorussie des malformations congénitales (1981-2001)
- V Odlind, A Ericson ; Incidence of legal abortion in Sweden after the Chernobyl accident Biomedecine & Pharmacotherapy, Volume 45, Issue 6, 1991, Pages 225-228 ; doi:10.1016/0753-3322(91)90021-K
- « naturally radiocesium-labeled feedstuffs » in W.W. Giese (1989), Countermeasures for reducing the transfer of radiocesium to animal derived foods ; Science of The Total Environment, Vol 85, September 1989, Pages 317-327 (résumé)
- Rowan D.J & Rasmussen J.B (1994) Bioaccumulation of radiocaesium by fish : the influence of physicochemical factors and trophic structure. Canadian Journal of Fisheries and Aquati c Sciences 51, 23882410|PDF, 23 pp
- SFEN, Accident de Tchernobyl - Conséquences dans d'autres pays européens - cas de la France (voir le paragraphe intitulé Activités des productions agricoles et produits naturels ; société française d'énergie nucléaire
- Ivanka Nikolova, Karl J. Johanson, Anders Dahlberg Radiocaesium in fruitbodies and mycorrhizae in ectomycorrhizal fungi ; Journal of Environmental Radioactivity, Volume 37, Issue 1, 1997, Pages 115-125 (résumé)
- H. Maubert, D. Robeau, P. Renaud, I. Linge, O. Pavlovski et I. Ossipiants (Institut de protection et de sûreté nucléaire, CE Cadarache, Institut de Sûreté nucléaire de Moscou,), Réflexions sur le respect des niveaux d'intervention dans un territoire contaminé par un dépôt accidentel de césium 137, Radioprotection 1995, Vol. 30, no 4, pages 495 à 508 ; Accepté : 4 avril 1995 et révisé : 7 février 1995, PDF, 14 pages (Résumé)
- Krivolutsky, D.A. 1994. Faune des sols et lutte écologique. Moscou, Fédération de Russie, Nauka. (en russe).
- Ipatyev, V. 2001. La construction de la «barrière biologique» dans les zones forestières contaminées par les radiations. Questions of Forest Sciences, 53: 153-158. (en russe).
- V.A. Ipatyev ; Réparer les dégâts de Tchernobyl: les forêts contaminées par les radiations et leur récupération ; les scientifiques cherchent à réduire les dangers des peuplements forestiers contaminés par les radiations, mais aucune solution à ce problème n'a encore été trouvée (lire l'article en ligne, en français) ; Revue UNASYLVA, FAO.
- Les conséquences de l'accident de Tchernobyl en France ; la contamination des produits agricoles Quelques cas particuliers de produits plus sensibles; Fiche information no 8 : Direction de l’environnement et de l’intervention
- Samira Faroussi, Said Belali, Ahmed Fahli, Said Fakhi, Mustapha Khomsi and Said Laachir ; Modélisation de profil du 137Cs par un modèle applicable à différents types de sols non remaniés ; Comptes Rendus Geosciences, Volume 339, Issue 2, February 2007, Pages 143-149
- Lysikov, A.B. (1995): Der Einfluss der Wühl aktivität von Schwarzwild auf den Prozeß der Wanderung von Radionukliden im Boden nahe des Kernkraftwerks Tschernobyl. Schriftenreihe für Ökologie, Jagd und Naturschutz, Band 3, 99-105
- Département de la santé des États-Unis, Toxicological profile for cesium, U.S. Department of health and humain services, Public Health Service Agency for Toxic Substances and Disease Registry April 2004
- Ulf Hohmann and Ditmar Huckschlag, 2005, Investigations on the radiocaesium contamination of wild boar (Sus scrofa) meat in Rhineland-Palatinate: a stomach content analysis ; European Journal of Wildlife Research Volume 51, Number 4, 263-270, DOI: 10.1007/s10344-005-0108-x (Résumé en anglais)
- Stara JF. 1965. Tissue distribution and excretion of cesium-137 in the guinea pig after administration by three different routes. Health Phys 11:1195-1202.
- Stara JF, Thomas RG. 1963. The tissue distribution and excretion of cesium-137 following inhalation: Preliminary data for rats. AEC Res Dev Rep LF-4.
- Paris, Le sol, un patrimoine menacé ? Le point scientifique, Congrès : Forum, Paris, 24 octobre 1996
- Knut Hove, Hans Staaland & Øyvind Pedersen, Hexacyanoferrates and bentonite as binders of radiocaesium for reindeer, 6 pages
- Åhman, B., Forberg, S. & Åhman, G. Zeolite and bentonite as caesium binders in reindeer feed. - Rangifer, Special issue No. 3: 73-82.
- Daburon, F., Archimbaud, Y., Cousi, J., Fayart, G., Hoffschir, D., Chevallereau, I. & Le Creff, H. 1991. Radiocaesium transfer to ewes fed contaminated hay after the Chernobyl Accident: Effect of vermiculite and AFCF (Ammonium Ferricyaferrate) as countermeasures. - Journal of Environmental Radioctivity, 14: 73-84
- Nigrovic, V. 1963. Enhancement of the excretion of radiocesium in rats by ferric cyanoferrate (II). - International Journal of Radiation Biology 7: 307-309.
Voir aussi
Articles connexes
Liens externes
- [PDF] IRSN, « Fiche radionucléide : Césium 137 et environnement »,
- [PDF] IRSN, « Fiche radionucléide : Césium 137 + Baryum 137m : Aspects sanitaires [PDF] », [PDF]
- [PDF] (en) Argonne National Laboratory, EVS, « Cesium », Human Health Fact Sheet,
- (en) ATSDR, U.S. Department of Health and Human Services, « Toxicological Profile for Cesium »,
Bibliographie
- Thiry Y, Ronneau C, Myttenaere C & During C (1992) Comportement du radiocésium en écosystème forestier contaminé lors d'un accident nucléaire. In Huitième Conférence Internationale de l'IPRA.
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
- Portail de la chimie
- Portail de la physique
- Portail du nucléaire