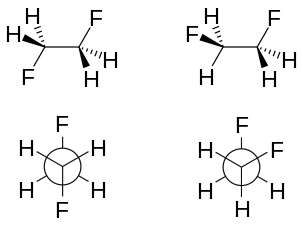
Effet gauche
L'effet gauche est une différence de stabilité résultant de la conformation d'une molécule. Cet effet concerne de nombreuses molécules, par exemple le 1,2-difluoroéthane H2FC–CFH2[1], pour lequel la conformation gauche est moins stable de 2,4 à 3,4 kJ/mol en phase gazeuse.
Le diméthoxyéthane est également dans le même cas.
Origine
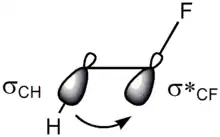
Les deux principales explications de l'effet gauche sont l'hyperconjugaison et les liaisons banane :
- l'hyperconjugaison s'expliquerait par un transfert de densité électronique depuis l'orbitale liante de la liaison σ C–H vers l'orbitale antiliante σ* de la liaison C–F, ce qui stabiliserait le conformère gauche. L'électronégativité plus élevée du fluor fait de l'orbitale σ de la liaison C–H un meilleur donneur d'électrons que l'orbitale σ de la liaison C–F, tandis que l'orbitale σ* de la liaison C–F est un meilleur accepteur d'électrons que l'orbitale σ* de la liaison C–H. La configuration gauche optimise le transfert d'électrons entre ces orbitales ;
- l'électronégativité du fluor accroît la nature d'orbitale p de la liaison C–F, ce qui accroît la densité électronique au-dessus et au-dessous sur la gauche et sur la droite de la liaison C–C axiale, et favorise la formation d'une liaison banane.
Entre ces deux modèles, on considère généralement que l'hyperconjugaison rend compte de l'essentiel de l'effet gauche observé dans le difluoroéthane[2],[3].
Observations et simulations
La géométrie moléculaire des rotamères peut être observée expérimentalement par spectroscopie infrarouge assistée de simulations in silico[1]. En accord avec les modèles décrits précédemment, la liaison C–C est plus longue dans le rotamère anti : 151,4 pm contre 150 pm. La répulsion stérique entre les deux atomes de fluor accroît l'angle de liaison CCF de 3,2° et fait passer l'angle dièdre FCCF de 60° à 71°.
Dans le 1,2-difluorodiphényléthane, composé apparenté au 1,2-difluoroéthane dans lequel deux atomes d'hydrogène sont remplacés chacun par un groupe phényle, l'observation du diastéréoisomère thréo par cristallographie aux rayons X et constante de couplage RMN montre qu'il possède une conformation anti entre les deux phényles et les deux atomes de fluor, tandis que le diastéréoisomère érythro présente une conformation gauche pour les deux groupes[4]. Les simulations numériques ont montré que cette conformation est plus stable de 880 J/mol.
L'effet gauche est très sensible au solvant en raison de la grande différence de polarité entre les deux conformères. Ainsi, le 2,3-dinitro-2,3-diméthylbutane, qui n'existe à l'état solide qu'en conformation gauche, favorise le conformère gauche à 79 % dans une solution de benzène C6H6, mais favorise le conformère anti à 58 % dans une solution de tétrachlorométhane CCl4.
Notes et références
- (en) Norman C. Craig, Anthony Chen, Ki Hwan Suh, Stefan Klee, Georg C. Mellau, Brenda P. Winnewisser et Manfred Winnewisser, « Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane », Journal of the American Chemical Society, vol. 119, no 20, , p. 4789-4790 (DOI 10.1021/ja963819e, lire en ligne)
- (en) Lionel Goodman, Hongbing Gu et Vojislava Pophristic, « Gauche Effect in 1,2-Difluoroethane. Hyperconjugation, Bent Bonds, Steric Repulsion », Journal of Physical Chemistry, vol. 109, no 6, , p. 1223-1229 (PMID 16833433, DOI 10.1021/jp046290d, Bibcode 2005JPCA..109.1223G, lire en ligne)
- (en) David O'Hagan, « Understanding organofluorine chemistry. An introduction to the C–F bond », Chemical Society Reviews, vol. 37, no 2, , p. 308-319 (PMID 18197347, DOI 10.1039/B711844A, lire en ligne)
- (en) David O'Hagan, Henry S. Rzepa, Martin Schüler et Alexandra M. Z. Slawin, « The vicinal difluoro motif: The synthesis and conformation of erythro- and threo- diastereoisomers of 1,2-difluorodiphenylethanes, 2,3-difluorosuccinic acids and their derivatives », Beilstein Journal of Organic Chemistry, vol. 2, , p. 19 (PMID 17014729, PMCID 1636058, DOI 10.1186/1860-5397-2-19, lire en ligne)
- Portail de la chimie
- Portail de la biochimie