Ehrlichia ruminantium
La cowdriose (également connue sous le nom de cowdriose, nintas et ehrlichiose ou Heartwater pour les anglophones) est une rickettsiose transmise par des tiques[1]. Son nom vient du fait que dans les cas mortels, on trouve généralement une accumulation de liquide dans le péricarde (la poche qui entoure le cœur ou dans les poumons des animaux infectés[2]. La maladie est causée par Ehrlichia ruminantium (anciennement Cowdria ruminantium ) - une protéobactérie coccique, intracellulaire obligatoire, à Gram négatif, appartenant à l’ordre des Rickettsiales et à la famille des Anaplasmataceae.

| MeSH | D016995 |
|---|
![]() Mise en garde médicale
Mise en garde médicale
Les vecteurs de cette maladie sont diverses tiques du genre Amblyomma.
Les impacts socio-économiques de cette maladie sont importants sur la production bovine dans les zones touchées.
Quatre manifestations documentées de la maladie ont été définis : aiguë, suraiguë, subaiguë et bénigne.
Des cas d'infections zoonotiques chez l'homme par E. ruminantium, similaires à d'autres espèces d'Ehrlichia, telles que celles qui causent l'ehrlichiose humaine, ont été signalés[3],[4],[5].
C'est une maladie émergente pour l'Humain[6].
Histoire
La cowdriose a été décrite pour la première fois en 1838 dans le journal personnel de Louis Trichardt, un Voortrekker en Afrique du Sud . Trichardt y a précisé qu'une majorité des moutons environnants étaient morts environ trois semaines après l'observation d'une importante infestation de tiques[7].
Dans un témoignage de 1877 à la Commission du Cap de Bonne-Espérance sur les maladies des moutons et des chèvres, l'éleveur J Webb a déclaré que l'apparition de tiques dans sa ferme 8 ou 9 ans plus tôt correspondait à l'apparition d'une maladie mortelle dans son bétail. Webb a rapporté avoir ouvert la poitrine des victimes et découvert que le "sac de cœur" était plein d'"eau".
« Le rôle de vecteurs des tiques a été élucidé en 1900 »[8].
La bactérie elle-même n'est isolée et identifiée qu'en 1925[8].
La maladie a atteint les îles des Caraïbes pour la première fois en 1980[2].
Son génome est complètement séquencé en 2005 et il est ensuite apparu que la bactérie présente une remarquable variabilité génétique qui rend difficile l'élaboration d'un vaccin durablement efficace dans tous les cas[9].
Distribution
La maladie est endémique en Afrique sub-saharienne, mais peut être trouvée partout où les tiques Amblyomma sont présentes. Les principales zones de préoccupation pour la maladie comprennent également Madagascar, Maurice, Zanzibar, les îles Comores et Sao Tomé . La cowdriose a été observée sur trois des îles des Caraïbes, la Guadeloupe, Marie-Galante et Antigua .
Dans les Caraïbes, au moins, le Héron garde-bœufs a été impliquée dans la propagation de la cowdriose, depuis qu'elle a colonisé les îles dans les années 1950[2].
Hôtes
Presque tous les bovidés sont sensibles à cette maladie, mais avec une sensibilité variable, le Zubu et le buffle d'eau semblant être les plus résistants[10]. Les espèces les plus sensibles à la cowdriose semblent être les chèvres [11],[12],[13]. Le buffle sud-africain, le bleskbok, le gnou noir, la pintade casquée, la tortue léopard et le lièvre des broussailles sont connus pour héberger la cowdriose sans symptômes, jouant donc probablement le rôle de réservoir pour le microbe et ses tiques vectrices[14].
Hôtes expérimentaux non-ruminants
En laboratoire, des non-ruminants tels que des furets, des souris de laboratoire et des mulots à quatre bandes ont montré une sensibilité à la maladie.
Signes cliniques
La maladie clinique est plus fréquente chez les jeunes animaux et les races non-autochtones.
Les signes cliniques de la maladie sont causés par une perméabilité vasculaire accrue et un œdème et l'hypovolémie qui en résultent.
Les symptômes comprennent :
- des signes neurologiques (tremblements, pression sur la tête),
- des signes respiratoires (toux, écoulement nasal
- des signes systémiques (fièvre, perte d'appétit) ; l'examen physique peut révéler des pétéchies sur les muqueuses, une tachycardie et des bruits cardiaques étouffés.
La cowdriose quand elle n'est pas mortelle, peut laisser des séquelles reproductives et gastro-intestinales.
Diagnostic
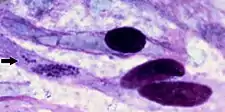
Lors de l'autopsie, un transsudat jaune clair, qui coagule au contact de l'air est souvent trouvé dans le thorax, le péricarde et l'abdomen. La plupart des cas mortels présentent un hydropéricarde (qui donne à la maladie son nom commun anglais). L'œdème pulmonaire et la congestion des muqueuses sont régulièrement observés avec un liquide mousseux dans les voies respiratoires et les surfaces des poumons tranchées à l'autopsie. Pour diagnostiquer définitivement la maladie, C. ruminantium doit être mis en évidence soit dans des préparations d'hippocampe sous coloration de Giemsa, soit par histopathologie cérébrale ou rénale.
Traitement et contrôle
Aux premiers stades de la maladie, les animaux peuvent être traités avec des sulfamides et des tétracyclines[15],[16].
En cas de maladie avancée, le pronostic est mauvais. Les tétracyclines peuvent également être utilisées à titre prophylactique quand des animaux sont introduits dans une zone endémique de cowdriose.
Lutte antivectorielle : les ectoparasiticides, utilisés sous forme de bains, peuvent être utilisés pour réduire l'exposition des animaux aux tiques Amblyoma. Dans les zones endémiques pour la cowdriose, l'utilisation de trempage, permet probablement d'aussi détruire d'autres tiques d'animaux domestiques telles que les espèces Rhipicephalus (Boophilus) et Hyalomma, ce qui contribue généralement au contrôle des vecteurs d'E. ruminantium .
Vaccins
Le vaccin commercial actuel est un vaccin sanguin vivant administré par voie intraveineuse (mais on a montré en 2020 que la voie intramusculaire est également efficace)[17] ; il utilise Ehrlichia ruminantium vivant (issu du sang de moutons infectés). Ce vaccin protège les animaux, y compris jeunes, mais il implique un traitement antibiotique contre la maladie après la vaccination. En outre, il ne protège pas contre tous les isolats sud-africains[17].
Plusieurs vaccins expérimentaux sont en cours de développement, par exemple les vaccins à ADN atténué, recombinant et multi-épitope [11],[18].
Mortalité
Selon l'espèce animale concerné, le taux de mortalité varie de 5% à 90%.
La mortalité semble la plus élevée chez les espèces ovines et caprines, mais ce n'est pas toujours le cas (certaines espèces ovines telles que l'Afrikaner ont des taux de mortalité ne dépassant pas 6%)[19].
Statut mondial
La cowdriose est une maladie à déclaration obligatoire ; elle doit être déclarée à l'Organisation mondiale de la santé animale (OIE).
États-Unis
Le département américain de l'Agriculture estime qu'une épidémie aux États-Unis pourrait coûter à l'industrie de l'élevage jusqu'à 762 millions de dollars de pertes par an. On craint que la tique porteuse de la maladie soit transportée par des oiseaux migrateurs des Caraïbes vers au moins la Floride. Les États-Unis ont préparé un plan de réponse pour atténuer les dommages et contenir toute propagation détectée[20].
Articles connexes
- Maladies à tiques
- Zoonose
- Maladie émergente (zoonotique)
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ehrlichia ruminantium » (voir la liste des auteurs).
- « Ehrlichia ruminantium infection (heartwater) in wild animals », Trends in Parasitology, vol. 18, no 5, , p. 214–8 (PMID 11983602, DOI 10.1016/s1471-4922(02)02251-1)
- « Heartwater » [archive du ], Animal and Plant Health Inspection Service, U.S. Department of Agriculture (consulté le )
- « Ehrlichia ruminantium: an emerging human pathogen? », Annals of the New York Academy of Sciences, vol. 1063, no 1, , p. 358–60 (PMID 16481543, DOI 10.1196/annals.1355.060, Bibcode 2005NYASA1063..358A, S2CID 35037984, lire en ligne)
- « Using local knowledge in emerging infectious disease research », Social Science & Medicine, vol. 258, , p. 113107 (PMID 32563166, PMCID 7292947, DOI 10.1016/j.socscimed.2020.113107)
- « Ehrlichia species, probable emerging human pathogens in sub-Saharan Africa: environmental exacerbation », Reviews on Environmental Health, vol. 26, no 4, , p. 269–79 (PMID 22435325, DOI 10.1515/REVEH.2011.034, S2CID 26448157, lire en ligne)
- Basil ALLSOPP, « Ehrlichia ruminantium: An Emerging Human Pathogen? », Annals of the New York Academy of Sciences, vol. 1063, no 1, , p. 358–360 (ISSN 0077-8923, DOI 10.1196/annals.1355.060, lire en ligne, consulté le )
- « Heartwater in Sheep and Goats », The Veterinary Journal (1900), vol. 55, no 9, , p. 157–161 (ISSN 0372-5545, DOI 10.1016/s0372-5545(17)72105-0, lire en ligne)
- (en) Basil A. Allsopp, Heartwater - Ehrlichia ruminantium infection, (ISSN 0253-1933, lire en ligne)
- (en) Basil A. Allsopp, « Natural history of Ehrlichia ruminantium », Veterinary Parasitology, vol. 167, nos 2-4, , p. 123–135 (DOI 10.1016/j.vetpar.2009.09.014, lire en ligne, consulté le )
- Pfukenyi et Mukaratirwa, « Amphistome infections in domestic and wild ruminants in East and Southern Africa: A review », Onderstepoort Journal of Veterinary Research, vol. 85, no 1, , e1–e13 (ISSN 2219-0635, PMID 30456960, PMCID 6244199, DOI 10.4102/ojvr.v85i1.1584, lire en ligne)
- (en) Zweygarth, Josemans et Steyn, « Experimental use of the attenuated Ehrlichia ruminantium (Welgevonden) vaccine in Merino sheep and Angora goats », Vaccine, vol. 26, , G34–G39 (PMID 19178891, DOI 10.1016/j.vaccine.2008.09.068, lire en ligne)
- Leask, Pettey et Bath, « An afebrile heartwater-like syndrome in goats », Journal of the South African Veterinary Association, vol. 84, no 1, (ISSN 2224-9435, DOI 10.4102/jsava.v84i1.955, lire en ligne)
- Ahmadu, Lovelace et Mahan, « Some observations on the sero-prevalence of heartwater and tick infestation in Zambian goats : research communication », Onderstepoort J Vet Res, vol. 71, no 2, , p. 161–164 (ISSN 2219-0635, PMID 15373339, DOI 10.4102/ojvr.v71i2.279, lire en ligne)
- « Tick Biolgy and Control. ed. G.B. Whitehead and J.D. Gibson. 222 pages. Proceedings of an International Conference held in January 1981 under the auspices of the Tick Research Unit, Rhodes University, Grahamstown, South Africa. ISBN 0 86810 047 1. Tick Research Unit, Rhodes University, Grahamstown, South Africa, 1982. », Parasitology, vol. 85, no 3, , p. 616 (ISSN 0031-1820, DOI 10.1017/s0031182000056420, lire en ligne)
- Purnell, Gunter et Schroder, « Development of a prophylactic regime using long-acting tetracycline for the control of redwater and heartwater in susceptible cattle moved into an endemic area », Tropical Animal Health and Production, vol. 21, no 1, , p. 11–19 (ISSN 0049-4747, PMID 2711456, DOI 10.1007/BF02297335, S2CID 26042627, lire en ligne)
- (en) Karrar et El Hag Ali, « Oral Treatment of Heartwater With Oxytetracycline (Terramycin Soluble Powder) », British Veterinary Journal, vol. 121, no 1, , p. 28–33 (ISSN 0007-1935, PMID 14267728, DOI 10.1016/S0007-1935(17)41404-7, lire en ligne)
- (en) Abdalla A. Latif, Helena C. Steyn, Antoinette I. Josemans et Ratselane D. Marumo, « Safety and efficacy of an attenuated heartwater (Ehrlichia ruminantium) vaccine administered by the intramuscular route in cattle, sheep and Angora goats », Vaccine, vol. 38, no 49, , p. 7780–7788 (DOI 10.1016/j.vaccine.2020.10.032, lire en ligne, consulté le )
- Collins, Pretorius, Kleef et Brayton, « Development of Improved Vaccines for Heartwater », Annals of the New York Academy of Sciences, vol. 990, no 1, , p. 474–484 (ISSN 0077-8923, PMID 12860676, DOI 10.1111/j.1749-6632.2003.tb07413.x, Bibcode 2003NYASA.990..474C, S2CID 26038896, lire en ligne)
- Deem, « Heartwater (cowdriosis): A review, 2nd edn », Parasitology Today, vol. 12, no 8, , p. 328 (ISSN 0169-4758, DOI 10.1016/0169-4758(96)80823-4, lire en ligne)
- « Heartwater - Emerging Pathogens Institute - University of Florida », www.epi.ufl.edu (consulté le )
Liens externes
- « Heartwater », Center for Food Security and Public Health, Iowa State University,
- « Heartwater - Cowdriosis », World Organisation for Animal Health (OIE),