Fécondation in vitro
La fécondation in vitro, en abrégé FIV (prononcé [fiv]) est une technique de procréation médicalement assistée et de transfert d'embryon. En 2007-2008, 2 % environ des bébés des pays riches sont issus de la fécondation in vitro, imaginée et mise au point dans les années 1970 et opérationnelle à partir des années 1980. Le nombre de bébés nés à la suite de l'utilisation de cette technique est estimé, tous pays confondus, à 4 millions d'enfants en 2012[1], passé à environ 8 millions en 2018[2].
Le nom complet est en réalité « fécondation in vitro et transfert d'embryon », soit l'acronyme FIVETE (prononcé [fivɛt][3]) qui est utilisé comme nom commun féminin. Ce nom, orthographié fivete[4],[5], est communément écrit fivète[6],[7] pour faciliter la lecture et être en accord avec sa prononciation.
Historique
La première fécondation in vitro est réalisée aux États-Unis par Miriam Menkin alors qu'elle travaille à ce sujet aux côtés du docteur John Rock[8]. La technique est approfondie au Royaume-Uni par les docteurs Patrick Steptoe et Robert Geoffrey Edwards[9]. Le premier « bébé-éprouvette », Louise Brown, est née le . En Inde, la deuxième FIV au monde a donné naissance à Durga et a été effectuée à Calcutta par le docteur Subhash Mukhopadhyay (en) le . Aux États-Unis, après les premiers essais inaboutis de Landrum Brewer Shettles, la première FIV du pays (ayant donné naissance à Elizabeth Carr) a eu lieu en 1981. Depuis cette date, on estime à 1 % des naissances le nombre de nouveau-nés conçus par cette technique. La première FIV en France[10] donna naissance à Amandine le à l'hôpital Antoine-Béclère de Clamart (Hauts-de-Seine). Elle a été réalisée grâce à la collaboration du biologiste Jacques Testart, du gynécologue René Frydman et du chef de service Émile Papiernik[11].
Cette technique fait régulièrement parler d'elle en raison des risques de dérives éthiques qu'elle peut générer (bébés à la carte, bébé-médicaments).
Statistiques
Depuis Louise Brown (1er bébé-éprouvette) en 1978, le nombre de fécondations in vitro n'a cessé d'augmenter. Au début des années 2000, près de 300 000 tentatives étaient effectuées chaque année en Europe avec un taux de grossesses menées à terme d'environ un tiers[12]. Toutefois, les taux de succès sont hétérogènes selon les pays.
Cette technique est efficace avec une conception dans 50 à 70 % des cas après 6 cycles, les chiffres décroissent rapidement avec l'âge de la femme[13].
En France, depuis « Amandine » (en 1982) à fin 2008, en 26 ans, environ 200 000 bébés (0,5 % des naissances) sont issus d'une fécondation in vitro, avec un taux qui augmente d'année en année (en France, environ 11 000 naissances sur 750 000[14]) ; Il s'agissait de stimulations ovariennes le plus souvent mais pour 0,8 % d'insémination artificielle et pour 1,7 % des cas de fécondation in vitro (FIV, dont le taux de succès s'est beaucoup amélioré (20 à 25 % des tentatives donnent au moins un enfant vivant). C'est la FIV qui a le plus progressé de 1998 à 2008 (de 0,52 % des naissances en 1988 à 1,74 % en 2006). En 2005–2006, 3 % seulement des enfants issus de FIV en France n'étaient pas issus des gamètes de leurs « parents biologiques » (304 enfants conçus par dons de sperme en 2006, 106 par don d'ovules et 10 par accueil d'embryons[15]). En France, 18 % des naissances issues de FIV donnent des jumeaux (contre 2 % pour l'ensemble des naissances)[16]. En France, 70 % des couples ayant tenté une FIV deviennent parents[17].
En août 2007, l'équipe du Dr Ernestine Gwet Bell était responsable de la naissance de 500 bébés par FIV au Cameroun[18].
L'agence de biomédecine, chargée de la régulation de ces pratiques en France, publie chaque année un rapport officiel sur le nombre, le type et l'issue des tentatives de FIV pratiquées à la fois dans les centres publics et privés français.
Principes opératoires
Fécondation
Lors d'un cycle normal et non stimulé, un seul ovocyte dans lequel se trouve un ovule est produit dans un des deux ovaires de la femme. Dans le cadre d'une FIV, les ovaires sont stimulés afin de faire grossir simultanément plusieurs ovocytes. Généralement, des injections journalières sont nécessaires. La stimulation est surveillée par de multiples prises de sang et échographies. Ces injections d'hormones permettent aussi de provoquer la croissance puis la maturation des ovocytes. Une injection destinée à accélérer le mûrissement des ovules est réalisée 36 heures avant la ponction ovocytaire. La ponction des ovocytes s'effectue généralement en ambulatoire en milieu hospitalier sous anesthésie générale légère ou locale. Le sperme est recueilli le jour de la ponction des ovocytes (quelquefois avant s'il a été congelé), il est ensuite « nettoyé » de son plasma séminal et préparé afin de récupérer les spermatozoïdes les plus mobiles et les plus typiques (normaux). Le sperme de l'homme, préparé techniquement pour améliorer la qualité spermatique, est mis en contact, au sein d'un laboratoire d'analyses médicales spécialement autorisé, avec les ovules de la femme. Environ 100 000 spermatozoïdes sont mis en contact avec chaque ovocyte recueilli. La fécondation a lieu en une douzaine d'heures. L'apparition de pronuclei indique le début d'une fécondation. L'embryon se développe alors par division cellulaire. Il est courant d'obtenir de 5 à 6 embryons en moyenne, bien que ce nombre puisse aller jusqu'à une trentaine. Les embryons sont mis en culture de 48 heures à 6 jours. Deux, trois ou cinq jours (blastocystes) après le jour de la fécondation, un ou plusieurs embryons sont transférés dans l'utérus de la femme.
Les embryons sont classés en fonction de leur qualité cellulaire, à savoir : leur nombre de cellules, leur régularité (tailles de cellules différentes ou non), et de leur fragmentation. Les embryons utilisés en priorité sont ceux dont la chronologie de la division cellulaire est respectée, avec des cellules bien régulières et sans fragmentation, ces paramètres étant censés être un indicateur des meilleures chances de grossesse.
Transfert
Le transfert embryonnaire est une opération visant à replacer un ou plusieurs embryons au sein de la cavité utérine, il s'opère dans la majorité des cas par introduction d'un cathéter dans l'utérus en passant par le col cervical. Le transfert embryonnaire n'est pas douloureux et ne nécessite pas d'anesthésie.
En cas de sténose du col (impossibilité de franchissement du col) certaines équipes pratiquent de façon exceptionnelle le transfert par voie dite trans-myomètriale (introduction d'une aiguille dans le muscle utérin, puis dépose des embryons dans la cavité utérine).
Immédiat
Les embryons sont habituellement transférés dès l'obtention des premières divisions. Le transfert embryonnaire peut être pratiqué le jour suivant la ponction (stade zygote), le lendemain (transfert à « J2 »), le surlendemain (transfert à « J3 ») ou, de plus en plus, cinq jours après la fécondation (blastocystes).
Les chances de grossesses sont augmentées en cas de transfert au stade blastocyste mais tous les embryons ne se développent pas jusqu'à ce stade.
Une société suisse propose une alternative qualifiée de « fécondation assistée in vivo » par ses promoteurs, dans laquelle la fécondation a lieu en éprouvette (donc in vitro), mais où l'embryon est provisoirement implanté dans l'utérus deux heures après les premières divisions. Cette implantation se fait grâce à un petit tube de 1 cm de long et d'1 millimètre de diamètre. L'embryon est placé dans ce tube pourvu de 280 trous d'un diamètre de 40 microns. Au bout de 18 heures, le tube est retiré de l'utérus ; les embryons sont triés puis réimplantés dans l'utérus. Cette méthode permettrait d'augmenter la qualité des embryons, sans toutefois augmenter les probabilités de grossesse[1].
Retardé
Le transfert peut être plus tardif et la phase de culture est prolongée cinq à six jours après la fécondation. Les embryons sont maintenus en culture jusqu'au stade blastocyste. Ces cultures prolongées nécessitent le recours à des milieux spéciaux. L'avantage du transfert au stade blastocyste est de permettre un contrôle du début de la croissance embryonnaire, en dépassant le stade du troisième jour de développement embryonnaire, stade critique du développement où surviennent de nombreux arrêts de mitose de l'embryon (blocage de division). Les blastocystes ont également un meilleur taux d'implantation car, physiologiquement l'embryon arrive dans la cavité utérine au 4e jour suivant la fécondation. L'implantation embryonnaire, phénomène englobant l'éclosion du blastocyste (sortie de la membrane pellucide), puis l'implantation à proprement parler (adhésion de l'embryon à l'endomètre, suivie de l'enfouissement de l'embryon au sein de la muqueuse endomètriale) ayant lieu au 6e-7e jour après la fécondation. Dans le cadre d'un diagnostic préimplantatoire, les blastomères sont prélevés sur l'embryon pour analyse au 3e jour. Les embryons sains peuvent être transférés dès l'obtention des résultats, généralement au 5e-6e jour.
Différé
Les embryons non transférés à l'état frais peuvent être conservés par congélation, en vue d'un replacement ultérieur, à la condition toutefois qu'ils soient d'une qualité suffisante. Les embryons qui ont été préalablement congelés lors du premier transfert, sont décongelés et sélectionnés la veille ou le jour du transfert, qui a lieu selon le même protocole. Le taux d'implantations réussies après transfert d’embryons congelés sont équivalents à celui du transfert d'embryon frais. Cette technique permet d’augmenter le nombre de transferts (et donc les chances de grossesse) à partir d’une seule ponction.
Généralement un maximum de deux embryons sont transférés dans l'utérus afin de limiter le risque de grossesses multiples. En fonction de la qualité des autres embryons obtenus, ceux-ci peuvent être congelés pour un transfert ultérieur. Ceux-ci pourront être réutilisés en cas d'échec ou si les parents souhaitent avoir un autre enfant. Cette technique est appelée « transfert d'embryons congelés ». Il est possible de congeler des zygotes (œuf fécondé à 2 pronuclei), des embryons au stade de 4 à 8 cellules ou des blastocystes.
Depuis 2012, les centres français se sont pour la plupart équipés du matériel permettant une congélation rapide des embryons : la vitrification embryonnaire. Cette technique permet une congélation flash des embryons et réduit l'apparition de cristaux dans les embryons. Lors de la décongélation des embryons en vue d'un transfert, il y a moins de perte pour les embryons ayant été vitrifiés que pour ceux ayant été congelés à vitesse lente.
Une congélation de l'ensemble des embryons sans transfert d'embryons frais peut être réalisé s'il y a un risque pour la patiente de présenter une hyper-stimulation ovarienne, si les conditions d'implantations ne sont pas optimales (progestérone augmentée au moment du déclenchement de l'ovulation, endomètre de mauvaise qualité), si une étude génétique sur les embryons est nécessaire.
La vitrification ovocytaire est depuis 2012 en France une alternative à la vitrification embryonnaire.
Implantation
Après ce transfert, environ 12 jours sont nécessaires pour avoir l’assurance qu’une grossesse se développe. C’est en effet le temps nécessaire pour qu’apparaisse dans le sang, à concentration détectable la β-HCG, l’hormone sécrétée par l’embryon qui sert de diagnostic à la grossesse.
• Si le taux de β-HCG est nettement supérieur à 50 mUI/ml après 10 jours, c’est le signe d’un début de grossesse.
• Si le taux de β-HCG est inférieur à 50 mUI/ml : il peut s’agir d’un taux résiduel d’hormones lié à la stimulation. Il convient de refaire un dosage de contrôle 48 heures plus tard afin de vérifier si le taux augmente ou au contraire diminue.
L'implantation reste l'étape limitante pour la réussite de la fécondation in vitro. Plusieurs techniques ont été testées pour essayer d'augmenter les chances de succès et ont une efficacité modérée : utilisation de gonadotrophines[19], modification mécanique de la zone pellucide entourant l'embryon[20] ou implantation multiple. L'acupuncture pourrait être également une technique douée d'une certaine efficacité[21].
Injection intracytoplasmique de spermatozoïdes
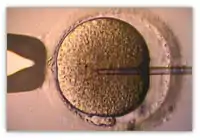
L'injection intracytoplasmique de spermatozoïde (ICSI) est une technique qui tente de remédier aux cas où les spermatozoïdes ne peuvent pas féconder spontanément l'ovule. Elle se passe in vitro et consiste à injecter directement un spermatozoïde dans l'ovule. Le transfert des embryons obtenus est ensuite identique à celui d'une FIV.
Techniques connexes
Il a été constaté que l'implantation d'un seul embryon échoue dans 86,34 % des cas. C'est pourquoi pour augmenter les chances de grossesse, l'équipe médicale transfère parfois 2 à 3 embryons, ceci en fonction des paramètres cliniques et biologiques en leur possession et après discussion avec le couple.
En cas d'endométriose
L'endométriose (quelle que soit son type et son stade) ne semble pas modifier les résultats d'une FIV en termes de taux de grossesse et de nombre de naissance vivante. Cependant le nombre d’ovocytes recueillis est plus faible (surtout si l'endométriose est sévère)[22].
Selon la littérature médicale, en cas d'endométriose sévère, la grossesse a plus de chance de se produire 'il y a un blocage ovarien avant stimulation pour FIV par un analogue agoniste de la GnRH ou par la contraception œstroprogestative[22]. La chirurgie n'es pas nécessaire en cas d'endométriose peu importante et n'affectant pas la fertilité, mais peut être utile en cas d’échec de FIV afin, pour de meilleurs résultats de l’AMP[22]. Si l'endométriose est récurrente, la chirurgie ne donne pas de meilleurs résultats que la FIV, le choix pouvant se faire lors d'une concertation médicochirurgicale[22]. Et la stimulation de l'ovulation pour FIV ne semble pas aggraver les symptômes induits par les lésions d’endométriose, ni en accélérer l'évolution ou accroitre le taux de récidive[22].
Aspects éthiques
Les techniques de la procréation médicalement assistée peuvent être mises en pratique selon deux formules :
- avec un don de cellules (c'est ce que désigne la lettre « D » après « IA » dans « IAD » : « insémination artificielle avec sperme d'un donneur ») ;
- avec les cellules des deux conjoints exclusivement (c'est ce que désigne la lettre « C » après « IA » dans « IAC » : « insémination artificielle avec sperme du conjoint »).
Les problèmes bioéthiques liés à la FIV sont nombreux :
- Manipulation de la vie dès son commencement : tentation d'eugénisme
- Congélation des embryons : statut juridique et moral de l'embryon (cf. personne physique en droit français). Devenir de l'embryon congelé, notamment en cas du décès du père[23]. Enfants conçus simultanément mais nés à plusieurs années d'intervalle.
- Risque de naissances multiples, augmentation du risque de prématurité.
- Risque d'anomalies génétiques (remarque : des chercheurs japonais ont constaté dans une étude pilote préalable à la reproduction de ouistitis génétiquement modifiés que les embryons de singes issus d'une fécondation naturelle étaient plus susceptibles d'exprimer un transgène que les embryons obtenus par fécondation in vitro[24]).
- Réduction embryonnaire en cas de grossesse multiple, posant les mêmes problèmes éthiques que l'avortement.
- Débat sur la notion de paternité ou maternité biologique et d'intention : gestation pour autrui, donneur de sperme, donneuse d'ovule. Qui est le père ? Qui est la mère ?
- Possibilité de trafic d'embryons dans des pays dont la réglementation n'est pas suffisamment stricte
- Sort des embryons non transférés après la fin du projet parental
- Faut-il tester les embryons à réimplanter dans certains cas (famille avec maladie héréditaire, embryon thérapeutique) ?
Injection intracytoplasmique de spermatozoïdes sélectionnés
L’IMSI (injection intracytoplasmique de spermatozoïde morphologiquement sélectionnés) est la plus récente technique d’assistance médicale à la procréation, l’IMSI est une évolution de l'ICSI qui permet une meilleure sélection du spermatozoïde qui est injecté dans l’ovocyte grâce à l’utilisation d’un microscope à fort grossissement (jusqu'à 6000X)[25]. L’IMSI présente de nombreux avantages, notamment dans le cas de la tératozoospermie, lorsque la majorité des spermatozoïdes présentent une forme atypique.
Objections religieuses
L'Église catholique est pour les méthodes de procréation médicalement assistée qui associent la conception d'un enfant de l'acte sexuel entre époux. Certains théologiens estiment licite le transfert intratubaire de gamètes - malgré le clair désaccord de la congrégation pour la doctrine de la foi[26]-, à certaines conditions, parce que la fécondation a lieu à l'intérieur du corps de la femme et pas dans une boîte de Petri[27].
Elle appelle les couples sans enfants à « rendre d'autres services importants à la vie des personnes humaines, tels par exemple que l'adoption, les formes diverses d'œuvres éducatives, l'aide à d'autres familles, aux enfants pauvres ou handicapés[28], ou à utiliser les méthodes naturelles de traitement de la stérilité, comme la méthode FertilityCare créée par le Thomas Hilgers en réponse à l'appel du pape Paul VI dans Humanae Vitae.
Selon l'Église catholique, les techniques de procréation médicalement assistée, lorsqu'elles font appel à un donneur (fécondation hétérologue) « lèsent le droit de l'enfant à naître d'un père et d'une mère connus de lui et liés entre eux par le mariage »[29].
L'Église catholique est également opposée à la fécondation homologue (sans donneur extérieur au couple) à cause de la dissociation entre la sexualité au sein d'un couple marié et la procréation[30]. Selon les considérations de Pierre Olivier Arduin, directeur de la commission bioéthique de l’Observatoire sociopolitique du diocèse de Fréjus-Toulon, en réponse à une question sur Aleteia, les protagonistes de la conception ne sont alors plus les parents se donnant l'un à l'autre, mais un technicien[31].
En outre, des embryons sont supprimés par ces méthodes, ce qui cause leurs décès, ou bien congelés. Les catholiques voient les embryons comme des vies humaines avec autant de droits que les autres et, pour cette raison, considèrent que la destruction d'embryons est inacceptable[32]. D'autres religions (islam, judaisme, église orthodoxe) ont des avis proches ; le protestantisme est la religion la plus ouverte sur ce sujet[33],[34].
Risques sur la santé des enfants
Une étude suisse de 2012 a mis en évidence un risque accru pour les enfants conçus via des techniques de procréation assistée de développer des maladies cardiovasculaires[35]. Tous les enfants de la cohorte étudiée (67 enfants) présentaient des fonctions altérées du système cardiovasculaire par rapport au groupe témoin de 57 enfants nés par méthode naturelle : pression systolique de l'artère pulmonaire plus élevée en moyenne de 30 % en haute altitude, dilatation au flux des artères brachiales inférieure en moyenne de 25 %, vitesse d'onde de pouls carotido-fémorale plus élevée et épaisseur plus grande des intima et média de la carotide[36].
Des études précédentes avaient fait apparaître un risque de malformations congénitales doublé[37].
Risques pour la recherche médicale
La chercheuse Laura Hercher souligne les risques que représentent la médecine génétique et les manipulations d’ADN pour la recherche médicale. Ces techniques sont, aux États-Unis, disponibles uniquement pour les familles les plus aisées (la fécondation in vitro coute 20 000 dollars par cycle, auxquels s'ajoutent 10 000 dollars de frais de laboratoire quels embryons ne sont pas porteur de la maladie)[38].
Selon la chercheuse : « Les familles aisées font la pluie et le beau temps dans la lutte contre les maladies dont souffrent leurs membres, montent des associations, attirent l'attention des médias. Les ménages modestes n'ont pas ce pouvoir. Ils sortiront à coup sûr perdant des "olympiades des maladies", ce jeu à somme nulle où les groupes de pression cherchent à orienter les fonds alloués à la recherche vers la maladie qui les préoccupe. En outre, ils pourraient se trouver confrontés à un déficit d'empathie croissant. Si une partie de la population se sent protégée, elle n'aura peut-être pas le réflexe de compassion qu'entraine généralement l'idée qu'on aurait pu être à la place d'une personne malade ou handicapée. Protéger son enfant apparaitrait alors comme une affaire de compétence et de responsabilité parentales. Là où la société voyait de la malchance, elle verrait une faute, et rechignerait à "payer pour les erreurs des autres"[38]. »
Cadre juridique
En Suisse
Afin de bénéficier d’une fécondation in vitro ou d'une injection intracytoplasmique de spermatozoïde, les conditions suivantes doivent être remplies :
- il n’existe pas / plus d’autre moyen de traitement ;
- le couple a pu avoir un entretien complet sur les chances et les risques d’une FIV ou d'une injection intracytoplasmique de spermatozoïde et avoir eu la possibilité de demander un soutien psychologique ;
- le couple a signé un consentement au traitement et à la congélation des zygotes ;
- un mois de réflexion s’est écoulé entre la signature du consentement et le début du traitement.
En France
En France, la fécondation in vitro est autorisée pour un couple présentant une infertilité pathologique, ou pour éviter la transmission d'une maladie d'une certaine gravité à l'enfant. Les règlementations mise en place par l'État stipulent que, pour avoir accès à la procédure, un homme et une femme doivent vivre ensemble, être en vie, et dans l'âge de procréer. Le couple ne peut pas légalement avoir recourt à l'intervention si la femme a atteint la ménopause[39].
L'embryon doit être conçu à partir des gamètes d'au moins un des membres du couple. Un embryon ne peut être conservé plus de 5 ans. Le don de gamètes est gratuit et anonyme. Si le donneur est dans un couple, les deux membres du couple du donneur et des receveurs doivent donner leur consentement[40].
Notes et références
- « Le premier bébé né par fécondation in vivo a vu le jour à Genève » Le Temps, 15 décembre 2009.
- European Society of Human Reproduction and Embryology. (2018, July 3). More than 8 million babies born from IVF since the world's first in 1978: European IVF pregnancy rates now steady at around 36 percent, according to ESHRE monitoring. ScienceDaily. Retrieved May 25, 2020 |source = www.sciencedaily.com/releases/2018/07/180703084127.htm
- « fivete », sur fr.wiktionary.org (consulté le )
- « fivete », sur larousse.fr (consulté le )
- « fivete », sur universalis.fr (consulté le )
- « fivète », sur fr.wiktionary.org (consulté le )
- « fivète », sur lerobert.com (consulté le )
- (en) Rachel E. Gross, « The female scientist who changed human fertility forever », sur www.bbc.com, (consulté le )
- (en) Steptoe PC, Edwards RG, « Birth after the reimplantation of a human embryo », Lancet, vol. 312, no 8085, , p. 366. (PMID 79723, DOI 10.1016/S0140-6736(78)92957-4)
- De nombreux échecs s'étaient produits avant cette première, en raison d'échecs d'implantation de l'embryon et d'un taux d'accouchement inférieur à 20 %. D'octobre 1980 à décembre 1981, 109 femmes avaient précédemment subi 129 cœlioscopies, ayant donné lieu à sept débuts de grossesse, dont deux seulement s'étaient maintenues, la première donnant naissance à Amandine. Source : Jean Claude Simoën, L'Express. L'hebdomadaire de notre histoire, Plon, , p. 347.
- Testart J, Frydman R, « Accouchement à terme après transfert in utero d'un embryon obtenu par fécondation externe. [Full-term delivery after intrauterine implantation of an embryo obtained by in vitro fertilization] », J Gynecol Obstet Biol Reprod (Paris), vol. 11, no 7, , p. 855-9. (PMID 7161457)
- Nyboe Andersen A, Gossens V, Gianaroli L, Felberbaum R, de Mouzon J, Nygren KG, Assisted reproductive technology in Europe, 2003. Results generated from European registers by ESHRE, Hum Reprod, 2007;22:1513-25
- Malizia BA, Hacker MR, Penzias AS, Cumulative live-birth rates after In Vitro fertilization, N Eng J Med, 2009;360:236-243
- http://pma.alwaysdata.net/
- Article d'Élise de La Rochebrochard (INED-INSERM), Revue Population et Sociétés, janvier 2009, 4 p.
- Pierre Jouannet, Quelle procréation pour demain ?, Pour la Science, no 422, (décembre 2012), p. 66-73
- « FIV : un test double les chances de réussite » (consulté le )
- Marion Obam, Mutations, « Cameroun: Ernestine Gwet Bell, la mécanicienne des embryons », sur fr.allafrica.com, (consulté le )
- Coomarasamy A, Afnan M, Cheema D, van der Veen F, Bossuyt PM, van Wely M, Urinary hMG versus recombinant FSH for controlled ovarian hyperstimulation following an agonist long down-regulation protocol in IVF or ICSI treatment: a systematic review and meta-analysis, Hum Reprod, 2008;23:310-5
- Edi-Osagie E, Hooper L, Seif MW, The impact of assisted hatching on live birth rates and outcomes of assisted conception: a systematic review, Hum Reprod 2003;18:1828-35
- Manheimer E, Zhang G, Udoff L et als. Effects of acupuncture on rates of pregnancy and live birth among women undergoing in vitro fertilisation: systematic review and meta-analysis, BMJ, 2008;336:545-549
- C. Chauffour, J.-L. Pouly et A.-S. Gremeau, « Prise en charge en FIV en cas d’endométriose, RPC Endométriose CNGOF-HAS », Gynécologie Obstétrique Fertilité & Sénologie, vol. 46, no 3, , p. 338–348 (DOI 10.1016/j.gofs.2018.02.015, lire en ligne, consulté le )
- Avis sur le transfert d'embryons après décès du conjoint (ou du concubin). (1993-12-17) Rapport du Comité consultatif national d'éthique
- SASAKI Erika et al. ; Generation of transgenic non-human primates with germline transmission ; Nature vol 458 p. 523-527 ; 28/05/2009
- PMA: La fécondation in vitro, l'ICSI et l'IMSI
- Dignitas Personae § 12 www.vatican.va
- loras.edu
- Souverain Pontife Jean-Paul II, « Instruction sur le respect de la vie humaine naissante et la dignité de la procréation. Réponses à quelques questions d'actualité. », sur vatican.va, (consulté le )
- paragraphe 2376 Catéchisme de l'Église catholique - Article 6 : Le sixième commandement. III. L’amour des époux [, site viechretienne.catholique.org (consulté le 07 Janvier 2021)
- Instruction Dignitas Personae (Congrégation pour la doctrine de la foi, 2008), § 12.
- Pierre Olivier Arduin, « Peut-on admettre l’assistance médicale à la procréation (PMA) ? », sur Questions de fond Aleteia.
- [https://fr.zenit.org/2008/12/12/dignitas-personae-instruction-vaticane-sur-certaines-questions-de-bioethique/ Dignitas Personae : Instruction vaticane sur certaines questions de bioéthique - ZENIT, Anita S. Bourdin, 12 Décembre 2008
- Les différentes religions et la FIV sur fiv.fr
- Mathieu Séverine, « Religion et assistance médicale à la procréation », Sociologie, vol. 3, , p. 267-281 (DOI 10.3917/socio.033.0267, lire en ligne)
- « La fécondation in vitro : un miracle à surveiller », sur lapresse.ca 15 mai 2012
- (en) Scherrer U, Rimoldi SF., Rexhaj E., Stuber T, Duplain H., Garcin S., de Marchi SF., Nicod P., Germond M., Allemann Y. et Sartori C., « Systemic and pulmonary vascular dysfunction in children conceived by assisted reproductive technologies », Circulation, (DOI 10.1161/CIRCULATIONAHA.111.071183, lire en ligne, consulté le )
- J. Guibert, C. Davy, F. Olivennes« Le suivi des enfants nés par assistance médicale à la procréation », Réalités en gynécologie-obstétrique, no 108, février 2006, p. 33.
- Laura Hercher, « Des riches génétiquement modifiés », sur Le Monde diplomatique,
- « La législation en vigueur », sur Fiv.fr (consulté le )
- Loi n° 94-653 du 29 juillet 1994 relative au respect du corps humain (lire en ligne)
Voir aussi
Articles connexes
- Médecine, recherche, éthique
- Éthique, Bioéthique, Fraude à fertilité
- Diagnostic préimplantatoire
- Santé reproductive, Santé-environnement,
- Fertilité,
- Biologie de la reproduction
- Reproduction (biologie), Procréation,
- Clonage,
- Fécondation in vivo assistée,
- CECOS, Don de sperme, Banque du sperme.
- Gonades
- Gamète, Gamétogénèse,
- Ovaire, ovules,
- Ovogenèse
- spermatogonies,
- Cellules de Leydig,
- Cellules de Sertoli,
- spermatogenèse, Spermiogenèse
- Spermatozoïde
- Sperme,
- spermogramme, Spermocytogramme,
- Compétition spermatique
- Système hormonal
- Système endocrinien,
- Hormone,
- Testostérone,
- Gonadostimulines,
- Hypophyse,
- Glande surrénale
- Hormone lutéinisante ou LH (contrôle la sécrétion pulsatile de testostérone)
- Hormone folliculo-stimulante ou FSH
- Perturbateur endocrinien
- Fécondation assistée
- Malformations, anomalies
- Diphallia et triphallia
- Hypospadias
- Micropénis
- Distance ano-génitale (indice chez le garçon d'exposition prénatale à des hormones féminisantes)
- Délétion de la spermatogenèse
- Tératospermie
- Azoospermie
- Asthénospermie
- Oligoasthénotératospermie ou oligospermie
- Nécrospermie
- Cryptozoospermie
- Cancers ;
- Divers ;
- Portail de la sexualité et de la sexologie
- Portail de la médecine
- Portail des femmes et du féminisme