Extraction des métaux par digestion acide
L’extraction des métaux par digestion acide ou digestion acide des métaux est une technique analytique de séparation préparatoire visant à extraire des analytes métalliques à partir de leur matrice minérale et organique. Cette extraction est réalisée en solubilisant les métaux dans l’acide. Ainsi débarrassée des autres matières, l’analyse de la solution acide permettra d’obtenir aisément les informations sur les différents analytes présents avec la méthode appropriée.
Une autre technique couramment utilisée pour extraire des analytes métalliques est l’extraction des métaux par calcination.
Histoire de la digestion acide
Les acides étaient majoritairement utilisés pour séparer des amalgames de métaux, notamment pour purifier l’or d’impuretés. Les acides singuliers, avant l’arrivée de l’aqua regia, même à concentration élevée, n’arrivaient pas à dissoudre l’or. L’aqua regia, signifiant l’eau royale, en latin, porte ce nom, car elle était la seule substance capable de dissoudre le roi des métaux, soit l’or, à l’époque. Étant alors considéré le métal le plus fort et le plus pur, il était nommé le roi[1]. Les alchimistes l’appelaient sol (provenant d’une notation où certains métaux représentaient les astres visibles à l’époque) et idéalisaient l’or, car il était le plus inerte et pur, notamment dû à sa résistance à la corrosion, triomphant sur tous les autres[2].
L'aqua regia aurait été découvert en Perse lors du IXe siècle, mais n'aurait fait parution en Europe qu'au XIIIe siècle, lorsque les travaux expliquant la méthode ont été traduits au latin et ont ainsi pu se répandre à un plus grand public[3].
Il faut donc faire baigner l’or impur dans l’acide pour que les autres métaux impurs se dissolvent et ainsi que l’or se purifie[4]. Cette technique remonte aux premières applications de digestion acide des métaux. Elle n’est pas considérée comme une technique de séparation préparatoire analytique à ce temps-là. C’est en fait Carius, dans les environs de 1860, qui commença à utiliser la digestion acide des métaux comme technique analytique. La technique consistait à dissoudre dans l’acide des composés organiques halogénés et du nitrate d’argent dans un tube appelé tube de Carius, afin de récupérer l’halogène depuis la forme halogénée de l’argent[5]. Le but initial n'était pas de solubiliser un métal, soit l'argent ici, dans l'acide, mais plutôt de pouvoir contenir un halogène dans une solution acide métallique.
La méthode de digestion acide continue d’être utilisée pour récupérer les métaux, mais sans le tube de Carius, du fait de sa nature hasardeuse, favorisant plus tard la digestion acide des métaux par voie humide chauffé à flamme ou à plaque chauffante. La technique fut révolutionnée dans les années 1980 avec le chauffage par micro-ondes[6]. Cette méthode permettait d’accélérer grandement ce processus analytique, rendant la technique beaucoup plus pratique et accessible.
Méthodes de digestion acide
Plusieurs méthodes de digestion ont été développées pour extraire des métaux en traces dans des matrices complexes contenant une grande quantité de substances organiques ou autres composants complexes. Chacune de ces méthodes possède des avantages et des inconvénients. Leurs utilisations vont dépendre de plusieurs facteurs ; la facilité d’exécution, la préparation nécessaire, l’instrumentation disponible et l’efficacité de récupération. Toutefois, chacune de ces méthodes a pour but commun de détruire la matrice organique et de dissoudre les métaux à doser, ce qui réduira alors la possibilité d’effet de matrice et d’autres interférences[7]. Par exemple, les échantillons de sols et de sédiments peuvent contenir des éléments en traces dont il est dans l’intérêt de déterminer la teneur, comme des métaux lourds. Toutefois, ces matrices complexes contiennent plusieurs composés qui pourrait être sources de contaminations et qui pourrait fausser les valeurs, soit la présence de composantes organiques, d’oxydes, de silicates, d’argile, etc[8]. La teneur en éléments traces pouvant être déterminés à l’aide de la digestion acide sont les métaux tels que ; l’aluminium, le cadmium, le chrome, le cuivre, le fer, le magnésium, le manganèse, le sélénium, le nickel, le zinc, etc[9]. Après la digestion, l’analyte est converti sous une forme adaptée où il peut être analysé par l’appareil d’analyse choisi (par exemple : ICP-AES)[9]. Une étape importante pour toute méthode de digestion est la validation de la méthode. Ceci implique que peu importe la technique utilisée pour extraire les métaux de la matrice, un échantillon standard certifié devra subir le même traitement[7],[9]. Cela permet d’assurer et de contrôler la qualité de la méthode. De plus, cela permet de corriger les valeurs obtenues si besoin et de déterminer de façon fiable l’efficacité de récupération des différentes méthodes pour chacun des métaux dosés[7],[9]. Les trois principales méthodes de digestion des métaux sont ; la digestion humide à contenant ouvert, la calcination à sec (Dry ashing) et la digestion acide assistée par micro-onde. Avant d’amorcer la digestion acide par l’une des méthodes énumérées précédemment, il est possible de devoir prétraiter l’échantillon d’une façon quelconque pour que celui-ci soit prêt pour la digestion en question, par exemple en séchant l’échantillon à l’air ou bien encore de broyer l’échantillon afin de permettre une meilleure digestion en augmentant la surface de contact pour l’acide[7].
Digestion humide à contenant ouvert
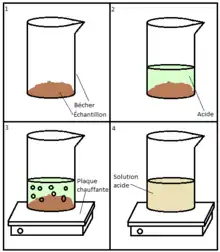
Comme le dit le nom de la méthode, la digestion se fait dans un contenant ouvert, préférablement en verre pour la plupart des acides. Un simple bécher peut suffire comme contenant. Toutefois, si l’utilisation de HF est nécessaire, un autre type de contenant doit être utilisé, car celui-ci dissout le verre selon la réaction suivant : :SiO2(s) + 6 HF(aq) → H2[SiF6](aq) + 2 H2O[10]. Pour cela, l’acide fluorhydrique est manipulé avec précaution et dans des contenants de plastique ou des récipients de polymères fluorisés[10]. De plus, la digestion est dite humide, car elle se fait à l’aide de solution concentrée en acide. La majorité des digestions acides se font en milieux oxydant, soit en ajoutant un agent oxydant ou en utilisant un acide qui est à la fois oxydant[7],[8],[9]. L’ajout d’oxydant augmente la pourvoir oxydant de l’acide[11]. L’oxydation lors de la digestion acide est très importante, car elle permet de minéraliser la matière organique en la convertissant sous forme d’eau (H2O) et de dioxyde de carbone (CO2)[11]. Afin que la digestion de la matrice organique soit efficace, les acides en question doivent être des acides inorganiques forts et dont le taux de pureté est élevé. L’importance d’utiliser des acides de hautes puretés est due au fait que la méthode se veut d’analyser des éléments souvent présents sous forme de traces. Donc, la présence d’impuretés dans les acides peut facilement fausser les résultats lors de l’analyse. La méthode se veut très simple, l’échantillon est d’abord déposé dans un bécher de verre propre, puis il est mélangé avec un acide oxydant fort, un mélange d’acides ou un mélange d’acides et d’agents oxydants[7],[8],[9]. Bien que la digestion est dite dans un récipient ouvert, il peut être nécessaire de déposer un verre de montre sur le montage afin d’éviter la contamination par des poussières ou autres composées volatiles ou en suspension dans l’air. Ensuite, le contenant est déposé sur une plaque chauffante où celle-ci chauffera la solution lentement jusqu’à attendre l’ébullition de la solution[11]. La digestion se réalise alors et la matrice organique est décomposée alors que les métaux sont dissous dans la solution et celle-ci devient alors claire[7]. La digestion se poursuit jusqu’à la quasi complète évaporation de la solution. Lors de la digestion, il peut être important de porter une attention particulière à la possible déposition de l’échantillon sur la paroi du contenant. Il faut alors rincer la paroi avec de l’acide ou de l’eau distillée afin d’éviter toute perte[7]. Le récipient contenant les analytes digérés est refroidi puis ces derniers sont dissous dans une solution diluée de l’acide afin de passer à l’analyse et l’entreposage[7],[8],[9]. Il filtration peut être nécessaire si la matrice a laissé des dépôts insolubles après la digestion.
L’avantage d’utiliser la méthode de digestion avec récipient ouvert c’est qu’elle requiert du matériel de faible coût et les échantillons ont moins besoin d’être prétraités en comparaison avec les autres méthodes[7]. Un inconvénient qui est à noter pour la digestion avec contenant ouvert est le haut risque de contamination provenant de l’environnement. De plus, la méthode du contenant ouvert limite la température maximale de la digestion à la température d’ébullition de l’acide utilisé[7]. La digestion à contenant ouvert consomme plusieurs acides qui sont combinés et ces acides peuvent potentiellement introduire des interférences lors de la prise de mesures[9].
Digestion acide assistée par micro-onde

La méthode conventionnelle utilise des acides forts afin de digérer les matrices organiques et dissoudre les métaux. Toutefois, ces acides sont plus efficaces lors que l’on augmente la température et la pression[12]. Une méthode qui se base sur ce principe et qui permet d’améliorer de beaucoup la digestion est de l’assister par micro-onde. La particularité de cette digestion est qu’elle utilise une source de micro-onde afin de chauffer l’échantillon et que celui-ci est placé dans un contenant qui est fermé[6]. Ceci permet d’avoir un contrôle sur la température et la pression facilement[6]. Cette condition est essentielle afin d’assurer l’efficacité, la reproductibilité et la sécurité qu’implique cette méthode[13].
L’utilisation du four à micro-ondes pour effectuer une digestion acide permet de réduire le temps requis pour effectuer la digestion des métaux et permet aussi de réduire la perte par volatilisation, puisque le contenant utilisé est fermé. De ce fait, les risques de contamination provenant de l’extérieur sont réduits. La digestion par four à micro-ondes nécessite de plus petits volumes d’acides que les autres méthodes[6]. Les micro-ondes à digestion acide sont équipés d’une sonde qui permet de suivre en temps réel les variations de température à l’intérieur des vases à digestion. Cette méthode de digestion permet aussi d’atteindre des températures et des pressions plus élevées qu’à contenant ouvert[6].
Pour l’ensemble des digestions par voie humide, l’utilisation de combinaisons d’acides et d’oxydants, souvent de l’acide nitrique, sulfurique, perchlorique et du peroxyde d’hydrogène, sont potentiellement dangereux durant la digestion de matière biologique, par exemple des matières compostables, et peut engendrer des pertes de potassium et de bore[7].
Applications
L’utilisation de la digestion acide a des applications très variées et dans plusieurs domaines. Dans certaines publications, la digestion acide avec contenant ouvert ou fermé est utilisée dans la dissolution d’os, de tissus biologiques et des matrices végétales[6]. Dans une publication parue en 2004, quatre différentes techniques de digestion acide ont été utilisées afin d’analyser les métaux lourds qui se trouvent dans des échantillons de compost[7]. Une autre publication propose l’utilisation de la digestion acide pour effectuer l’analyse des métaux lourds dans des échantillons de sols et de sédiments[14].
Notes et références
- Williams-Jones A. E., Bowell R. J., Migdisov A. A., (2009) Gold in Solution. Elements 5(5): 281-287.
- Russell R. (1686) The works of Geber, The Most Famous Arabian Prince And Philosopher, Of The Investigation and Perfection of The Philosophers-Stone. Londres, Angleterre: William Cooper. 302 p.
- Brown J. C., Brown H. H. (1920) A History of Chemistry From the Earlies Times. Londres, Angleterre : J. & A. Churchill. 592p.
- Greenberg A. (2006) From Alchemy to Chemistry in Picture and Story. Wiley, 688 p.
- Cohen J. B. (1908) Practical Organic Chemistry for Advanced Students. Londres, Angleterre : Macmillan. 284 p.
- L. B. Jassie, H. M. Kingston (1988) Introduction to microwave sample preparation : theory and practice. Washington D.C., États-Unis d’Amérique : American Chemical Society Reference Book, 263 p.
- Hseu,Z.-Y. (2004) Evaluating heavy metal contents in nine composts using four digestion methods, Elseliver, Bioresources technology 95: 53-59
- M. Bettinelli , G.M. Beone, S. Spezia , C. Baffi (2000) Determination of heavy metals in soils and sediments by microwave-assisted digestion and inductively coupled plasma optical emission spectrometry analysis, Elseliver, Analitical Chimica Acta 424: 289-293
- Yang, L. et al., (2013) Comparison of dry ashing, wet ashing and microwave digestion for determination of trace element in peristracum serpentis and periostracum cicadea by ICP-AES, Journal of the Chilean Chemical Socet 58 (3) : 1876-1879
- Smith, R. A. (2003) Fluorine Compounds, Inorganique, Hydrogen,Kirk-Othmer Encyclopedia of Chemical Technology. Consulté le 16/03/2017.
- Skoog D. A., West D. M., Hollar J. F., Crouch S. R., (2015) Chimie analytique, Belgique, 3e édition, français, Groupe De Boeck, 1116 p.
- Jackwerth, E., Gomiscker, S. (1984) Pure Appl. Chem. 56(4), 480-489
- Kingston, H. M., Jassie, L. B. (1986) Anal. Chem. 58 : 2534-2541
- Matsumura, S., Karai, I., Takise, S., Kiyota, I., Shinagawa, K., Horiguchi, S. (1982) Osaka City Med. J. 28 : 145-148
- Portail de l'assainissement
- Portail de la chimie