Felidae
Les Félidés (Felidae) ou Félins sont une famille de mammifères placentaires de l'ordre des carnivores et du sous-ordre des féliformes. Si on exclut le taxon fossile des Proailurinae, qui ne possède qu'un seul et unique genre connu, on y distingue trois sous-familles : les « petits félins » (Felinae), les « grands félins » (Pantherinae) et les félins dit « à dents de sabre » (Machairodontinae), aujourd'hui éteints. Parmi leurs traits caractéristiques figurent leur tête ronde au crâne raccourci, leur mâchoire dotée d’environ trente dents, et leurs griffes rétractiles, exception faite du chat viverrin et du chat à tête plate (semi-rétractiles) et du guépard (non rétractiles). Les félins sont digitigrades, c’est-à-dire qu’ils marchent en appuyant sur leurs doigts (la plante du pied ne se pose pas sur le sol).
Proailurus, qui vivait en Eurasie il y a environ 25 millions d’années dans la période de l’Oligocène, est à l'heure actuelle considéré comme le plus vieux fossile de félidé. On considère Pseudaelurus comme le dernier ancêtre commun des félins modernes.
Félidés • Félins
« Félin » redirige ici. Pour les autres significations, voir Félin (homonymie).
Pour l’article homonyme, voir Felidae (film).

Sous-familles de rang inférieur
- Felinae (« petits félins » )
- Pantherinae (« grands félins »)
- †Machairodontinae (« félins à dents de sabre »)
- †Proailurinae[1]
Origine et évolution des Félidés
Premiers félins
Les carnivores actuels partagent un ancêtre commun dont ils ont tous hérité et qui serait probablement rattaché aux miacidés. Ces petits carnivores forestiers seraient apparus il y a environ 60 millions d'années (Ma) et avaient l'allure et la taille des genettes actuelles, avec un corps allongé et une longue queue. Il n'en reste que de rares fossiles dans l'hémisphère nord.
L'origine des félins est mal documentée dans le registre des fossiles car les ancêtres des félidés vivaient en général dans les milieux tropicaux, qui n'offrent pas de bonnes conditions de fossilisation. Les espèces disparues considérées comme les plus proches de l'ancêtre des félins seraient Proailurus (un petit carnassier européen et arboricole apparu il y a 40 Ma) puis Pseudaelurus qui vivait il y a 9 à 20 Ma en Europe et en Asie et dont les félins actuels ont divergé il y a 14,5 Ma[2],[3],[alpha 1].
Dispersion des félins dans le monde
Selon étude de l'ADN mitochondrial des espèces actuelles, publiée en 2006 dans Science[5], les félins auraient effectué deux vagues de migrations : il y a neuf millions d’années, les félins d’Asie se répandirent en Afrique et en Amérique à la faveur d’une baisse du niveau des océans ; puis, il y a un à quatre millions d’années les félins d’Amérique revinrent sur le vieux continent, notamment les lynx et les guépards[4].
Félins à dents de sabre
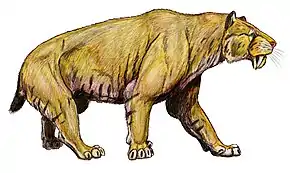
Les félins dits « à dents de sabre » (Machairodontinae) forment l'une des plus anciennes sous-familles de félidés, les plus vieux fossiles datent d'il y a plus de 16 millions d'années[6]. Ce groupe, partageant un ancêtre commun avec les ancêtres des félinés et des panthérinés, se caractérise par une élongation plus ou moins grande des canines et se répartit en quatre tribus de rang inférieur : Metailurini, Smilodontini, Machairodontini et Homotherini. À noter que des caractéristiques similaires chez d'autres familles éteintes de mammifères carnivores féliformes sont visibles : les Nimravidae et les Barbourofelidae (ce groupe partage un ancêtre commun avec les félins). Il s’agit d’un phénomène de convergence évolutive qui apparaît aussi chez les animaux de toute période comme les sparassodontes (des proches parents éteints des marsupiaux), tels les Thylacosmilus, ou encore les gorgonopsiens (des thérapsides prédateurs appartenant à un groupe comprenant des ancêtres de mammifères), tel Inostrancevia.
Les Machairodontinae, comme les genres Smilodon ou Homotherium dont les derniers représentants se sont éteints il y a environ 10 000 ans, probablement en raison de leur hyper-spécialisation[7] : l’étude de leur squelette révèle des lésions dues à l’extension ou à la flexion des attaches des muscles et des ligaments[8],[9].
Anatomie et caractéristiques physiques
Les différentes espèces de félins ont des poids et tailles variés qui vont de 1,5 kg pour le chat à pattes noires à plus de 300 kg pour le tigre. Pourtant, malgré leurs différences, les félins partagent de nombreux points communs.
Squelette et musculature en général
Qu’ils soient grands ou petits, l’une des principales caractéristiques communes aux félins est leur squelette flexible, plus particulièrement au niveau de la colonne vertébrale, offrant une grande souplesse, aidée aussi par des muscles du dos eux aussi très souples. Les omoplates et les clavicules sont assez libres de mouvement, retenues par très peu de ligaments, et permettent une grande diversité de mouvements. Les muscles les plus développés sont ceux des pattes arrière, pour que les félins puissent faire de grands sauts et courir vite (jusqu’à 120 km/h pour le guépard).
La morphologie des félins est donc parfaitement adaptée à la chasse, ce qui est inévitable pour leur survie. Mais chaque félin est différent, et, selon le type de proie qu’ils convoitent, ils s’adaptent physiologiquement.
Crâne
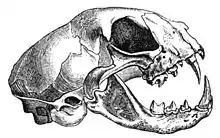



La mâchoire raccourcie constitue une innovation de la famille des Felidae. Le crâne est donc plus court que celui des autres carnivores, et possède en général moins de dents, mais cette forme augmente considérablement la force des morsures car permettant un puissant mouvement vertical de la mâchoire. L’articulation de la mâchoire ne permet pas les mastications horizontales, comme chez les ruminants par exemple.
L’élasticité de la chaîne hyoïde, au-dessus du larynx, permet traditionnellement de séparer les grands félins (Pantherinae) des petits (Felinae)[10].
Les vibrisses (plus communément appelées moustaches) sont un élément important pour le sens du toucher. Autour du museau, sur le menton, les joues et les sourcils, elles sont implantées à des endroits stratégiques pour une plus grande sensibilité. Comme les poils, elles tombent et repoussent au fur et à mesure de la vie du félin. L’orientation de certaines d’entre elles peut être modifiée sous l’action de muscles faciaux.
Yeux
Les yeux sont positionnés vers l’avant, ce qui permet la vision binoculaire, très importante chez les prédateurs. L’angle de vision binoculaire est de 130°, pour un champ de vision total de 287°, contre seulement 180° chez l’homme[11]. Leur pupille peut se contracter, devenant selon les espèces, petite et ronde ou en forme de fine fente verticale en pleine lumière, et grosse et ronde en l’absence de luminosité. Le tapetum lucidum, qui tapisse le fond de la rétine, permet la réflexion de la lumière et favorise la vision dans la pénombre : l’œil du félin est six fois plus sensible dans l’obscurité que l’œil humain.
Les félins possèdent un grand nombre de bâtonnets mais très peu de cônes, comparativement à l’œil humain qui en possède six fois plus. De plus, ces cônes absorbent principalement la lumière verte et très peu le bleu et le rouge : les félins voient principalement leur environnement en nuance de gris[12][source insuffisante]. Mais, pour les prédateurs, percevoir les couleurs est moins important que de percevoir les mouvements, et cela ne handicape pas leur vision.
Du fait de l’emplacement de leur fovéa, où se concentre la majorité de leurs cellules photosensibles, un félin tourne la tête plusieurs fois avant de sauter sur une proie, afin de gagner en précision.
Oreilles
Les oreilles des félins sont très sensibles et nombre d’entre eux repèrent leur proie à l’ouïe, tel le serval. D’une grande mobilité, elles sont en outre un organe de communication corporelle important. Les facultés de l’oreille féline étant bien supérieures à celle de l’humain.
Les oreilles sont sensibles à la température et sont un lieu de déperdition de chaleur. C’est pourquoi les félins qui vivent dans des milieux froids ont de petites oreilles, comme l’once, au contraire du chat des sables qui a de larges pavillons pour évacuer la chaleur. Elles peuvent aussi dépendre des proies convoitées, plus grandes pour un animal qui fera peu de bruit et vice versa, car un large pavillon d’oreille répercute les sons et vibrations les plus ténus, permettant une grande précision pour la localisation des proies, par exemple si elles se cachent sous le sable.
Certains félins comme le lynx et le caracal voient leurs oreilles surmontées de « plumets », touffes de poils fins d’environ 5 cm.
Organe de Jacobson
L’organe voméronasal ou organe de Jacobson, situé près du palais, permet de « goûter » certaines odeurs bien spécifiques, comme les marques olfactives des autres félins. L’utilisation de cet organe se caractérise par le flehmen, une grimace qui consiste chez les félins à ouvrir la gueule et découvrir les gencives. Il complète efficacement l’odorat, sens des félins le plus complexe à étudier.
Langue

La langue des félins est tapissée de papilles cornées orientées vers l’arrière qui lui permettent de faire la toilette, d’enlever en partie les poils de ses proies et de mieux racler leur chair.
Les félidés, à l’instar du lapement du chat, ont pour s'abreuver une technique différente du reste des mammifères. On a longtemps pensé que leurs papilles cornées servaient à retenir l’eau, mais il en va tout autrement. Alors que l’homme boit par la technique de succion et que le chien, comme beaucoup d’autres vertébrés, plonge le museau et plie sa langue comme une cuillère, ce qui amène le liquide vers sa gueule, les félidés plient la pointe de la langue vers le bas et vers sa face dorsale pour effleurer le liquide, puis la retirent aussitôt, ce qui crée une colonne de liquide. Au moment où la gravité reprend le pas sur la force d’inertie et va faire retomber la colonne, ils referment leur mâchoire et aspirent alors une partie de cette colonne[13]. Cette technique de lapement (en moyenne 4 lapées par seconde pour le chat, moins pour les félidés plus gros[14]) a été modélisée mathématiquement et reproduite par un robot (disque de verre rond remontant par un piston à la même vitesse que la langue féline, soit 1 m/s[15]). Une hypothèse expliquant cette technique sophistiquée met en cause la région extrêmement sensible du nez et des moustaches des félidés, ces derniers lapant en cherchant à maintenir cette région la plus sèche possible[16].
Denture
| Formule dentaire | |||||||
|---|---|---|---|---|---|---|---|
| mâchoire supérieure | |||||||
| 1 | 3 | 1 | 3 | 3 | 1 | 3 | 1 |
| 1 | 2 | 1 | 3 | 3 | 1 | 2 | 1 |
| mâchoire inférieure | |||||||
| Total : 30 | |||||||
| Denture commune aux Felidae | |||||||
Les félins possèdent 28 à 30 dents. Leurs quatre canines sont plus longues que celles des loups et sont utilisées pour la mise à mort. Leur taille a même atteint 18 cm au temps des tigres à dents de sabre. Les 12 petites dents de devant, ou incisives, servent à arracher les poils ou les plumes et la viande des os.
Sur les côtés des mâchoires se trouvent les prémolaires et les molaires, également appelées dents jugales ; elles sont moins utiles pour les félins mâchant peu leur nourriture. Les dernières prémolaires supérieures et les premières molaires inférieures des félins sont aiguës et tranchantes et faites pour déchiqueter la viande. Ces dents particulières sont appelées les carnassières.
Membres

Le squelette des félins est caractérisé par une clavicule « flottante », reliée au sternum par un unique ligament, ce qui confère aux félidés une grande souplesse des pattes antérieures : les félins peuvent par exemple déplacer leurs épaules en alternance, ce qui n’est pas le cas pour tous les carnivores. Les membres antérieurs sont par ailleurs très souples (sauf pour le guépard qui a toutefois une plus grande souplesse de l’échine), ce qui permet d’avoir une grande précision. On peut aussi noter que les félins peuvent écarter latéralement les pattes avant ce qui permet d’attraper les proies ou de monter aux arbres. Les membres postérieurs sont, eux plus longs que les membres antérieurs, permettant aux félins de capturer des proies plus grandes qu’eux et augmentent leurs capacités d’accélération.
Pattes
Les félins sont digitigrades, ils marchent sur leurs doigts. Ils en ont cinq aux pattes antérieures et quatre aux pattes postérieures, le cinquième doigt des pattes antérieures ne touchant pas le sol et celui des pattes postérieures ayant disparu au cours de l’évolution. La plante de leurs pieds est recouverte d’une sorte de semelle (coussinets pour les chats) permettant d’accroître leur souplesse et d’être silencieux en marchant. Les coussinets de ceux qui vivent et se déplacent sur le sol brûlant des déserts est recouvert de poils. La petitesse des pattes et leur résistance améliorent elles aussi leur course.
Griffes
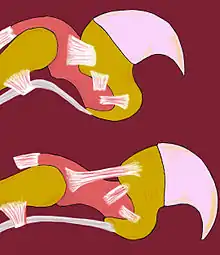
En blanc : les tendons et les ligaments.
En rose et en jaune orangé : les os.
Les félins, en dehors du guépard, du chat viverrin et du chat à tête plate, ont les griffes rétractiles. Ce dernier point n’est pas caractéristique des félins, puisque d’autres animaux en possèdent, comme les geckos. Les griffes sont un élément important du sens du toucher.
La sortie des griffes dépend de la contraction volontaire des muscles fléchisseurs des doigts. Au repos, de nombreux tendons gardent les griffes à l’intérieur de la gaine protectrice et permettent aux félins de faire « patte de velours ».
Comportement et vie sociale
Bien que presque tous soient des solitaires, la vie sociale des félins dépend de leur comportement, ainsi que de leur habitat (il arrivera plus facilement que des félins s’associent pour chasser si la proie est grosse ou si on est en période de disette par exemple).
Communication
Il existe différents modes de communication chez les félins. En tant que mammifères, ils sont peu bavards, mais peuvent communiquer par des vocalises. Tout comme les humains, ils émettent des sons avec leurs cordes vocales pendant l’expiration. La fréquence de ces cris va de 50 à 10 000 hertz, et leur répertoire est très varié, allant du chuintement au rugissement, et certains cris sont propres à une espèce.
Pour les félins solitaires, les vocalises servent surtout en période de reproduction, pour appeler les femelles ou pour avertir les autres félins que le territoire est occupé. Ces vocalises peuvent être complétées par des marquages olfactifs, au moyen de diverses substances (phéromones, urine, etc.), et visuels (griffures sur les arbres, etc.).
Mais chez les félins sociables, la communication est primordiale pour une bonne entente. Chez eux, les vocalises sont plus nombreuses et plus complexes. Le miaulement d’appel est l’un des plus communs, et peut être utilisé dans beaucoup de situations par exemple quand les mères communiquent avec leurs petits. Quand ils veulent se faire agressifs, les félins crachent et grondent, tandis que lors d’approches amicales, ils émettent des gargouillements et s’ébrouent, signe d’apaisement. Très connu grâce à nos chats domestiques, le ronronnement est aussi employé par les autres félins pour exprimer le contentement. Les félins utilisent aussi entre eux des postures significatives, par exemple pour signaler à leurs congénères un danger, pour inviter un partenaire à l’accouplement, pour menacer un adversaire ou, à l’inverse, pour montrer sa soumission. Ces attitudes accompagnent et complètent les vocalises.
Vie en solitaire
Les félins solitaires sont généralement nocturnes, ils vivent la nuit et voient assez bien dans l’obscurité. Ils vivent sur des territoires de forme et de taille variées, divisés en zones d’activités stratégiquement placées (zone d’alimentation, de repos, point d’eau, etc.). Pour se nourrir, ils doivent chasser des proies, différentes selon leur espèce et l’endroit où ils vivent. Mais malgré leurs aptitudes, le succès d’une chasse n’est pas toujours garanti, et les félins ne mangent que tous les 3 à 4 jours en moyenne (cela diffère selon la saison, l’habitat et le régime alimentaire). Chez le guépard par exemple, on estime que la chasse est fructueuse seulement une fois sur trois. Et même si la proie est attrapée, il suffit que le félin ait mal assuré sa prise pour qu’elle s’échappe.
En dehors de la chasse, les félins passent le plus clair de leur temps à dormir (jusqu’à 18 heures par jour) ou juste à se prélasser dans leur abri. Le régime carnivore des félins explique ce comportement : la viande se digère rapidement, ce qui leur permet de se nourrir moins souvent, et la chasse les épuise fortement (chez le guépard, l’énergie dépensée dans la course est telle qu’il ne peut généralement pas rattraper sa proie si elle s’enfuit par la suite, et ne peut pas non plus la récupérer si d’autres prédateurs la lui volent).
Exceptions
Durant la période des chaleurs, quand un mâle trouve une femelle prête à s’accoupler, il la suit durant plusieurs jours, jusqu’à l’accouplement. Il arrive parfois qu’il reste plus longtemps en compagnie de la femelle, s’occupant même de ses petits. En dehors de cette période, rares sont les rencontres, les femelles s’évitant entre elles, et les autres mâles préférant rester à distance grâce aux odeurs qui marquent les limites des territoires. Il arrive pourtant des exceptions, par exemple quand un mâle abat une grande proie, il accepte parfois de la partager avec les femelles cohabitant avec lui. Tous ces cas prouvent que les solitaires peuvent être sociables, mais l’exemple le plus flagrant est celui des jeunes mâles, venant de quitter leur mère, qui s’associent pour un temps avant de trouver leur propre territoire. C’est très souvent le cas chez les guépards, dont l’organisation sociale reste néanmoins assez méconnue, car ils ne sont ni des félins sociaux, ni de véritables félins solitaires. En s’associant ainsi, ils bénéficient de l’avantage du nombre, très utile pour la chasse. Cependant, même s’il arrive à des guépards mâles adultes d’avoir des territoires se chevauchant, et en dépit de ces associations spontanées, on ne peut parler de véritable organisation sociale. Il arrive aussi à de jeunes lions ou de jeunes tigres de suivre ce genre de comportement.
Cas particulier : le lion
Les lions sont, à la différence des autres félins, des animaux très sociables, vivant dans une troupe d’une vingtaine d’individus, composée d’une famille très soudée avec des mâles (un à sept), des femelles (une dizaine généralement) et leurs petits. Le nombre d’individus est cependant limité par le nombre de proies disponibles dans le territoire, qui peut atteindre 500 km2, c’est pourquoi les jeunes mâles quittent le groupe pour former leur propre famille quand ils atteignent leur maturité sexuelle.
Ce sont les lionnes qui sont chargées de la chasse, les mâles s’occupant plutôt de tenir à distance les intrus, maintenant ainsi la sécurité des jeunes. Mais un mâle reste rarement plus de 4 ans à la tête d’un groupe, remplacé par de plus jeunes lions qui auraient gagné un combat contre l’autre. Ces changements de dominants sont bénéfiques aux clans, leur apportant un sang neuf.
Répartition et habitat
Les habitats sont variés, bien que près des trois-quarts des espèces vivent dans les forêts. Les félins ont colonisé tous les continents, sauf l’Australie et l’Antarctique (exception faite du chat domestique).
Classifications
Classification classique
Depuis l’avènement des études moléculaires de l’ADN des espèces, la classification des félins subit de nombreux changements. De nombreuses espèces « apparaissent » tandis que d’autres se fondent. On classe traditionnellement les félins actuels en deux ou trois sous-familles :
- sous-famille des félinés (Felinae) ;
- sous-famille des pantherinés (Pantherinae) ;
- sous-famille des acinonychinés (Acinonychinae) ; cette sous-famille n’est plus reconnue et ses membres sont inclus dans celle des Felinae en tant que genre.
À celles-ci, on peut rajouter deux sous-familles éteintes :
- Machairodontinae, dont les félins à dents de sabre ;
- Proailurinae.
Espèces actuelles
Liste des espèces actuelles selon ITIS[17]:
- Sous-famille Felinae Fischer de Waldheim, 1817:
- Genre Acinonyx Brookes, 1828:
- Acinonyx jubatus (Schreber, 1775) - le Guépard
- Genre Caracal Schreber, 1776:
- Caracal aurata (Temminck, 1827) - le Chat doré africain
- Caracal caracal (Schreber, 1776) - le Caracal
- Genre Catopuma Severtzov, 1858:
- Catopuma badia (Gray, 1874) - le Chat bai
- Catopuma temminckii (Vigors and Horsfield, 1827) - le Chat de Temminck
- Genre Felis Linnaeus, 1758:
- Felis chaus (Schreber, 1777) - le Chaus
- Felis margarita (Loche, 1858) - le Chat des sables
- Felis nigripes (Burchell, 1824) - le Chat à pieds noirs
- Felis silvestris (Schreber, 1777) - le Chat sauvage
- Felis silvestris bieti (Milne-Edwards, 1892) - le Chat de Biet
- Felis silvestris cafra (Desmarest, 1822) - le Chat sauvage d'Afrique subsaharienne
- Felis silvestris catus (Linnaeus, 1758) - le Chat domestique
- Felis silvestris lybica (Forster, 1780) - le Chat ganté
- Felis silvestris ornata (Gray, 1830) - le Chat orné
- Felis silvestris silvestris (Schreber, 1775) - le Chat forestier
- Genre Leopardus Gray, 1842 (incluant l'ancien genre Oncifelis):
- Leopardus colocolo (Molina, 1782) - le Colocolo
- Leopardus pajeros (Desmarest, 1816) - le Chat des pampas
- Leopardus geoffroyi (d'Orbigny and Gervais, 1844) - le Chat de Geoffroy
- Leopardus guigna (Molina, 1782) - le Kodkod
- Leopardus guttulus (Hensel, 1872) - l'Oncille du Sud
- Leopardus jacobitus (Cornalia, 1865) - le Chat des Andes
- Leopardus pardalis (Linnaeus, 1758) - l'Ocelot
- Leopardus tigrinus (Schreber, 1775) - l'Oncille
- Leopardus wiedii (Schinz, 1821) - le Margay
- Leopardus colocolo (Molina, 1782) - le Colocolo
- Genre Leptailurus Severtzov, 1858:
- Leptailurus serval (Schreber, 1776) - le Serval
- Genre Lynx Kerr, 1792:
- Lynx canadensis Kerr, 1792 - le Lynx du Canada
- Lynx lynx (Linnaeus, 1758) - le Lynx boréal
- Lynx pardinus (Temminck, 1827) - le Lynx pardelle
- Lynx rufus (Schreber, 1777) - le Lynx roux
- Genre Otocolobus Brandt, 1842:
- Otocolobus manul (Pallas, 1776) - le Manul
- Genre Pardofelis Severtzov, 1858:
- Pardofelis marmorata (Martin, 1837) - le Chat marbré
- Genre Prionailurus Severtzov, 1858:
- Prionailurus bengalensis (Kerr, 1792) - le Chat-léopard
- Prionailurus iriomotensis (Imaizumi, 1967) - le Chat d'Iriomote
- Prionailurus planiceps (Vigors and Horsfield, 1827) - le Chat à tête plate
- Prionailurus rubiginosus (I. Geoffroy Saint-Hilaire, 1831) - le Chat rubigineux
- Prionailurus viverrinus (I. Geoffroy Saint-Hilaire, 1831) - le Chat viverrin
- Prionailurus bengalensis (Kerr, 1792) - le Chat-léopard
- Genre Puma Jardine, 1834:
- Puma concolor (Linnaeus, 1771) - le Puma
- Puma yagouaroundi (É. Geoffroy Saint-Hilaire, 1803) - le Jaguarondi
- Genre Acinonyx Brookes, 1828:
- Sous-famille Pantherinae Pocock, 1917:
- Genre Neofelis Gray, 1867:
- Neofelis diardi (G. Cuvier, 1823) - la Panthère nébuleuse de Bornéo
- Neofelis nebulosa (Griffith, 1821) - la Panthère nébuleuse
- Genre Panthera Oken, 1816:
- Panthera leo (Linnaeus, 1758) - le Lion
- Panthera onca (Linnaeus, 1758) - le Jaguar
- Panthera pardus (Linnaeus, 1758) - le Léopard
- Panthera tigris (Linnaeus, 1758) - le Tigre
- Panthera uncia (Schreber, 1775) - la Panthère des neiges
- Genre Neofelis Gray, 1867:
La classification des félins est en perpétuelle évolution, notamment grâce aux récentes analyses génétiques. Les différents changement de classification ont récemment été résumés dans le rapport final de la "Cat Classification Task Force" en 2017[18] :
- le Chat d'Iriomote (Prionailurus bengalensis iriomotensis (Imaizumi, 1967)) est considéré depuis les années 1990 comme une sous-espèce du chat-léopard.
- le Chat doré africain (Caracal aurata (Temminck, 1827)) est placé dans le genre Caracal.
- le Chat De Pallas (Otocolobus manul (Pallas, 1776)) est placé à part dans le genre Otocolobus Brandt, 1842.
- le Chat des pampas (Leopardus colocola pajeros (Desmarest, 1816)) est classé comme une sous-espèce du Colocolo (Leopardus colocola (Molina, 1782)). Le débat a cependant toujours lieu, y compris avec le Chat du Pantanal.
- la Panthère des neiges (Panthera uncia (Schreber, 1775)) est intégrée au genre Panthera.
- l'Oncille du Sud est considéré depuis 2013 comme une espèce différente de l'Oncille (Leopardus tigrinus).
Une partie des félins actuels, y compris de genres distincts, sont capables d'hybridations naturelles ou forcées.
 Guépard (Acinonyx jubatus).
Guépard (Acinonyx jubatus).%252C_Paris%252C_d%C3%A9cembre_2013.jpg.webp) Caracal (Caracal caracal).
Caracal (Caracal caracal). Serval (Leptailurus serval).
Serval (Leptailurus serval). Panthère nébuleuse (Neofelis nebulosa).
Panthère nébuleuse (Neofelis nebulosa).
Taxons éteints
- Proailurinae
- Proailurus (Filhol, 1879)[19]
- Pseudailurus grade
- Pseudaelurus (Gervais, 1850)[21],[22]
- P. quadridentatus (Blainville, 1882)
- P. guangheesis (Cao et al, 1990)
- P. cuspidatus (Wang et al, 1998)
- Sivaelurus (Pilgrim, 1910)
- S. chinjiensis (Pilgrim, 1910)
- Hyperailurictis (Kretzoi, 1929)
- H. intrepidus (Leidy, 1858)
- H. marshi (Thorpe, 1922)
- H. stouti (Schultz & Martin, 1972)
- H. validus (Rothwell, 2001)
- H. skinneri (Rothwell, 2003)
- Styriofelis (Kretzoi, 1929)
- S. turnauensis (Deperet, 1892)
- S. romieviensis (Roman & Viret, 1934)
- Miopanthera (Kretzoi, 1938)
- M. lorteti (Gaillard, 1899)
- M. pamiri (Ozansoy, 1965)
- Pseudaelurus (Gervais, 1850)[21],[22]
- Pantherinae
- Panthera
- P. spelaea (Goldfuss, 1810)[23]
- P. atrox (Leidy, 1853)[24]
- P. fossilis (Reichenau, 1906)
- P. palaeosinensis (Zdansky, 1924)
- P. youngi (Pei, 1934)
- P. gombaszoegensis (Kretzoi, 1938)[25]
- P. shawi (Broom, 1948)
- P. zdanskyi (Mazák, Christiansen & Kitchener, 2011)[26]
- P. blytheae (Tseng et al., 2013)[27]
- P. balamoides (Stinnesbeck et al., 2019)
- P. leo
- P. onca
- P. onca augusta (Leidy, 1872)
- P. onca mesembrina (Cabrera 1934)
- P. pardus
- P. pardus spelaea (Bächler, 1936)
- P. pardus
- P. tigris trinilensis (Dubois, 1908)
- P. tigris soloensis (Koenigswald, 1933)
- Panthera
- Felinae
- Felis
- F. lunensis (Martelli, 1906)
- Lynx
- L. issiodorensis (Croizet & Jobert, 1828)
- L. rexroadensis (Stephens, 1959)[28],[29]
- L. thomasi
- Puma
- P. pardoides (Owen, 1846)
- P. pumoides (Castellanos, 1956)
- Acinonyx
- A. pardinensis (Croizet & Jobert, 1828)
- A. intermedius (Thenius, 1954)[22]
- A. aicha (Geraads, 1997)
- Sivapanthera (Kretzoi, 1929)
- S. arvernensis (Croizet & Jobert, 1828)
- S. brachygnathus (Lydekker, 1884)
- S. pleistocaenicus (Zdansky, 1925)
- S. potens (Pilgrim, 1932)
- S. linxiaensis (Qiu et al., 2004)
- S. padhriensis (Ghaffar & Akhtar, 2004)
- Pratifelis (Hibbard, 1934)
- P. martini (Hibbard, 1934)
- Miracinonyx (Adams, 1979)[30]
- M. inexpectatus (Cope, 1895)
- M. trumani (Orr, 1969)
- Diamantofelis (Morales, Pickford, Soria & Fraile, 1998)[31]
- D. ferox (Morales, Pickford, Soria & Fraile, 1998)
- Namafelis (Morales, Pickford, Fraile, Salesa & Soria, 2003)[32]
- N. minor (Morales, Pickford, Fraile, Salesa & Soria, 2003)
- Asilifelis (Werdelin, 2011)[33]
- A. coteae Werdelin, 2011
- Leptofelis (Salesa et al., 2012)
- L. vallesiensis (Salesa et al., 2012)
- Pristifelis (Salesa et al., 2012)
- P. attica (Wagner, 1857)
- Katifelis (Adrian, Werdelin & Grossman, 2018)[34]
- K. nightingalei (Adrian, Werdelin & Grossman, 2018)
- Felis
- Machairodontinae
- Tchadailurus (Salesa et al., 2012)
- T. adei (Bonis et al., 2018)
- Tribu Metailurini:
- Metailurus (Zdansky, 1924)[35]
- M. major (Zdansky, 1924)
- M. mongoliensis (Colbert, 1939)
- M. ultimus (Li, 2014)
- M. boodon
- Adelphailurus (Hibbard, 1934)
- A. kansensis (Hibbard, 1934)
- Stenailurus
- S. teilhardi
- Dinofelis (Zdansky, 1924)[36],[37]
- D. aronoki
- D. barlowi
- D. cristata
- D. darti
- D. diastemata
- D. paleoonca
- D. petteri
- D. piveteaui
- Yoshi (Spassov and Geraads, 2014)[38]
- Y. minor (Zdansky, 1924)
- Y. garevskii (Spassov and Geraads, 2014)
- Metailurus (Zdansky, 1924)[35]
- Tribu Smilodontini:
- Megantereon (Croizet & Jobert, 1828)
- M. cultridens (Cuvier, 1824)
- M. nihowanensis (Teilhard de Chardin & Piveteau, 1930)
- M. hesperus (Gazin, 1933)
- M. whitei (Broom, 1937)
- M. inexpectatus (Tielhard de Chardin, 1939)
- M. vakshensis (Sarapov, 1986)
- M. ekidoit (Werdelin & Lewis, 2000)
- M. microta (Zhu et al., 2015)
- Smilodon (Lund, 1842)
- S. populator (Lund, 1842)
- S. fatalis (Leidy, 1869)
- S. gracilis (Cope, 1880)
- Paramachairodus (Pilgrim, 1913)
- P. maximiliani
- P. orientalis
- P. transasiaticus
- Promegantereon (Kretzoi, 1938)[35]
- P. ogygia (Kretzoi, 1938)
- Rhizosmilodon (Wallace & Hulbert, 2013)
- R. fiteae (Wallace & Hulbert, 2013)
- Megantereon (Croizet & Jobert, 1828)
- Tribu Homotherini:
- Homotherium (Fabrini, 1890)
- H. latidens (Owen, 1846)
- H. serum (Cope, 1893)
- H. ischyrus (Merriam, 1905)
- H. venezuelensis (Rincón et al., 2011)
- Amphimachairodus (Kretzoi, 1929)[35]
- A. kabir (Peigné et al., 2005)
- A. giganteus (Kretzoi, 1929)
- A. kurteni (Sotnikova, 1992)
- A. coloradensis (Anton et al., 2013)
- A. alvarezi (Ruiz-Ramoni et al., 2019)
- Nimravides (Kitts, 1958)[35]
- N. catacopsis (Cope, 1887)
- N. pedionomus (MacDonald, 1948)
- N. thinobates (MacDonald, 1948)
- N. hibbardi (Dalquest, 1969)
- N. galiani (Baskin, 1981)
- Xenosmilus (Martin et al., 2000)
- X. hodsonae (Martin et al., 2000)
- Lokotunjailurus (Werdelin, 2003)
- L. emageritus (Werdelin, 2003)
- L. fanonei (Bonis, Peigné, Mackaye, Likius, Vignaud & Brunet, 2010)
- Homotherium (Fabrini, 1890)
- Tribu Machairodontini:
- Machairodus (Kaup, 1833)[35]
- M. aphanistus (Kaup, 18329
- M. horribilis (Schlosser, 1903)
- M. robinsoni (Kurtén, 1975)
- M. pseudaeluroides (Schmidt-Kittler 1976)
- M. alberdiae (Ginsburg et al., 1981)
- M. laskerevi (Sotnikova, 1992)
- Hemimachairodus (Koenigswald, 1974)
- H. zwierzyckii (Koenigswald, 1974)
- Miomachairodus (Schmidt-Kittler 1976)
- M. pseudaeluroides (Schmidt-Kittler 1976)
- Machairodus (Kaup, 1833)[35]
- Tchadailurus (Salesa et al., 2012)
Phylogénie des genres actuels
La taxonomie des félins est difficile à étudier car peu de fossiles sont arrivés jusqu’à nous, et ceux-ci sont également difficilement différentiables : même de nos jours, reconnaître un squelette de tigre de celui d’un lion est complexe. Les travaux de phylogénie se tournent à présent vers la génétique, ce qui permet à la fois de différencier les diverses lignées de félins, mais également de dater leur divergence. Cependant, une difficulté vient s’ajouter à ces analyses : pour certaines espèces, les échantillons d’ADN sont difficilement ostensibles[4].
Les travaux menés en 2006 par Warren Johnson et Stephen O’Brien ont porté sur trente gènes différents situés sur les mitochondries et les chromosomes sexuels. En s’appuyant sur des fossiles et sur la séquence intégrale du chat abyssin « Cannelle » (Cinnamon), il a été possible de dater les embranchements de l’arbre phylogénétique. Ces recherches génétiques donnent une classification différentes des espèces vivantes de félidés[4],[5],[39].
Voici par ordre chronologique les dates de divergences des différentes lignées estimées par cette étude[40],[41]:
- 10,8 Ma : séparation des sous-familles des panthérinés et des félinés ;
- 9,4 Ma : séparation de la lignée comprenant le genre Pardofelis ;
- 8,5 Ma : séparation de la lignée comprenant les genres Caracal et Leptailurus ;
- 8 Ma : séparation de la lignée comprenant le genre Leopardus ;
- 7,2 Ma : séparation de la lignée comprenant le genre Lynx ;
- 6,7 Ma : séparation de la lignée comprenant les genres Acinonyx et Puma ;
- 6,2 Ma : séparation de la lignée comprenant le genre Felis et celle comprenant les genres Otocolobus et Prionailurus.
Phylogénie des genres actuels de félins d'après Johnson et al. (2006)[5] :
| Felidae |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
La phylogénie des espèces actuelles est paradoxale car on n'obtient pas le même cladogramme avec différentes parties du génome (ADN mitochondrial, chromosomes sexuels, autres chromosomes), comme l'indique l'étude de Johnson et al. (2006)[5], et même avec différentes zones d'un même ADN, comme l'indique l'étude de Li et al. (2019)[3]. On retrouve généralement les mêmes huit clades, mais pas dans le même ordre chronologique des séparations. L'originalité de l'étude de 2019 est de séparer les séquences de gènes selon leur taux de recombinaison ; les régions du génome riches en recombinaisons donnent des arbres phylogénétiques différents et en désaccord avec les données paléontologiques (comme d'ailleurs aussi l'étude de 2006)[alpha 2] ; les régions pauvres permettent de reconstruire un arbre unique et cohérent avec la paléontologie (ci-dessous). L'abondance des recombinaisons et leur décryptage révèle une étonnante capacité des félins à s'interféconder tout au long de leur histoire[2],[3].
- Dernier ancêtre commun des félins
- Clade du Léopard (Panthera pardus)
- (Clades éteints)
- Clade du Caracal (Caracal caracal)
- (Clades éteints)
- Clade du Chat de Temminck (Catopuma temminckii)
- (Clades éteints)
- Clade de l'Ocelot (Leopardus pardalis)
- (Clades éteints)
- Clade du Lynx boréal (Lynx lynx)
- (Clades éteints)
- Clade du Puma (Puma concolor)
- (Clades éteints)
- Clade du Chat-léopard (Prionailurus bengalensis)
- (Clades éteints)
- Clade du Chat domestique (Felis silvestris catus)
Voir aussi
Articles connexes
Bibliographie
- Rémy Marion, Catherine Marion, Géraldine Véron, Julie Delfour, Cécile Callou et Andy Jennings, Larousse des Félins, LAROUSSE, , 224 p. (ISBN 2-03-560453-2)
- Peter Jackson et Adrienne Farrell Jackson, Les félins, toutes les espèces du monde, Paris, Delachaux et Niestlé, coll. « La bibliothèque du naturaliste », , 272 p. (ISBN 2-603-01019-0)
Liens externes
- (en) Référence Animal Diversity Web : Felidae
- (fr+en) Référence CITES : famille Felidae (sur le site de l’UNEP-WCMC)
- (en) Référence Paleobiology Database : Felidae Gray, 1821 (consulté le )
- (fr+en) Référence ITIS : Felidae
- (en) Référence Mammal Species of the World (3e éd., 2005) : Felidae Fischer de Waldheim, 1817
- (en) Référence NCBI : Felidae (taxons inclus)
- (en) Référence Tree of Life Web Project : Felidae
- Ressources relatives au vivant :
- Global Biodiversity Information Facility
- (en) Animal Diversity Web
- (en) Australian Faunal Directory
- (cs + en) BioLib
- (sv) Dyntaxa
- (en) EPPO Global Database
- (en) EU-nomen
- (en) Fauna Europaea
- (en) Paleobiology Database
- (mul + en) iNaturalist
- (en) Interim Register of Marine and Nonmarine Genera
- (en) Invasive Species Compendium
- (en) Mammal Species of the World
- (en) NBN Atlas
- (nl) Nederlands Soortenregister
- (en + en) New Zealand Organisms Register
- (en) Système d'information taxonomique intégré
- (en) World Register of Marine Species
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
Notes et références
Notes
Références
- M. C. McKenna et Bell, S. K., Classification of Mammals, Columbia University Press, , 631 p. (ISBN 978-0-231-11013-6, lire en ligne), « Family Felidae Fischer de Waldheim, 1817:372. Cats », p. 230
- Hervé le Guyader, « Les félins, rois de l'hybridation », Pour la science, no 510, , p. 84-86.
- (en) Gang Li, Henrique V Figueiró, Eduardo Eizirik et William J Murphy, « Recombination-Aware Phylogenomics Reveals the Structured Genomic Landscape of Hybridizing Cat Species », Molecular Biology and Evolution, vol. 36, no 10, , p. 2111-2126 (DOI 10.1093/molbev/msz139).
- Stephen O’Brien et Warren Johnson, « L’évolution des chats », Pour la science, no 366, (ISSN 0153-4092, résumé).
- (en) W. E. Johnson, E. Eizirik, J. Pecon-Slattery, W. J. Murphy, A. Antunes et al., « The late Miocene radiation of modern Felidae: a genetic assessment », Science, vol. 311, no 5757, , p. 73-77 (DOI 10.1126/science.1122277).
- Paleobiology Database: Machairodontinae basic info
- http://www.museum-bourges.net/museum-faune-préhistorique-83.html
- (en) A.D. Rincón, F.J. Prevosti et G.E. Parra, « New Saber-Toothed Cat Records (Felidae: Machairodontinae) for the Pleistocene of Venezuela, and the Great American Biotic Interchange », The Society of Vertebrate Paleontology, vol. 31, .
- (en) M.J. Salesa, M. Antón, G. Siliceo, M.D. Pesquero et L. Alcalá, « First Evidence of Pathology in the Forelimb of the Late Miocene Saber-Toothed Felid Promegantereon ogygia (Machairodontinae, Smilodontini) », The Anatomical Record, vol. 297, (résumé)
- (en) Gerald E. Weissengruber, Gerhard Forstenpointner, Sandra Petzhold, Claudia Zacha et Sibylle Kneissl, Anatomical Imaging, (ISBN 978-4-431-76932-3, lire en ligne), « Anatomical Peculiarities of the Vocal Tract in Felids », p. 15-21.
- Rémy Marion, Catherine Marion, Géraldine Véron, Julie Delfour, Cécile Callou et Andy Jennings, Larousse des Félins, LAROUSSE, , 224 p. (ISBN 2-03-560453-2).
- Peter Jackson et Adrienne Farrell Jackson, Les félins, toutes les espèces du monde, Paris, Delachaux et Niestlé, coll. « La bibliothèque du naturaliste », , 272 p. (ISBN 2-603-01019-0).
- Caméra à haute vitesse montrant le lapement du chat au ralenti.
- Les chercheurs en mécanique des fluides ont calculé que la fréquence de lapement augmente avec la masse élevée à la puissance −1⁄6.
- Robot mimant le lapement.
- (en) Pedro M. Reis et coll., « How Cats Lap: Water Uptake by Felis catus », Science, vol. 26, , p. 1231-1234 (DOI 10.1126/science.1195421).
- Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 4 mars 2019
- Kitchener, A. C., Breitenmoser-Würsten, C., Eizirik, E., Gentry, A., Werdelin, L., Wilting A., Yamaguchi, N., Abramov, A. V., Christiansen, P., Driscoll, C., Duckworth, J. W., Johnson, W., Luo, S.-J., Meijaard, E., O’Donoghue, P., Sanderson, J., Seymour, K., Bruford, M., Groves, C., Hoffmann, M., Nowell, K., Timmons, Z. & Tobe, S., « A revised taxonomy of the Felidae. The final report of the Cat Classification Task Force of the IUCN/SSC Cat Specialist Group », Cat News, vol. Special Issue 11, , p. 1−80 (lire en ligne)
- Filhol, H., « Étude sur les Mammifères fossiles de Saint-Gérand le Puy (Allier) », Annales des Sciences Géologiques, vol. 10, no 1, , p. 1–252 (lire en ligne)
- Peigné, S., « Proailurus, l'un des plus anciens Felidae (Carnivora) 'dEurasie : systematique et evolution », Bulletin de la Société d'Histoire Naturelle de Toulouse, no 135, , p. 125–134 (lire en ligne)
- Gervais, P., « Zoologie et paléontologie françaises. Nouvelles recherches sur les animaux vertébrés dont on trouve les ossements enfouis dans les sol de le France et sur leur comparaison avec les espèces propres aux autres regions du globe », Zoologie et Paléontologie Françaises, vol. 8, , p. 1–271
- (en) L. Werdelin, N. Yamaguchi, W. E. Johnson et S. J. O'Brien, « Phylogeny and evolution of cats (Felidae) », dans Biology and Conservation of Wild Felids, Oxford University Press, (ISBN 978-0-19-923445-5, lire en ligne), p. 59–82
- R. Barnett, M. L. Z. Mendoza, A. E. R. Soares, S. Y. W. Ho, G. Zazula, N. Yamaguchi, B. Shapiro, I. V. Kirillova, G. Larson et M. T. P. Gilbert, « Mitogenomics of the Extinct Cave Lion, Panthera spelaea (Goldfuss, 1810), Resolve its Position within the Panthera Cats », Open Quaternary, vol. 2, , p. 4 (DOI 10.5334/oq.24, lire en ligne)
- Leidy, J., « Description of an Extinct Species of American Lion: Felis atrox », Transactions of the American Philosophical Society, vol. 10, , p. 319–322 (DOI 10.2307/1005282, JSTOR 1005282)
- Kretzoi, M., « Die Raubtiere von Gombaszög nebst einer Übersicht der Gesamtfauna (Ein Beitrag zur Stratigraphie des Altquartärs) », Annales Musei Nationalis Hungarici, vol. 31, , p. 88–157
- (en) J. H. Mazák, P. Christiansen et A. C. Kitchener, « Oldest Known Pantherine Skull and Evolution of the Tiger », Plos One, vol. 6, no 10, , e25483 (PMID 22016768, PMCID 3189913, DOI 10.1371/journal.pone.0025483, Bibcode 2011PLoSO...625483M)
- Z. J. Tseng, X. Wang, G. J. Slater, G. T. Takeuchi, Q. Li, J. Liu et G. Xie, « Himalayan fossils of the oldest known pantherine establish ancient origin of big cats », Proceedings of the Royal Society B, vol. 281, no 1774, , p. 20132686 (PMID 24225466, PMCID 3843846, DOI 10.1098/rspb.2013.2686, lire en ligne)
- J. J. Stephens, « A new Pliocene cat from Kansas », Academy of Science, Arts and Letters, no 44, , p. 41–46
- L. Werdelin, « The evolution of lynxes », Annales Zoologici Fennici, no 18, , p. 37–71 (lire en ligne)
- Adams, D. B., « The Cheetah: Native American », Science, vol. 205, no 4411, , p. 1155–1158 (PMID 17735054, DOI 10.1126/science.205.4411.1155, Bibcode 1979Sci...205.1155A)
- Morales, J., Pickford, M., Soria, D. et Fraile, S., « New carnivores from the basal Middle Miocene of Arrisdrift, Namibia », Eclogae Geologicae Helvetiae, vol. 91, , p. 27–40
- Morales, J., Pickford, M., Fraile, S., Salesa, M. J. et Soria, D., « Creodonta and Carnivora from Arrisdrift, early Middle Miocene of southern Namibia », Memoirs of the Geological Survey of Namibia, vol. 19, , p. 177–194
- Werdelin, L., « A new genus and species of Felidae (Mammalia) from Rusinga Island, Kenya, with notes on early Felidae of Africa », Estudios Geológicos, vol. 67, no 2, , p. 217–222 (DOI 10.3989/egeol.40463.184, lire en ligne)
- Adrian, B., Werdelin, L. et Grossman, A., « New Miocene Carnivora (Mammalia) from Moruorot and Kalodirr, Kenya », Palaeontologia Electronica, vol. 21, no 1, , p. 21.1.10A (DOI 10.26879/778)
- M. Anton, Sabertooth, Bloomington, Indiana, University of Indiana Press, (ISBN 978-0-253-01042-1)
- (en) L. W. van den Hoek Ostende, M. Morlo et D. Nagel,, « Majestic killers: the sabre-toothed cats », Geology Today, fossils explained 52, vol. 22, no 4, , p. 150–157 (DOI 10.1111/j.1365-2451.2006.00572.x, lire en ligne [PDF], consulté le )
- L. de Bonis, S. Peigné, H. T. Mackaye, A. Likius, P. Vignaud et M. Brunet, « New sabre-toothed Felidae (Carnivora, Mammalia) in the hominid-bearing sites of Toros Menalla (late Miocene, Chad) », Geodiversitas, vol. 40, no 1, , p. 69−87 (DOI 10.5252/geodiversitas2018v40a3, lire en ligne)
- N. Spassov et D. Geraads, « A New Felid from the Late Miocene of the Balkans and the Contents of the Genus Metailurus Zdansky, 1924 (Carnivora, Felidae) », Journal of Mammalian Evolution, vol. 22, , p. 45–56 (DOI 10.1007/s10914-014-9266-5)
- (en) Wozencraft, W. C., Mammal Species of the World, Johns Hopkins University Press, (ISBN 978-0-8018-8221-0).
- Ces lignées sont généralement appelées : « lignée de la panthère » (genres Neofelis et Panthera) ; « lignée du chat bai » (genre Pardofelis) ; « lignée du caracal » (genres Caracal et Leptailurus) ; « lignée de l'ocelot » (genre Leopardus) ; « lignée du lynx » (genre Lynx) ; « lignée du puma » (genres Acinonyx et Puma) ; « lignée du chat domestique » (genre Felis) ; « lignée du chat léopard » (genres Otocolobus et Prionailurus).
- « Synthèse phylogénétique de l'évolution des félins », sur Pour la Science, (consulté le )
- Portail des félins
- Portail des mammifères