Ouabaïne
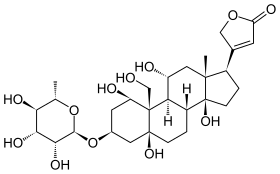
L’ouabaïne ou g-strophanthine est un hétéroside cardiotonique de formule brute C29H44O12 dont la partie sucrée est le L-rhamnose, un dérivé désoxyhexose du mannose. Il est l’une des formes naturelles de la strophantine, qui possèdent des propriétés similaires. Celle-ci est extraite à partir de l’ouabaio ou du Strophantus gratus, appartenant à la famille des apocynacées.
| ouabaïne | |
| |
| Identification | |
|---|---|
| Nom UICPA | 4-[(1R,3S,5S,8R,9S,10R,11R,13R,14S,17R)-1,5,11,14-tétrahydroxy-10- (hydroxyméthyl)-13-méthyl-3-((2R,3R,4R,5R,6S)-3,4,5-trihydroxy-6-méthyltétrahydro-2H- pyran-2-yloxy)hexadécahydro-1H-cyclopenta[a]phénanthrén-17-yl]furan-2(5H)-one |
| Synonymes |
g-strophanthine, ouabaïne |
| No CAS | |
| No ECHA | 100.010.128 |
| No CE | 211-139-3 |
| DrugBank | DB01092 |
| PubChem | 4605 |
| SMILES | |
| InChI | |
| Apparence | Poudre blanche |
| Propriétés chimiques | |
| Formule | C29H44O12 [Isomères] |
| Masse molaire[1] | 584,652 5 ± 0,029 9 g/mol C 59,58 %, H 7,59 %, O 32,84 %, 584.65 g/mol |
| Propriétés physiques | |
| T° fusion | 200 °C |
| T° ébullition | Modèle:272,9 |
| Masse volumique | Modèle:1,51/2 |
| Précautions | |
| Directive 67/548/EEC | |
| Composés apparentés | |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
Extraction
À partir des espèces du genre Acokanthera, on découpe le bois en petit copeaux dont on libère les diverses substances présentes en plongeant ces copeaux dans de l'eau chaude. Le mélange est ensuite déféqué à l'acétate de plomb puis neutralisé à l'acide sulfurique. Une étape de filtration est réalisée ainsi qu'un traitement à l'alcool à chaud. On obtient donc des cristaux après évaporation.
À partir du Strophantus gratus, les graines de l'arbre sont récupérées puis pulvérisées. Un épuisement à l'alcool est pratiqué, et on effectue une distillation sous vide afin d'éliminer celui-ci. Le résidu est ensuite mis dans de l'eau et l'évaporation des résidus dans l'eau donne des cristaux.
Les cristaux obtenus sont de couleur blanche et sont peu amers.
Propriétés diverses et action
Il s'agit d'un hétéroside cardiotonique, du fait de ses propriétés structurelles (7):
- Cycle lactonique insaturé sur le C17 en β
- Groupe oxygénés en β en C3 et C14
- Fusion Cis des cycles C & D (C11 à C17)
La numérotation des molécules est faite ci-dessous.
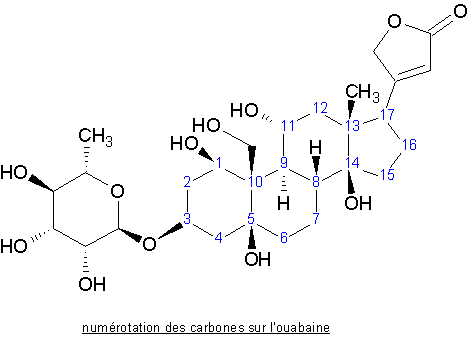
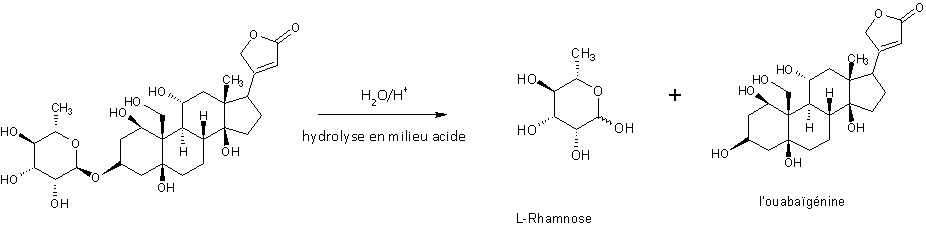
Le nombre de groupements OH détermine la toxicité du produit via la polarité de la molécule, ce qui favorise la rapidité d’action de la molécule dû à la solubilisation de celle-ci. L'ouabaine possède les propriétés générales des sucres (6), en effet l'hydrolyse de la molécule en milieu acide chlorhydrique donne le sucre L-Rhamnose & sa partie aglycone, l'ouabaïgénine, génine de même type de la digitaline, lui conférant à la molécule ses propriétés cardiotoniques.
L’ouabaïne peut être produite par les glandes surrénales lors d’une consommation excessive de sel. Celle-ci permet de stopper la dégradation de l’ATP présent dans l’organisme. Les membranes cellulaires contenant des pompes sodium/calcium & sodium/potassium se retrouvent inhibées du fait que l’ouabaïne entre en compétition avec le potassium entrant dans la cellule. Ces cellules perdent alors de leur potentiel membranaire du fait que l’échange entre un ion calcium et un ion sodium ne peut se faire, conduisant à une augmentation de la concentration des ions calcium et sodium dans le cytoplasme des cellules & à un arrêt progressif des pompes calcium/sodium. (2) (3)
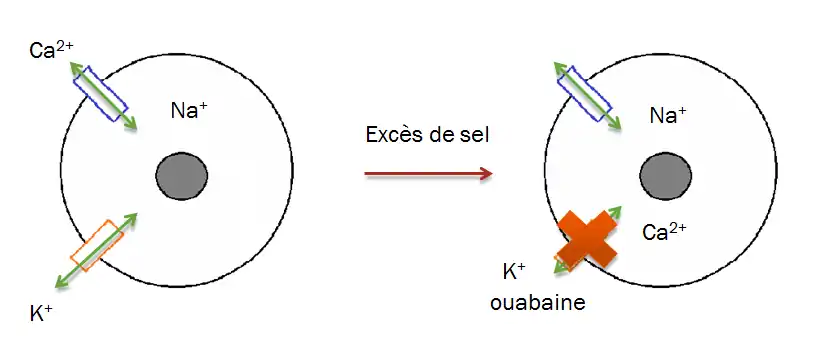
Ces effets conduisent à une augmentation du rythme cardiaque, et suivant la dose produite de l'ouabaine, des symptômes d'hypertension peuvent surgir. Une trop forte production de celle-ci peut conduire à un emballement du rythme cardiaque, donc à un risque de mort(Exemple pour le chat : 105 microgrammes/kg à la suite d'une injection en intraveineuse).
Usages
On utilisait les graines du Strophantus dans la fabrication des flèches empoisonnées durant leurs période de chasse ou de pêche, ou bien pour se défendre (7).
Actuellement, on utilise l'ouabaïne dans l'industrie pharmaceutique pour l'insuffisance cardiaque congestive accompagnée de fibrillation auriculaire. Cependant, celle-ci est très peu utilisé à cause de sa toxicité.
Article connexe
Liens externes
- http://www.odec.ca/projects/2005/ross5m0/public_html/avant_hyper.htm
- http://www.med.univ-rennes1.fr/cgi-bin/adm/reponse?prg=5&cod=M11924
- http://www.pharmacorama.com/Rubriques/Output/Digoxinea3.php
- http://fr.chemical5.com/formulas/cas-630-60-4.htm
- http://www.prota4u.org/protav8.asp?h=M5&t=Strophantus&p=Strophanthus+gratus#VernacularNamesOthers
- http://www.universalis-edu.com/encyclopedie/ouabaine/
- http://orbi.ulg.ac.be/bitstream/2268/22902/1/Des%20poisons%20de%20fleches%20aux%20r%C3%A9actifs%20pharmacologique%20de%20pointe%20pp%2091_122.pdf
- http://www.eurekasante.fr/medicaments/vidal-famille/medicament-ddigox01-DIGOXINE-NATIVELLE.html
- http://www.prota4u.org/protav8.asp?fr=1&g=pe&p=Acokanthera+oblongifolia+(Hochst.)+Codd
Notes & Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Portail de la botanique
- Portail de la chimie
- Portail de la pharmacie