Geldanamycine
La geldanamycine est un antibiotique de la famille des ansamycines à benzoquinone qui inhibe la protéine Hsp90 en occupant le site de liaison à l'ADP/ATP[3]. Cette protéine joue un rôle important dans la régulation du cycle cellulaire, la croissance et survie des cellules face aux stimuli notamment thermiques, l'apoptose, l'angiogenèse et l'oncogenèse.
| Geldanamycine | |
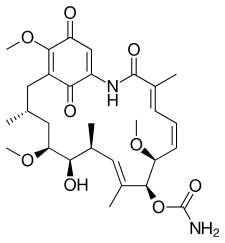 Structure de gladanamycine |
|
| Identification | |
|---|---|
| No CAS | |
| No RTECS | LX8920000[1] |
| PubChem | 5288382 |
| ChEBI | 5292 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C29H40N2O9 |
| Masse molaire[2] | 560,635 9 ± 0,029 1 g/mol C 62,13 %, H 7,19 %, N 5 %, O 25,68 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
La geldanamycine a été découverte chez Streptomyces hygroscopicus, une bactérie du genre Streptomyces[4]. Il s'agit d'un polycétide macrocyclique synthétisé par une polycétide synthase de type I. Les gènes gelA, gelB et gelC codent la polycétide synthase. Cette dernière est d'abord chargée avec de l'acide 3-amino-5-hydroxybenzoïque (AHBA) et utilise ensuite la malonyl-CoA, la méthylmalonyl-CoA et la méthoxymalonyl-CoA pour produire de la progeldanamycine, un précurseur de geldanamycine[5]. Cet intermédiaire subit par la suite plusieurs étapes pour produire la geldanamycine, telles qu'une hydroxylation, une méthylation, une carbamylation et une oxydation[6].
La geldanamycine induit, dans les cellules tumorales, la dégradation des protéines altérées par des mutations, notamment en rapport avec le gène Src, le chromosome de Philadelphie et le facteur p53, préférentiellement aux protéines normales. Cet effet est médié par la protéine Hsp90. Malgré son potentiel antitumoral important, la geldanamycine présente plusieurs inconvénients majeurs qui empêchent son utilisation comme médicament, notamment son hépatotoxicité, qui ont conduit au développement d'analogues substitués sur l'atome de carbone no 17 : la tanespimycine (17-AAG) et l'alvespimycine (17-DMAG).
Notes et références
- Fiche Sigma-Aldrich du composé Geldanamycine de Streptomyces hygroscopicus ≥ 98 % (HPLC), poudre, consultée le 23 août 2013.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Theodor W. Schulte, Shiro Akinaga, Shiro Soga, William Sullivan, Bridget Stensgard, David Toft, et Leonard M. Neckers4, « Antibiotic radicicol binds to the N-terminal domain of Hsp90 and shares important biologic activities with geldanamycin », Cell Stress Chaperones, vol. 3, no 2, , p. 100-108 (lire en ligne) DOI:10.1379/1466-1268(1998)003<0100:ARBTTN>2.3.CO;2
- (en) Weiqing He, Linzhuan Wu, Qunjie Gao, Yu Du et Yiguang Wang, « Identification of AHBA Biosynthetic Genes Related to Geldanamycin Biosynthesis in Streptomyces hygroscopicus 17997 », Current Microbiology, vol. 52, no 3, , p. 197-203 (lire en ligne) DOI:10.1007/s00284-005-0203-y
- (en) Woncheol Kim, Dongho Lee, Seong Su Hong, Zhu Na, Jin Chul Shin, Su Heun Roh, Cheng-Zhu Wu, Oksik Choi, Kyeong Lee, Yue-Mao Shen, Sang-Gi Paik, Jung Joon Lee et Young-Soo Hong, « Rational Biosynthetic Engineering for Optimization of Geldanamycin Analogues », ChemBioChem, vol. 10, no 7, , p. 1243-1251 (lire en ligne) DOI:10.1002/cbic.200800763
- (en) Dongho Lee, Kyeong Lee, Xing Fu Cai, Nguyen Tien Dat, Shanthaveerappa K. Boovanahalli, Mijeoung Lee, Jin Chul Shin, Woncheol Kim, Jae Kap Jeong, Jong Suk Lee, Choong-Hwan Lee, Jeong-Hyung Lee, Young-Soo Hong et Jung Joon Lee, « Biosynthesis of the Heat-Shock Protein 90 Inhibitor Geldanamycin: New Insight into the Formation of the Benzoquinone Moiety », ChemBioChem, vol. 7, no 2, , p. 246-248 (lire en ligne) DOI:10.1002/cbic.200500441
- Portail de la chimie