Glycosome
Le terme glycosome recouvre deux réalités cytologiques différentes. Il a été introduit en 1968 à la suite de l'observation que le glycogène n'est pas statique dans les hépatocytes mais reste associé aux enzymes de son métabolisme[2] : il s'agit dans ce cas d'une structure constituée de protéines interagissant avec le glycogène dans les cellules du foie. Mais les glycosomes sont également des organites typiques de certains protozoaires et qui contiennent les enzymes de la glycolyse. On les trouve en particulier chez les kinétoplastidés, au sein desquels figurent les trypanosomes et les Leishmania, de la famille des Trypanosomatidae, responsables notamment de la maladie du sommeil et de la leishmaniose. Ils sont délimités par une membrane simple et contiennent une matrice dense constituée de protéines. Ils assurent essentiellement la glycolyse au sein de ces cellules, mais interviennent également dans la voie de sauvetage des purines, la β-oxydation des acides gras, et la biosynthèse des étherlipides[3]. Des travaux phylogénétiques[4] laissent penser qu'ils ont évolué à partir du peroxysome[5].
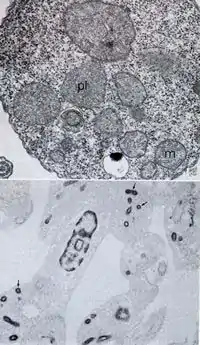
Structure des glycosomes hépatiques
Les glycosomes sont formés de glycogène et de protéines. Ces protéines sont les enzymes intervenant dans le métabolisme du glycogène. L'ensemble forme un complexe constituant un organite différentié[2]. Les protéines des glycosomes proviennent des ribosomes du cytosol et possèdent une séquence spécifique, appelée PTS1, qui les identifie afin qu'elles soient transportées jusqu'à leur destination[3]. Ils sont délimités par une membrane constituée d'une seule bicouche lipidique. Le glycogène des glycosomes est identique au glycogène libre du cytosol[6].
Les glycosomes peuvent être associés ou liés à différents types d'organites cellulaires. Ils ont été observés liés au réticulum sarcoplasmique et à ses filaments intermédiaires, aux myofibrilles, aux mitochondries, au réticulum endoplasmique rugueux, au sarcolemme, à des polyribosomes ou encore à l'appareil de Golgi. Ces différences entre organites liés peuvent introduire des différences de fonctionnalité entre ces différents glycosomes. Ceux qui sont liés aux myofibrilles semblent devoir fournir de l'énergie à la myosine en produisant de l'ATP par glycolyse. Ceux qui sont liés au réticulum endoplasmique lisse ou rugueux sollicitent en revanche leurs glycogène synthases et leurs [phosphorylase] phosphatases.
Fonctions des glycosomes des kinétoplastidés
Outre la glycolyse, ces glycosomes assurent des fonctions dans la voie de sauvetage des purines, la β-oxydation des acides gras, et la biosynthèse des étherlipides[3].

Les glycosomes possèdent les sept premières enzymes de la glycolyse, qui permettent l'oxydation du glucose en glycéraldéhyde-3-phosphate à l'aide de deux molécules de NAD+[5]. Deux molécules d'ATP sont consommées aux premières étapes de cette voie métabolique mais sont régénérées par la suite, de sorte que, globalement, les glycosomes ne produisent pas d'ATP avec la glycolyse : c'est dans le cytosol que les trois dernières étapes de cette voie métabolique se déroulent, et qu'elles produisent deux molécules d'ATP par molécule de glucose oxydée.
Les parasites qui ont des glycosomes sont incapables de synthétiser leurs purines de novo. Ils disposent en revanche d'une voie de sauvetage, dont certaines enzymes se trouvent dans les glycosomes : l'hypoxanthine-guanine phosphoribosyltransférase et l'adénine phosphoribosyltransférase notamment. Ces enzymes possèdent une séquence PTS1 qui les identifient comme devant être transportées jusqu'aux glycosomes[3].
Contrairement aux peroxysomes, la plupart des trypanosomes ont besoin de leurs glycosomes pour survivre, ce qui fait de ces derniers des cibles potentielles pour le développement de médicaments antiparasitaires. L'altération du fonctionnement des glycosomes conduit à une déficience en certaines enzymes intervenant dans la β-oxydation des acides gras et la biosynthèse d'étherlipides, dans la mesure où ces enzymes sont dégradées dans le cytosol faute de membrane pour les maintenir dans l'environnement des glycosomes. Or les étherlipides sont indispensables au cycle cellulaire des trypanosomes[5]. Par ailleurs, les glycosomes permettent de commencer la glycolyse en l'absence d'ATP, ce qui les rend indispensables aux trypanosomes pour survivre en situation de stress. Pour ces différentes raisons, des recherches pharmaceutiques sont menées afin de développer des médicaments altérant le fonctionnement des glycosomes[8].
Notes et références
- (en) Wanderley De Souza, « From the cell biology to the development of new chemotherapeutic approaches against trypanosomatids: dreams and reality », Kinetoplastid Biology and Disease, vol. 1, no 1, , p. 3 (PMID 12234386, PMCID 119324, DOI 10.1186/1475-9292-1-3, lire en ligne)
- (en) K. Kielan Rybicka, « Glycosomes — the organelles of glycogen metabolism », Tissue and Cell, vol. 28, no 3, , p. 253-265 (PMID 8701432, DOI 10.1016/S0040-8166(96)80013-9, lire en ligne)
- (en) Marilyn Parsons, Tetsuya Furuya, Sampa Pal et Peter Kessler, « Biogenesis and function of peroxisomes and glycosomes », Molecular and Biochemical Parasitology, vol. 115, no 1, , p. 19-28 (PMID 11377736, DOI 10.1016/S0166-6851(01)00261-4, lire en ligne)
- (en) J. A. Flaspohler, W. L. Rickoll, S. M. Beverley et M. Parsons, « Functional identification of a Leishmania gene related to the peroxin 2 gene reveals common ancestry of glycosomes and peroxisomes », Molecular and Cellular Biology, vol. 17, no 3, , p. 1093-1101 (PMID 9032236, PMCID 231834, DOI 10.1128/MCB.17.3.1093, lire en ligne)
- (en) Marilyn Parsons, « Glycosomes: parasites and the divergence of peroxisomal purpose », Molecular Biology, vol. 53, no 3, , p. 717-724 (PMID 15255886, DOI 10.1111/j.1365-2958.2004.04203.x, lire en ligne)
- (en) James G. White, « Platelet glycosomes », Platelets, vol. 10, no 4, , p. 141-146 (PMID 16801099, DOI 10.1080/09537109976095, lire en ligne)
- (en) Melisa Gualdron-Lopez et Paul A.M. Michels, « Channel-forming activities in glycosomes fraction from bloodstream form of Trypanosoma brucei », Compartmentalization of metabolism in trypanosomatid parasites and drug discovery, (consulté le )
- (en) Nathalie Galland, Stéphane de Walque, Frank G. J. Voncken, Christophe L. M. J. Verlinde et Paul A. M. Michels, « An internal sequence targets Trypanosoma brucei triosephosphate isomerase to glycosomes », Molecular and Biochemical Parasitology, vol. 171, no 1, , p. 45-49 (PMID 20138091, DOI 10.1016/j.molbiopara.2010.01.002, lire en ligne)
- Portail de la biologie cellulaire et moléculaire