Goitrine
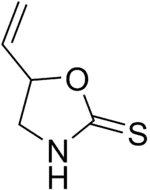
La goitrine est un thiocarbamate cyclique formant un cycle à cinq atomes (oxazolidine).
| Goitrine | |
| |
| Identification | |
|---|---|
| Nom systématique | 5-éthényl-1,3-oxazolidine-2-thione |
| Synonymes |
goitrine |
| No CAS | |
| No ECHA | 100.032.845 |
| PubChem | 3034683 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H7NOS [Isomères] |
| Masse molaire[1] | 129,18 ± 0,01 g/mol C 46,49 %, H 5,46 %, N 10,84 %, O 12,39 %, S 24,82 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Occurrence naturelle
La goitrine est naturellement présente dans les légumes crucifères, comme le chou, les choux de Bruxelles et dans l'huile de colza[2].
Formation
La goitrine est formée par hydrolyse d'un glucosinolate, la progoitrine ou 2-hydroxy-3-buténylglucosinolate. L'isothiocyanate (2-hydroxy-3-buténylisothiocyanate) instable dérivé de ce dernier se cyclise spontanément en goitrine, de par la présence du groupe hydroxyle situé à proximité du groupe isothiocyanate, ce qui permet la formation du cycle à cinq. L'oxygène de cette molécule provient donc du groupe hydroxyle de l'isothiocyanate instable original.
Effets
La goitrine réduit la production des hormones thyroïdiennes telles que la thyroxine[3], résultant en la possible formation d'un goitre, d'où son nom.
Les plantes contenant de la progoitrine (ou un autre glucosinolate tel que la glucobrassicine ou la sinalbine qui peuvent libérer un ion thiocyanate) ont donc un potentiel goitrogène, mais relativement faible, aucune altération des fonctions thyroïdiennes n'ayant été observée pour les quantités d'un régime alimentaire normal[4].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Goitrin » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Lüthy J, Carden B, Friederich U, Bachmann M, « Goitrin--a nitrosatable constituent of plant foodstuffs », Experientia, vol. 40, no 5, , p. 452–3 (PMID 6723906, DOI 10.1007/BF01952381)
- McMillan M, Spinks EA, Fenwick GR, « Preliminary observations on the effect of dietary brussels sprouts on thyroid function », Hum Toxicol, vol. 5, no 1, , p. 15–9 (PMID 2419242, DOI 10.1177/096032718600500104)
- Verhoeven DT, Verhagen H, Goldbohm RA, van den Brandt PA, van Poppel G, « A review of mechanisms underlying anticarcinogenicity by brassica vegetables », Chem. Biol. Interact., vol. 103, no 2, , p. 79–129 (PMID 9055870, DOI 10.1016/S0009-2797(96)03745-3, lire en ligne)
- Portail de la chimie