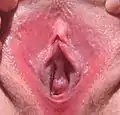
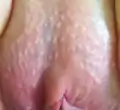
Grain de Fordyce
Les grains de Fordyce (granules de Fordyce ou papules de Fordyce) sont des macules et papules de couleur jaunâtre/blanchâtre, d'environ 1 à 3 mm de diamètre et plus opaques que la muqueuse périphérique. En raison de leur répartition spécifiques (uniquement sur certaines muqueuses), ils sont dits « ectopiques » et « hétérotopiques ».
Ils constituent un type particulier de glandes sébacées : ils sécrètent du sébum en faible quantité, mais surtout ils sont dépourvus de tout follicule pileux.
Leurs fonctions sont encore mal comprises, mais pourraient être liées au système hormonal, à la protection de certaines muqueuses et dans la bouche à la production de salive.
Bien que ces papules soient très fréquentes dans la bouche, et sur les organes génitaux ; leurs modifications pathologiques sont considérées comme 'curieusement' rares[1].
Remarque : il existe d'autres types de glandes sébacées ectopiques et dont le rôle est également encore mal compris : Glande de Tyson (glande prépuciale), tubercules de Montgomery qui sont des petites protubérances situées sur la peau de l'aréole qui entoure le mamelon du sein (formées par les glandes aréolaires sous-jacentes)[2].
Localisations
Ces petites glandes ne sont couramment observées que sur certaines structures anatomiques du corps :
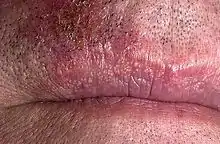
Sur les lèvres
Les lèvres ne sont pas recouvertes de peau mais d'une muqueuse particulière ; et on trouve souvent sur leur périphérie (et aux commissures parfois), à partir de l'adolescence, des alignements plus ou moins importants de grains de Fordyce. De même dans la bouche dans les parties correspondantes du sillon alvéo-labial (le sillon où se fait la jonction entre la muqueuse de la partie intérieure des lèvres et l'arc de la gencive où se trouvent les alvéoles dentaires)[1].
Il n'y a pas de corrélation connue ou significative entre les granules de Fordyce et les maladies systémiques[3].
Dans la bouche
- La présence de GdF est une variation normale des phénotypes de la muqueuse buccale[4] et de nombreuses études ont étudié leur incidence en fonction de l'âge, de la puberté et du sexe[5],[6],7,8,9,10.
En effet, de nombreux grain de Fordyce sont présents sur la muqueuse de l'intérieur de la bouche de la plupart des adolescents et des adultes (muqueuses prolabiales et orales)[1] (chez qui ces glandes sébacées intrabuccales ne doivent pas être confondues avec des débuts d'aphtes ou des boutons parfois présent sur la face intérieure des lèvres, des joues, etc). Sewerin a estimé que 80 % des gens en ont sur leurs muqueuses prolabiales, et de 95 % sur leurs muqueuses buccales, avec un pic entre 20 et 29 ans. Une autre étude plus récente, et faite en Afrique du Sud en a trouvé moins (chez 62,07 % et 57,25 % chez les hommes et femmes adultes, respectivement). Selon Vigarios (2021) La muqueuse buccale est la seconde partie du corps où l'on trouve le plus de grains de Fordyce, sans différence significative de prévalence entre hommes et femmes[1] ; selon 0livier (2006), 70 à 95 % de la population en porte et elles sont parfois si nombreuses qu'elles peuvent dominer la surface de la muqueuse buccale[7].
Les lipides de la muqueuse de la bouche (muqueuses constamment en renouvellement) pourraient jouer un rôle immunitaire et de protection important [8].
Sur les organes génitaux externes
Des grains de Fordyce apparaissent, souvent à l'adolescencence, sur une partie de la peau et de muqueuses des organes génitaux externes (sur la face interne du pénis principalement) chez le garçon, et dans la vulve, sur les petites lèvres chez l'adolescente puis la femme[9],[10].
Dans le tube digestif
Exceptionnellement, elles semblent aussi présentes sur certaines muqueuses lisses du tube digestif (muqueuses oesophagiennes)[11] ,[12].
Lien avec l'Hyperlipidemie ?
En 2014, des chercheurs ont observé la bouche de 350 personnes recrutées pour une étude sur les grains de Fordyce dans la sphère buccale). Près de 90 % du groupe portaient des papules de Fordyce détectables[13]. Ces papules étaient surtout localisés sur la muqueuse buccale et parfois sur la muqueuse des lèvres ; leur densité tendait à diminuer avec l'âge et/ou avec le tabagisme ; les personnes au profil lipidique élevé portaient en moyenne plus de papules que les autres membres du panel[13].
Aspects
Plutôt que de véritables « grains », ils ont l'apparence de micropapules de faible épaisseur, de 1 à 3 mm de diamètre, parfois lobulées, formant éventuellement l'apparence de plaques ou d'alignements de papules.
Sur les organes génitaux, ils sont perceptibles par une légère granulation et surtout rendus visible par une teinte plus claire que la peau de la verge (blanc-jaunâtre sur une peau claire) notamment sur la peau étirée et/ou lors de l'érection[14].
Ils ne doivent pas être confondus avec les papules qui forment (beaucoup plus rarement) les papules perlées blanches sur la couronne du gland.
Apparition et évolution selon les âges de la vie
Dans la bouche (sur la gencive inférieure, sur les muqueuses) ces papules n'apparaitraient que peu à peu, et rarement vers l'âge de 3 ans, puis à l'adolescence pour devenir plus visibles à l'âge adulte[15]. Une étude ayant porté sur 32 022 enfants mexicains (16 473 garçons, 15 549 filles) a constaté que les granules de Fordyce étaient très rares (prévalence : 1,2 pour 1 000 enfants), contrastant avec une prévalence de 85,6 % rapportée pour la population adulte[16].
On sait que les changements hormonaux de la puberté induisent de fortes modifications de la teneur en cires et en lipides du biofilm protecteur de la peau. Ces changements de milieu sélectionnent à leur tour d'autres communautés bactériennes et fongiques, modifiant durablement le microbiote cutané[17] (et l'odeur corporelle), avec souvent des problèmes d'acné[18] qui se résolvent en fin de puberté. L'évolution des communautés microbiennes a pu être associée aux stades de Tanner (classification du degré de maturation sexuelle), avec aussi des différences notables selon le sexe[17]. Les filles d'un petit panel étudié avaient une flore cutanée dominée par le genre Cutibacterium avec une diversité décroissante dans le temps de la puberté. Parmi les champignons, Malassezia prédominait sur la plupart des sites cutanés chez les sujets plus matures sexuellement, et de manière plus marquée chez les filles. Les abondances relatives plus élevées de ces taxons lipophiles - Cutibacterium acnes et Malassezia restricta étaient fortement associés aux concentrations sériques d'hormones sexuelles connue pour leur influence sur l'activité des glandes sébacées[17]. Les grain de Fordyce jouent donc un rôle évolutif lié à la maturation sexuelle, la physiologie de la peau et au microbiome cutané externe[17].
Il ne semble cependant pas y avoir déjà eu d'études évaluant si les grain de Fordyce modifient également le biofilm des muqueuses internes de la bouche d'une manière équivalente ou proche.
À Taïwan, selon une étude publiée en 2014 : 82,8 % des 2050 patients reçus pour un examen de la bouche par le départment de dentisterie du Chang Gung Memorial Hospital de Taipei présentaient des granules de Fordyce dans la bouche ; ces granules étaient plus fréquents chez les hommes (89,5 % des cas) que chez les femmes (87,5 % des cas), et en nombre croissant avec l'âge (en moyenne). Les auteurs notent que ces granules égaient plus fréquemment sur la muqueuses labiale et sur la « muqueuse buccale » (ici définie par l'épithélium tapissant la surface interne des joues et des lèvres depuis la ligne de contact des lèvres opposées jusqu'à la ligne d'attache entre la crête alvéolaire (supérieure et inférieure) et le Raphé ptérygo-mandibulaire) par rapport à tout autre partie de la muqueuse qui tapisse l'intérieur de la cavité buccale[19].
Puis avec la vieillesse, la densité de ces papules diminue.
- Sur les organes génitaux, les grains de Fordyce apparaissent surtout au moment de la puberté (les glandes sébacées sont connues pour fortement répondre à plusieurs hormones sexuelles à l'adolescence). Ils peuvent aussi être induits par une stimulation hormonale des glandes sébacées.
Prévalence
On estime[réf. souhaitée] que la moitié de la population porteraient des Grains de Fordyce.
Fonction(s)
Leurs éventuelles fonctions sont encore mal comprise, d'autant que ces glandes produisent très peu de sébum.
De nombreuses études ont montré que les lipides cutanés ont un rôle utile pour la santé de la peau (sauf en cas d'excès et de déséquilibres dans le cas de l'acné par exemple), mais peu d'études se sont intéressé à l'utilité et aux effets des lipides produits par les glandes de Fordyce de la muqueuse buccale, vulvaire ou la peau du pénis.
La salive humaine (qui a notamment un rôle anti-microbien démontré[8],[20]) est un mucus complexe contenant notamment du cholestérol, des acides gras, des triglycérides, des esters de cire, des esters de cholestérol et du squalène ; sa teneur moyenne en lipides neutres totaux est d'environ de 12,1 ± 6,3 μg/ml[21]. Ces lipides salivaire sont chimiquement très similaires à ceux trouvés à la surface de la peau (lesquels ont une composition qui change entre le stade "nouveau-né" et la fin de la puberté)[22]. Ces lipides neutres semblent à la fois produits par les grain de Fordyce de la muqueuse buccale et par des glandes sébacées associées aux principales glandes salivaires[21].
grains de Fordyce et santé
En dépit de leur forme qui peut faire penser à des boutons ou à une allergie, les grains de Fordyce sont plus ou moins fermes, toujours indolores au contact et à la palpation. Ils sont normaux, sans aucun danger et non-contagieux.
Ces entités physiologiques (au même titre que les grains de beauté) peut être source de crainte (ou de souffrance psychologique chez ceux qui en ignoraient l'existence).
Les dermatologues considèrent ce « problème » comme un non-problème ou comme bénin. Certains proposent néanmoins un traitement au laser CO2, une électrodessication[23] ; certains chirurgiens proposent de les retirer à l'emporte-pièce[24] et en 2019, Ga Ram Ahn & al; cite « un cas de traitement réussi de taches de Fordyce avec un dispositif de radiofréquence à micro-aiguille isolée » [25].
La circoncision ne prévient ni ne modifie en rien cette particularité.[réf. nécessaire]
Modifications pathologiques
Elles semblent curieusement rares chez glandes sébacées libres (par rapport à celles de la peau)[26].
En 1993, Daley s'étonnait que l'on comprenne encore si peu de choses sur les processus physiologiques et pathologiques qui impliquent les glandes sébacées intrabuccales (grains de Fordyce)[26]
Parmi les rares cas pathologiques on peut citer :
- occupations des grains par des Demodex[26], pathologiques que s'ils prolifèrent au-delà d'un certain seuil :
- lésions kystiques[26] (à ne pas confondre avec le vrai kyste sébacé), avec par exemple de possibles « pseudokystes » remplis de kératine se formant dans les canaux excréteurs de glandes sébacées situées sur le bord vermillon de la lèvre inférieure d'une femme de 86 ans. Cette entité pathologique est probablement à relier aux milia de la peau ;
- hyperplasie sébacée ; Daley en 1993 notait que les néoplasmes de ces glandes sont rares, mais que leur hyperplasie est plus fréquente et parfois mal diagnostiquée (car confondues avec de gros « granules de Fordyce » ou quand elles sont très grosses avec des adénomes sébacés) ; il a proposé de définir l'hyperplasie sébacée intrabuccale comme une lésion cliniquement jugée comme une anomalie distincte, nécessitant une biopsie pour le diagnostic ou la confirmation de l'impression clinique, présentant des caractéristiques d'une ou plusieurs glandes sébacées bien différenciées présentant au moins 15 lobules par glande. Selon sa définition : les glandes sébacées avec moins de 15 lobules et formant une lésion clinique apparemment distincte sur la muqueuse buccale sont normales, et toutes autres lésions similaires d'autres sites intrabuccaux sont à considérer comme des glandes sébacées ectopiques. Les adénomes sébacés sont moins différenciés que les hyperplasies sébacées[26]. ;
- lésions néoplasiques[26] ; En 2015, des chercheurs italiens montrent qu'une activation du système des glandes sébacées (Granulés de fordyce de la muqueuse buccale y compris) se produit chez les patients atteints du syndrome de Muir-Torre (SMT). Selon eux, l'« hyperplasie sébacée intra-orale » pourrait devenir un paramètre supplémentaire pour le diagnostic clinique du syndrome de Muir-Torre. Cette hyperplasie pourrait aussi permettre de distinguer des individus plus susceptibles d'être affectés par ce syndrome[27].
- cas rarissimes de stéatocystome simplex intra-oral (deux cas connus)[28].
Notes et références
- E. Vigarios et V. Sibaud, « Grains de Fordyce de la muqueuse buccale », Annales de Dermatologie et de Vénéréologie - FMC, vol. 1, no 2, , p. 88–90 (DOI 10.1016/j.fander.2020.04.001, lire en ligne, consulté le )
- (en) Luis Requena et Omar Sangüeza, Cutaneous Adnexal Neoplasms, Springer International Publishing, (ISBN 978-3-319-45703-1, DOI 10.1007/978-3-319-45704-8, lire en ligne)
- (de) A. Dreher et G. Grevers, Fordyce-Flecken, vol. 74, , 390–392 p. (ISSN 0935-8943 et 1438-8685, DOI 10.1055/s-2007-997764, lire en ligne), chap. 06
- Bork K, Hoede N, Korting G, Burgdorf WH, Young SK. 2nd ed. Philadelphia: WB Saunders; 1996. Diseases of the Oral Mucosa and the Lips; p. 240–1.
- (en) Meir Gorsky, Amos Buchner, Dan Fundoianu-Dayan et Carmela Cohen, « Fordyce's granules in the oral mucosa of adult Israeli Jews », Community Dentistry and Oral Epidemiology, vol. 14, no 4, , p. 231–232 (ISSN 0301-5661 et 1600-0528, DOI 10.1111/j.1600-0528.1986.tb01541.x, lire en ligne, consulté le )
- (en) K.M. Nordstrom, K.J. McGinley, S.R. Lessin et J.J. Leyden, « Neutral lipid composition of Fordyce's granules », British Journal of Dermatology, vol. 121, no 5, , p. 669–670 (ISSN 0007-0963 et 1365-2133, DOI 10.1111/j.1365-2133.1989.tb08205.x, lire en ligne, consulté le )
- J.H Olivier, « Fordyce granules on the prolabial and oral mucous membranes of a selected population », SADJ, vol. 61, no 2, , p. 072–074 (ISSN 1029-4864, PMID 16711559, lire en ligne, consulté le )
- D. V. Dawson, D. R. Drake, J. R. Hill et K. A. Brogden, « Organization, barrier function and antimicrobial lipids of the oral mucosa », International Journal of Cosmetic Science, vol. 35, no 3, , p. 220–223 (ISSN 1468-2494, PMID 23320785, PMCID 3640763, DOI 10.1111/ics.12038, lire en ligne, consulté le )
- RA. Monteil. « Les grains de Fordyce : maladie, hétérotopie ou adenoma ? Étude histologique et ultrastructurale (Fordyce's spots: disease, heterotopia or adenoma? Histological and ultrastructural study) » J Biol Buccale 1981 Jun;9(2):109-28.
- Françoise Plantier, « Particularités anatomo-pathologiques de la vulve », Annales de Pathologie, muqueuses génitales, vol. 42, no 1, , p. 43–48 (ISSN 0242-6498, DOI 10.1016/j.annpat.2021.04.002, lire en ligne, consulté le )
- Marie Csanyi, Maxime Arnaud, Florence Le Pessot et Emmanuel Huet, « À propos de 2 cas de glandes sébacées ectopiques œsophagiennes : corrélations endoscopiques, et anatomopathologiques sur biopsies et pièces opératoires », Annales de Pathologie, vol. 36, no 2, , p. 134–138 (ISSN 0242-6498, DOI 10.1016/j.annpat.2016.01.004, lire en ligne, consulté le )
- EBSCOhost Login (lire en ligne)
- Kamis Y. Gaballah et Iman Rahimi, « Can presence of oral Fordyce's granules serve as a marker for hyperlipidemia? », Dental Research Journal, vol. 11, no 5, , p. 553–558 (ISSN 1735-3327, PMID 25426145, PMCID 4241607, lire en ligne, consulté le )
- (en) William H. Goeckerman « Fordyce's condition of the penis. Report of a case » Arch Derm Syphilol. 1926;14(1):50-52. DOI:10.1001/archderm.1926.02370190063008
- Crispian Scully, Oral and maxillofacial medicine : the basis of diagnosis and treatment, Churchill Livingstone/Elsevier, (ISBN 978-0-7020-4948-4, lire en ligne)
- (en) Heddie O. Sedano, Ignacio Carreon Freyre, Maria L.Garza de la Garza et Celia M.Gomar Franco, « Clinical orodental abnormalities in Mexican children », Oral Surgery, Oral Medicine, Oral Pathology, vol. 68, no 3, , p. 300–311 (DOI 10.1016/0030-4220(89)90215-6, lire en ligne, consulté le )
- (en) Jin Park, Nicole H. Schwardt, Jay-Hyun Jo et Zhiwei Zhang, « Shifts in the Skin Bacterial and Fungal Communities of Healthy Children Transitioning through Puberty », Journal of Investigative Dermatology, vol. 142, no 1, , p. 212–219 (PMID 34252398, PMCID PMC8688298, DOI 10.1016/j.jid.2021.04.034, lire en ligne, consulté le )
- (en) Jubin Kim, Taehun Park, Hye-Jin Kim et Susun An, « Inferences in microbial structural signatures of acne microbiome and mycobiome », Journal of Microbiology, vol. 59, no 4, , p. 369–375 (ISSN 1225-8873 et 1976-3794, DOI 10.1007/s12275-021-0647-1, lire en ligne, consulté le )
- (en) Meng-Ling Chiang, Yu-Jia Hsieh, Yu-Lun Tseng et Jr-Rung Lin, « Oral mucosal lesions and developmental anomalies in dental patients of a teaching hospital in Northern Taiwan », Journal of Dental Sciences, vol. 9, no 1, , p. 69–77 (DOI 10.1016/j.jds.2013.06.004, lire en ligne, consulté le )
- (en) Philip W. Wertz et Sarah de Szalay, « Innate Antimicrobial Defense of Skin and Oral Mucosa », Antibiotics, vol. 9, no 4, , p. 159 (ISSN 2079-6382, DOI 10.3390/antibiotics9040159, lire en ligne, consulté le )
- (en) Andrew J. Brasser, Christopher A. Barwacz, Deborah V. Dawson et Kim A. Brogden, « Presence of wax esters and squalene in human saliva », Archives of Oral Biology, vol. 56, no 6, , p. 588–591 (PMID 21247555, PMCID PMC3095707, DOI 10.1016/j.archoralbio.2010.12.002, lire en ligne, consulté le )
- P. Ramasastry, D. T. Downing, P. E. Pochi et J. S. Strauss, « Chemical composition of human skin surface lipids from birth to puberty », The Journal of Investigative Dermatology, vol. 54, no 2, , p. 139–144 (ISSN 0022-202X, PMID 5414607, DOI 10.1111/1523-1747.ep12257164, lire en ligne, consulté le )
- (en) Lee JH, Lee JH, Kwon NH, Yu DS, Kim GM, Park CJ, Lee JD, Kim SY, « Clinicopathologic Manifestations of Patients with Fordyce's Spots », Ann Dermatol, vol. 24, no 1, , p. 103-6. (PMID 22363169, PMCID PMC3283840, DOI 10.5021/ad.2012.24.1.103, lire en ligne [html])
- (en) Pallua N, Stromps JP, « Micro-punch technique for treatment of Fordyce spots: a surgical approach for an unpleasant condition of the male genital », J Plast Reconstr Aesthet Surg, vol. 66, no 1, , e8-11. (PMID 23026471, DOI 10.1016/j.bjps.2012.08.039)
- (en) Ga Ram Ahn, Su Jung Park, Chang Kyun Lee et Beom Joon Kim, « A case of successful treatment of Fordyce spots with a single insulated microneedle radiofrequency device », Dermatologic Therapy, vol. 32, no 5, (ISSN 1396-0296 et 1529-8019, DOI 10.1111/dth.13026, lire en ligne, consulté le )
- (en) Tom D. Daley, « Intraoral sebaceous hyperplasia », Oral Surgery, Oral Medicine, Oral Pathology, vol. 75, no 3, , p. 343–347 (DOI 10.1016/0030-4220(93)90148-W, lire en ligne, consulté le )
- Ponti, G., Meschieri, A., Pollio, A., Ruini, C., Manfredini, M., Longo, C., ... & Pellacani, G. (2015). Fordyce granules and hyperplastic mucosal sebaceous glands as distinctive stigmata in Muir–Torre syndrome patients: characterization with reflectance confocal microscopy. Journal of Oral Pathology & Medicine, 44(7), 552-557.
- (en) Tom Daley, « Pathology of intraoral sebaceous glands », Journal of Oral Pathology and Medicine, vol. 22, no 6, , p. 241–245 (ISSN 0904-2512 et 1600-0714, DOI 10.1111/j.1600-0714.1993.tb01065.x, lire en ligne, consulté le )
Liens externes
- Les grains de Fordyce (vulgarisation)
- (en) Détails sur les grains de Fordyce
- (en) Net Doctor : bouton sur le pénis
- (en) Grain de Fordyce
- Informations et réactions à propos des grains de Fordyce
- Portail de la médecine
- Portail de l’anatomie