Hème b
L'hème de type B est un groupement prosthétique des protéines de transport de l'oxygène, notamment l'hémoglobine et la myoglobine, c'est-à-dire un groupement non protéique de ces protéines. Cette hème contient un atome de fer sous forme ferreux Fe2+ en son centre qui lui permettra d'être liée de façon covalente à la protéine d'hémoglobine et qui lui permettra également de fixer les molécules de dioxygène (O2) afin de permettre à la molécule d'hémoglobine de transporter l'oxygène dans le sang puis dans les tissus où la pression partielle en oxygène sera basse.
| Hème b | |
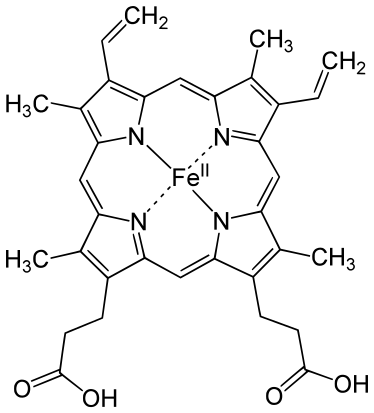 Structure de l'hème b |
|
| Identification | |
|---|---|
| Nom UICPA | acide 3-[18-(2-carboxyéthyl)-7,12-bis(éthényl)-3,8,13,17-tétraméthylporphyrin-21,23-diid-2-yl]propanoïque ; fer(II) |
| Synonymes |
ferrohème b, |
| No CAS | |
| No ECHA | 100.114.904 |
| PubChem | 444097 |
| ChEBI | 17627 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C34H32FeN4O4 [Isomères] |
| Masse molaire[1] | 616,487 ± 0,033 g/mol C 66,24 %, H 5,23 %, Fe 9,06 %, N 9,09 %, O 10,38 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
L’hème b, également appelé protohème IX, est la forme la plus abondante d'hème. L'hémoglobine et la myoglobine sont deux exemples de protéines de transport de l'oxygène qui contiennent de l'hème b. Ce dernier est également présent dans les peroxydases, et les cyclooxygénases COX-1 et COX-2 en contiennent sur l'un de leurs deux sites actifs.
L'hème b est généralement lié à l'apoprotéine par une liaison covalente de coordination entre l'ion ferreux et la chaîne latérale d'un résidu d'acide aminé de la protéine.
Dans l'hémoglobine et la myoglobine, l'ion ferreux est ainsi coordonné avec un résidu histidine, mais avec un résidu cystéine dans le cytochrome P450 et de l'oxyde nitrique synthase : dans tous ces cas, l'acide aminé de coordination avec l'hème est conservé au cours de l'évolution.
Structure de l'hème de type B
L’hème contient en localisation plutôt centrale un noyau appelé noyau porphyrique ou porphyrine ou protoporphyrine IX (synonymes). Sur ce noyau s’ajouteront des chaînes latérales avec des positions bien précises. Ces chaînes peuvent être des groupements méthyles, vinyles ou acides propioniques (acide carboxylique). Cette combinaison d'un noyau porphyrique et de chaînes latérales constituent l'hème de type B.
L’hème est composée de 4 noyaux pyrroles (tétrapyrrole) qui contiennent du carbone et de l’azote. Ces 4 noyaux pyrroles ont cette propriété assez remarquable d’être tous situés dans le même plan (exceptionnel au vu du nombre d’atomes, l'hème est une des plus grandes molécules planes existant dans le vivant). Ils sont reliés par des ponts carbone insaturés. Ces insaturations avec leurs orbitales π vont permettre une délocalisation des électrons et entraîner un effet d’égalisation de toutes les orbitales (immense hybridation) qui rendra la structure plane.
Fixation du fer
Un atome supplémentaire se trouve au centre de l’hème : le fer, sous forme Fe2+ ferreux. Il est fixé par des liaisons covalentes à 4 azotes de l'hème et maintenu dans le plan de la structure. Le fer ferreux possède 4 potentialités de valence (liaisons de coordination) dans le plan, et 2 valences en dessous et au-dessus du plan soit en tout 6 électrons de valences.
L’hème va se fixer sur l’hémoglobine grâce au fer. Ce fer se fixe sur une histidine de l'hémoglobine particulière qui ressemble au noyau pyrrole : l'histidine de l’hélice alpha F. Sur cette hélice alpha, l'histidine est le 8ème acide aminé. On appelle cette histidine l’histidine proximale ou histidine F8 : c’est la plus proche de l’hème. C’est une liaison covalente de coordination.
L’hème n’est ainsi pas fixé de façon très solide et va pouvoir bouger. En réalité, c’est toute la poche hydrophobe dans laquelle se fixe l'hème au sein de l'hémoglobine, qui fixe cette hème de façon correcte et relativement immuable. Avec des liaisons faibles qui sont des liaisons hydrophobes, donc par la présence de doubles liaisons et la présence d’acides aminés hydrophobes qui permettent des interactions hydrophobes dipôle-dipôle, on a une fixation de l’hème à l’intérieur de la structure.
Transport de l'oxygène grâce à l'hème
Il y a donc 4 liaisons dans le plan de l'hème, une 5ème liaison sur l’histidine proximale, et il existe une 6ème liaison possible qui va utiliser une paire d’électrons du dioxygène pour faire une liaison covalente. L’oxygène se fixe très fortement sur l'atome de fer de l'hème. Il va former un angle.
Cet angle est vital car il explique l’affinité de l’hémoglobine pour l’oxygène. Cet oxygène va pouvoir se détacher lorsque la pression partielle en oxygène va baisser : la liaison même si elle est covalente va pouvoir être relâchée dans les bonnes conditions (oxygène en faible concentration).
Oxydation du fer de l'hème
C’est la 6ème liaison du fer sous forme ferreux (Fe2+) qui forme une liaison covalente de coordination avec l’atome de dioxygène. Ce fer peut subir des réactions d’oxydoréduction et être transformé en fer ferrique Fe3+. Le fer ferrique qui a perdu un électron ne peut plus fixer l’oxygène : il n'existe plus de liaison supplémentaire pour la liaison. Lorsque le fer est sous forme Fe3+ on appelle la molécule qui le porte la méthémoglobine. C’est une hémoglobine dans laquelle le fer s’est oxydé sous forme de fer ferrique à cause d’oxydants. L’hème est entièrement protégé à l’intérieur de l’hémoglobine : cette protection empêche l’attaque par des oxydants notamment la présence de l’eau qui peut oxyder le fer ferreux. Cette protection n'est toutefois pas à toute épreuve.
L'oxydation du fer ferreux qui passe sous forme ferrique peut entraîner des complications pathologiques au sein de l'organisme telles que la méthémoglobinémie.
Transport du monoxyde de carbone
L’hémoglobine est un transporteur optimal du monoxyde de carbone (CO). C’est assez dangereux et paradoxal car le monoxyde de carbone est un poison violent et ne peut pas remplacer le dioxygène dans les chaînes biologiques.
Si l’on prend un hème ferreux et que l’on y met du monoxyde de carbone, il y a une affinité plus forte que l’oxygène (25 000 fois supérieure). Normalement, on ne trouve pas ou très peu de monoxyde de carbone dans l’environnement (produit de combustion partielle des corps carbonés, exemple : cheminée qui brûle du bois dans un milieu fermé, avec une hypoxie partielle, produit du monoxyde de carbone). Si on trouve du monoxyde de carbone dans l’environnement et qu’il se fixe sur l’hémoglobine, cette hémoglobine est perdue et on ne pourra plus enlever le monoxyde de carbone à cause de cette affinité extrême : les cellules éliminent l’hémoglobine.
Un phénomène cependant empêche le monoxyde de carbone de se fixer : l’histidine distale, qui permet à l’oxygène de créer une liaison hydrogène, va empêcher la liaison optimale du monoxyde de carbone sur le fer en formant une liaison coudée entre les atomes. Cette affinité de 25 000 va être divisée par 125 par un coude, et on n’a plus qu’une affinité 200 fois plus forte que celle de l’oxygène. Ce phénomène est vital puisque avec une affinité du monoxyde de carbone 25 000 fois plus forte que celle du dioxygène, même les traces de monoxyde de carbone produites par notre environnement (produites par tout ce qui est une combustion, même notre respiration), se fixent et toute possibilité de transporter de l’oxygène via l’hémoglobine disparaît.
Dans le cas du dioxygène, la liaison hydrogène est exactement dans l’axe de l’orbitale de la paire d’électrons et va être optimisée avec l’azote de l’histidine.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Portail de la chimie
- Portail de la biochimie