Hémagglutination
L’hémagglutination est une variante de la réaction d’agglutination. Elle est définie comme la fixation d’anticorps spécifiques sur des structures antigéniques présentes à la surface des globules rouges. Cette réaction aboutit à la formation d’un agrégat d'hématies appelé agglutinat. L’hémagglutination est un mécanisme principalement utilisé en laboratoire afin d’établir des sérodiagnostics et de déterminer les groupes sanguins. Cette méthode est très utilisée étant donné sa rapidité, sa bonne sensibilité et son faible coût.
.jpg.webp)
Principe
La réaction d'hémagglutination met en jeu la fixation d'anticorps sur des antigènes dit particulaires. C'est un moyen de détecter les anticorps d’un immun-sérum, signe de la réponse immunitaire humorale, qui se fixent sur les antigènes membranaires des hématies. C'est aussi un moyen de déterminer le groupe sanguin grâce à un anticorps connu appelé sérum test. Ceci est possible par le biais d’un pouvoir agglutinant.
Deux théories rendent compte de ce mécanisme :
- La théorie des ponts : une immunoglobuline (Ig) étant accrochée par ses deux sites anticorps à deux sites antigéniques membranaires d’érythrocytes différents.
- La théorie du potentiel zêta : l’anticorps est une protéine amphotère qui neutralise les charges électronégatives des radicaux carboxylates (COO- de l'acide sialique en particulier) et permet le rapprochement des hématies.
- Théorie mixte : en fait, selon la position de l'épitope plus ou moins enfoui sous le glycocalix (RH) ou à l'extrémité d'une chaîne protéique ou osidique (MNS, ABO), et donc plus ou moins éloigné de la membrane lipidique, l'accessibilité par les anticorps sera très différente. Le rapprochement des hématies peut donc être initié par une chute du potentiel zêta, puis renforcé par des ponts, ou être initié par des ponts sur des épitopes nombreux (ABO) et très externes ou sur des hématies déformées présentant des spicules, fixation initiale qui contribue également à baisser le potentiel zêta.
La liaison des anticorps aux antigènes membranaires (ABO, RH, Duffy, Kidd…), adsorbés (Lewis, Chido-Rodgers) ou artificiellement fixés (technique précédant au milieu des années 1970 l'IEA pour les sérologies virales, par exemple) présents sur les hématies entraîne une baisse du potentiel zêta et un rapprochement des hématies. Une fois ces hématies suffisamment proches, elles peuvent s'agréger en agglutinats soit par l'action de force de van der Waals ou de tension superficielle, et/ou par les ponts qui peuvent se former entre deux hématies grâce aux deux (IgG) ou divers (IgM) sites anticorps (Fab) d'une même immunoglobuline.
Certaines agglutinines sont plus ou moins agglutinantes :
- Les IgM ont un fort pouvoir agglutinant, cela résulte de leur structure moléculaire : chaque molécule d'IgM est constituée de 5 sous-unités identiques ayant la structure de base des molécules d'Ac, à savoir, 2 chaines lourdes (H), deux chaines légère (L) et deux sites anticorps.
- Alors que les IgG sont peu ou pas agglutinantes du fait de leur structure bivalente et de leur poids moléculaire (160 000) inférieur à celui des IgM (1 000 000).
Les antigènes peuvent exister naturellement sur la cellule : ce sont des antigènes particulaires (ex. : antigènes de groupes érythrocytaires sur les hématies) ou être fixés artificiellement sur une particule inerte (bille de latex, gélatine, particule de charbon, bille de polystyrène, hématie…) : ce sont des antigènes solubles rendus particulaires. On parle alors d'agglutination directe ou passive.
Les hématies sont des structures intéressantes d'utilisation car elles représentent un support neutre et rendent visible la réaction. Cependant ce sont des supports fragiles qui nécessitent préalablement un traitement au formol les rendant plus résistants.
De plus, pour ces réactions il est nécessaire d’effectuer :
- un témoin réactif avec des hématies non sensibilisées à l’antigène qui vérifie que la solution tampon est bien isotonique et que les hématies sont bien neutres.
- un témoin positif et un témoin négatif qui permettent d'effectuer un contrôle qualité.
Hémagglutination directe active
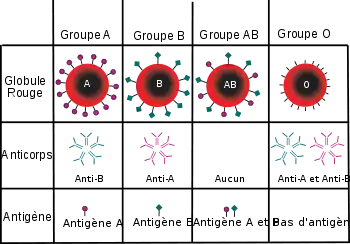
L’hémagglutination directe active repose sur la mise en présence d’hématies et d’un sérum contenant des anticorps agglutinants, en règle générale des IgM. Dès lors, les hématies s’agglutinent si ces anticorps baissent suffisamment le potentiel zêta et forment des ponts avec les antigène particulaires présents naturellement sur les membranes des hématies.
ex. : recherche de groupe sanguin[1] (les hématies sont porteuse des antigènes des différents systèmes de groupe sanguins), l’identification d’hématies animales et la détection d'anticorps dans un liquide biologique.
Hémagglutination directe passive
L’hémagglutination directe passive se fait avec des antigènes solubles fixés sur les membranes des hématies les rendant ainsi particulaires. Les hématies jouent ici le rôle de support figuré inerte n'intervenant pas dans la réaction antigènes-anticorps. La présence d'anticorps agglutinants sera alors décelée par l'agglutination des hématies sur lesquelles l'antigène a été fixé.
Hémagglutination indirecte
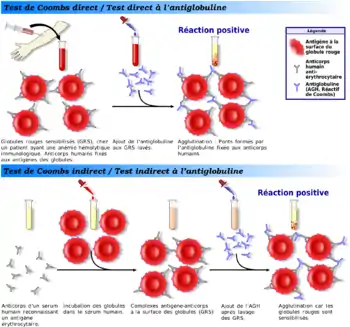
Cette réaction d’hémagglutination associe des antigènes particulaires et des anticorps peu ou non agglutinants. Il est donc nécessaire de favoriser l'agglutination, expliquée par deux théories, la théorie des ponts d'une part, et la baisse du potentiel zêta d'autre part, ou l'association des deux.
Il existe trois méthodes d'agglutination artificielle afin de réaliser cette réaction :
- ajout au milieu de macromolécules, telles que l'albumine, qui diminuent les forces de répulsion inter-globulaire par action sur le potentiel zêta, et favorisent l'agglutination par les anticorps incomplets IgG. (Exemple : détermination du groupe Rhésus sanguin) ;
- traitement par des enzymes protéolytiques, ce qui supprimera un certain nombre de charges électriques superficielles de la membrane (acide sialique en particulier, COO−) et diminuera les forces de répulsion. (ex. : recherche des agglutinines irrégulières (RAI) dans le dépistage de l'isoimmunisation sanguine fœto-maternelle) ;
- pontage ou baisse du potentiel zêta par des antiglobulines (2e anticorps spécifique du 1er) qui en se fixant l'anticorps humain spécifique de l'antigène érythrocytaire, permettent leur agglutination en diminuant le potentiel zêta et/ou réunissent des cellules voisines et augmentent la taille des réseaux, c'est le Test de Coombs, appelé maintenant test à l'antiglobuline dont 2 versions existent.
Inhibition de l'hémagglutination
Un grand nombre de virus possèdent des hémagglutinines sur leur enveloppe. Ils vont ainsi provoquer l'agglutination des globules rouges. La réaction d'inhibition de l'hémagglutination met en jeu un antigène viral et des anticorps antiviraux, dirigés contre cette hémagglutinine, et les récepteurs portés par les hématies. Dans cette réaction, les anticorps antiviraux protecteurs se fixent sur le virus et empêchent sa combinaison avec les récepteurs des hématies introduites dans le deuxième temps de la réaction. Si les anticorps reconnaissent leur antigène, le complexe immun formé neutralise la capacité hémagglutinante du virus et on aboutit à une hémagglutination négative. Dans le cas où les anticorps ne correspondent pas au virus isolé, le complexe immun ne se forme pas et le virus peut induire une hémagglutination.
ex. : recherche de βHCG, sérodiagnostic de la rubéole ou de la rougeole.
Le terme d'inhibition de l'agglutination est souvent utilisé en immuno-hématologie. Cette technique permet de mettre en évidence un antigène soluble présent dans un liquide biologique, plasma ou sérum, salive, sperme, lait…
Il peut s'agir soit d'un antigène de groupe sanguin présent sur les globules rouges tests humains, soit d'un antigène qui y a été fixé, de façon spécifique, immunoglobuline, parfois non spécifique.
Cette technique a permis de mettre en évidence la présence de substances de groupe ABO, Lewis dans la salive de sujets secréteurs, grâce à des érythrocytes de groupe connu.
Cette technique a également permis de découvrir les divers allotypes d'immunoglobulines G at A, grâce à la technique d'inhibition d'antiglobuline. Il s'agit des systèmes Gm, km et Am. Le principe est décrit dans discussion:Robin Coombs.
En médico-légal, cette technique maintenant largement dépassée, permettait de mettre en évidence l'origine humaine (ou simiesque -nous sommes cousins) d'un liquide biologique, sang, sperme… par inhibition d'une antiglobuline reconnaissant les immunoglobulines humaines. Il s'agissait de l'inhibition d'un test à l'antiglobuline, en pouvant même en déterminer les phénotypes Gm.
Notes et références
Voir aussi
Bibliographie
- Jacques Béraud, Le technicien d'analyses biologiques : guide théorique et pratique, Éditions TEC & DOC, Tours, 2001 (ISBN 2-7430-0404-5)
- T. Kindt, R. Goldsby, B. Osborne (traduit de l'anglais par C. Fridman), Immunologie : le cours de Janis Kuby, Dunod, Paris, 2008 (6e édition) (ISBN 978-2-10-051242-3)
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressource relative à la santé :
- Portail de la biologie cellulaire et moléculaire
- Portail de l’hématologie