Acide chlorique
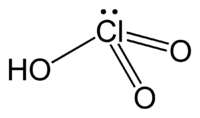
L'acide chlorique est un composé chimique de formule brute HClO3. C'est un oxydant fort et un oxoacide de chlore, dont la base conjuguée est l'ion chlorate ClO3−.
| Acide chlorique | |
| |
| Identification | |
|---|---|
| Nom UICPA | acide chlorique chlorate d'hydrogène |
| No CAS | |
| No ECHA | 100.029.303 |
| No CE | 232-233-0 |
| ChEBI | 17322 |
| SMILES | |
| InChI | |
| Apparence | solution incolore |
| Propriétés chimiques | |
| Formule | HClO3 [Isomères] |
| Masse molaire[1] | 84,459 ± 0,003 g/mol H 1,19 %, Cl 41,98 %, O 56,83 %, |
| Propriétés physiques | |
| Solubilité | >400 g·l-1 (eau,20 °C) |
| Précautions | |
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
L'acide chlorique est stable à froid en solution aqueuse jusqu'à une concentration molaire d'environ 30 %, et des solutions concentrées jusqu'à 40 % peuvent être préparées par évaporation contrôlée à pression réduite. À chaud ou à des concentrations plus élevées, l'acide chlorique se décompose de multiples façons, par exemple :
L'acide chlorique n'est en fait jamais thermodynamiquement stable face à sa dismutation en ions chlorure Cl− et perchlorate ClO4− suivant la réaction :
mais cette réaction est plutôt lente. En présence de réducteurs, il peut donner des vapeurs toxiques de dioxyde de chlore ClO2.
Synthèse
On prépare l'acide chlorique en faisant réagir du chlorate de baryum Ba(ClO3)2 avec de l'acide sulfurique H2SO4, le sulfate de baryum qui se forme au cours de cette réaction précipitant dans la solution :
Une autre méthode consiste à chauffer de l'acide hypochloreux HClO, ce qui donne de l'acide chlorique en libérant du chlorure d'hydrogène HCl :
Il se forme également de l'acide chlorique par réaction de l'acide sulfurique sur le chlorate de potassium KClO3 lors de la combustion du sucre avec ces deux derniers composés.
Utilisations
On utilise surtout des sels de l'acide chlorique ; par exemple :
- Le chlorate de potassium KClO3 est utilisé comme herbicide total, en particulier pour obtenir des allées de terre sans aucune herbe. Néanmoins, en raison de son caractère fortement oxydant, il n'est distribué de nos jours qu'en petites quantités et mélangé à d'autres produits. Il sert aussi de transporteur d'oxygène dans les allumettes et les dispositifs pyrotechniques.
- Le « chlorate de soude » ou chlorate de sodium NaClO3 est utilisé principalement pour la génération du dioxyde de chlore ClO2, un oxydant puissant utilisé pour le blanchiment de la pâte à papier et comme herbicide domestique. Ajoutés au chlorate de sodium, les sels de vanadium renforcent son action herbicide, alors qu'ils sont aussi utilisés en agriculture comme oligo-éléments fertilisants.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Chloric acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 12 avril 2011 (JavaScript nécessaire)
