Acide iodique
L'acide iodique est un composé chimique de formule brute HIO3. C'est un oxoacide d'iode dont la base conjuguée est l'anion iodate IO3−. Il contient un atome d'iode à l'état d'oxydation +5 et est l'un des oxoacides d'halogène les plus stables.
| Acide iodique | |||
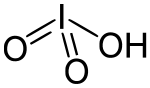 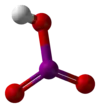 Molécule d'acide iodique |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | acide iodique iodate d'hydrogène |
||
| No CAS | |||
| No ECHA | 100.029.056 | ||
| No CE | 231-962-1 | ||
| PubChem | 24345 | ||
| ChEBI | 24857 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide blanc | ||
| Propriétés chimiques | |||
| Formule | HIO3 [Isomères] |
||
| Masse molaire[1] | 175,910 6 ± 0,001 g/mol H 0,57 %, I 72,14 %, O 27,29 %, |
||
| pKa | 0,75 | ||
| Propriétés physiques | |||
| T° fusion | 110 °C | ||
| Solubilité | 2 690 g·l-1 (eau, 20 °C) | ||
| Masse volumique | 4,62 solide | ||
| Précautions | |||
| SGH[2] | |||
  Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Propriétés chimiques
L'acide iodique est un oxydant fort très soluble dans l'eau mais, contrairement à ses homologues HClO3 et HBrO3, il peut également être isolé à l'état pur.
Il se déshydrate en pentoxyde d'iode I2O5 par chauffage contrôlé, puis se décompose par chauffage plus poussé en un mélange d'iode I2, d'oxygène O2 et d'oxydes d'iode inférieurs.
On peut le préparer en oxydant de l'iode avec des oxydants forts tels que l'acide nitrique HNO3, le chlore Cl2, l'acide chlorique HClO3 ou le peroxyde d'hydrogène H2O2[3], par exemple :
Dans cette réaction, l'acide chlorhydrique doit être éliminé au fur et à mesure afin de ne pas renverser l'équilibre en réduisant l'acide iodique nouvellement formé, ce qu'on peut réaliser par exemple avec de l'oxyde de mercure HgO.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Arnold F. Holleman, Nils Wiberg, « Lehrbuch der Anorganischen Chemie », 102e édition, Berlin, 2007. (ISBN 978-3-11-017770-1)
