Herpès néonatal
L' herpès néonatal désigne l'infection du nouveau-né par le virus de l'herpès. C'est une infection rare (2 à 3 cas pour 100 000 naissances en France), mais à mortalité et morbidité élevées, et suivie d'importants risques de séquelles[1].
| Type | Virus |
|---|---|
| Groupe | |
| Famille | Herpesviridae |
| Sous-famille | Alphaherpesvirinae |
| Genre | Simplexvirus |
Virus Herpes Simplex 2 (HSV-2)
— auteur incomplet —, date à préciser
L'herpès néonatal est du à une transmission « verticale » du virus de l'herpès, de la mère au nouveau-né. La contagion se fait presque toujours au moment de l'accouchement, mais il existe de très rares cas de contamination in utero.
Les symptômes apparaissent généralement 5 à 15 jours après la naissance[2].
Le diagnostic repose sur l'analyse clinique et biologique. Pour un nouveau né suspect d’être infecté par le virus, le traitement (Aciclovir intraveineux), est maintenant prescrit sans attendre les résultats des prélèvements[3]) pour une durée précisée par le pédiatre au vu de la gravité de la maladie lors du diagnostic.
Si en fin de grossesse la femme enceinte présente les symptômes d’un herpès (surtout s’il s’agit du sérotype HSV-2) ou si elle a présenté ces symptômes lors du troisième trimestre de sa grossesse (et plus encore s’il s’agit d’une primo-infection) alors une césarienne est pratiquée. Elle vise à préventivement empêcher le nouveau-né d'acquérir une infection à HSV lors de l'accouchement[4]. C’est en effet lors du « travail » que le nouveau-né risque le plus d’être contaminé par les virus, s'ils sont excrété par la mère à ce moment (c'est souvent le cas si la mère a contracté le virus durant le troisième trimestre de grossesse[4]).
On a estimé qu'aux États-Unis la prévention de l'infection par le partenaire masculin aux femmes enceintes "à risque" pourrait réduire l'incidence de l'herpès néonatal de 60% à 80% et fortement réduire les cas les plus graves (liés à des primo-infections lors du 3e trimestre de la grossesse)[5]. L'utilisation du préservatif, même si elle ne représente pas à elle seule un moyen de protection efficace pour prévenir l'infection[6], lorsqu'elle est combinée à une thérapie antivirale réduit le risque sans pour autant le supprimer.
Prévalence
Elle est à notamment relier aux cas de premières infections par l'herpes génital (l'une des Infections sexuellement transmissibles (IST) les plus fréquentes dans le monde, dont l'incidence générale aux États-Unis est estimée entre 1 et 2 millions de nouveaux cas annuels, pour une prévalence de près de 30 %chez les 30-40 ans [7].
La prévalence de l'herpès génital serait dans le monde d'environ 22 % chez les femmes enceintes, sans qu'elles en soient généralement informée[8].
Au Canada, le taux rectifié selon l’âge de séropositivité pour HSV-2 était de 17 % (pour une plage de valeurs s’étendant de 7 % à 28 %)[9] et selon les données de surveillance de l’infection néonatale aux HSV, il y aurait dans le pays 6 cas sur 100 000 naissances vivantes[10]
Mais une enquête sérologique transversale conduite au sein d'une communauté socio-économiquement défavorisées de 155 inuits et 11 caucasiens isolés au nord du Canada a mis en évidence une prévalence de 100% pour le virus de l'herpès simplex (dès l'âge de six ans)[11]. Une autre étude a montré que les enfants inuits sont pour la plupart contaminés très tôt par le virus (entre le 4e et le 13e mois de leur vie)[12]. Les populations autochtones danoises du Groenland semblent nettement moins touchées[13].
Aux États-Unis où cette infection n'est pas une maladie à déclaration obligatoire au niveau national, on estime que de 20 à 30 % des femmes enceintes auraient des anticorps anti-HSV–2[14]. Dans ce pays, environ 1 bébé sur 3500 babies en serait victime[15]
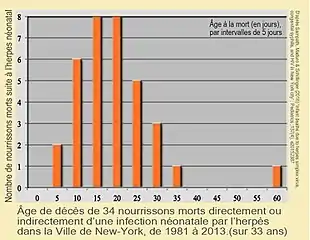
Selon une étude récente (2016) à New York 34 nouveau-nés en sont morts en 33 ans (de 1981 à 2013), soit 0,82 décès pour 100 000 naissances vivantes, à comparer à 38 décès par syphilis congénitale (0,92 pour 100 000) ou aux 262 décès causés par le VIH (6,33 pour 100 000) dans le même temps. Cependant alors que les décès de nourrissons par SC sont en recul (aucun cas entre 1996 et 2015) de même que pour le VIH (un seul décès infantile entre 2004 et 2015), le taux de mortalité néonatale lié au VHS a significativement augmenté durant la décennie (2004-2013) par rapport aux années antérieures[16]. Le taux de mortalité diminue (il était de 85% pour les cas non-traités par antiviraux il y a quelques décennies et est de 25% au début du XXIe siècle[réf. nécessaire].
En France l'herpès néonatal est une manifestation herpétique rare puisqu’en 2002 la prévalence était estimée à 2,7 cas pour 100 000 naissances vers 2010 (20 cas par an pour le pays est le chiffre retenu par la HAS en 2016)[17].
L’incidence des cas néonataux semble significativement varier selon les pays (de 1 à 14 pour 100 000 naissances vivantes [18],[19], et très majoritairement (75 % environ des cas, 64 à 73% des cas selon melinda Bénard (2010) et 85% des cas neurologiques[20]) attribués au HSV-2 (et 25 % à HSV-1)[10].
Cette maladie reste rare, mais sa fréquence semble en légère augmentation[16] tout comme celle du Zona du nourrisson (du au virus de l'Herpès Zoster) selon Thomas & Williams (2014)[21]
Transmission
Elle est :
- « verticale » (c'est-à-dire de mère à enfant) et directe, se réalisant lors de l'accouchement dans environ 90 % des cas [on parle de « Contamination per partum » dans ce cas] [22]. ;
- « verticale » et « anténatale » (c'est-à-dire acquise in utero, via le placenta suppose-t-on[23]) ; Edwards & al (2015) ont recherché (et effectivement trouvé) des signes histopathologiques de présence du virus de l'herpès dans le placenta, dans le liquide amniotique et dans le cordon ombilical, alors même que dans ce cas l'enfant semblait à la naissance en bonne santé, avant qu'il ne développe les signes de la maladie.
L'herpès néonatal acquis in utero est la forme la plus rare de la maladie : elle ne concerne qu'environ 3 % des cas selon une estimation française de 2016[22] et dans 5 % des cas selon Pichler & al. en 2015 (ces auteurs ajoutent que la littérature médicale n'en avait décrit que 64 cas avant 2014, dont 90 % avaient été causé par le type HSV-2 du virus[24]) ; - postnatale dans 5 à 10 % des cas[22].
Incubation
L'incubation varie selon le virus et l'état du système immunitaire du bébé : de 2 jours à 3 semaines [22].
Manifestations cliniques
Elles apparaissent 2 jours à 3 semaines après l’infection (et plus souvent au sixième jour)[22].
Les trois formes de l'herpès néonatal
Herpès néonatal (et pronostic)
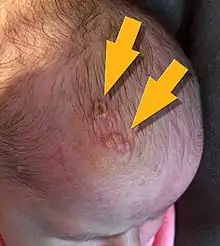
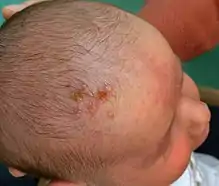
Trois formes principales sont généralement distinguées, dites « disséminée », « neurologique » ou « localisée »[1],[18].
- Forme disséminée (25 % des cas). Cette forme est plus fréquente chez le prématuré. Elle touche divers organes (dont cerveau, poumon, foie, cœur, glandes surrénales et peau) et se déclare dans les 7 premiers jours de vie. Elle est presque toujours induite par une primo-infection maternelle.
Son allure est septicémique (avec ou sans atteinte du système nerveux central). Les symptômes surviennent souvent chez le nourrisson en fin de sa première semaine de vie ; ce sont d’abord des troubles de l'alimentation (avec vomissements), fièvre et d’éventuelles convulsions. L’évolution est ensuite rapide avec une défaillance hépatique se manifestant par un ictère (avec ou sans « gros foie ») et par une défaillance multi–viscérale. Sans traitement adéquat, l’atteinte cardiovasculaire et un syndrome hémorragique se concluent par la mort du nourrisson dans 80 à 90 % des cas.
Même avec le meilleur traitement antiviral 30 % des bébés atteints mourront et 17 % de ceux qui survivent conserveront des séquelles neurologiques[1]. - Forme « neurologique » ou « encéphalitique », localisée au système nerveux central (45 % des cas) : elle se déclare plus tardivement dans les 16 à 19 premiers jours de vie, avec une manifestation principale : la méningo–encéphalite (qui se traduit par des troubles du comportement et des convulsions, souvent accompagnée d'une méningite lymphocytaire et des lésions cutanées sont également possibles.
L’analyse du LCS montre une augmentation modérée de l’albuminorachie.
14 % des nouveau-nés touchés en meurent[22]. Un antiviral approprié et prescrit aussi tôt que possible réduira la mortalité à 6 % des cas. Il réduira morbidité neurologique ; séquelles (à vie souvent) pour actuellement 70 % des cas[1]; - Forme « cutanéo-muqueuse », qui est localisée à la peau, aux muqueuses, et qui touche aussi les yeux et/ou à la bouche (30 % des cas), avec kératoconjonctivite, lésions ulcérées des muqueuses, lésions cutanées (vésiculeuses, érythémato-maculeuses)[22] : son pronostic est bien meilleur : le médicament antiviral approprié diminue la morbidité neurologique et/ou oculaire qui tombe à moins de 2 % des nouveau-nés)[1].
Risques et conséquences pour le nouveau-né infecté
La maladie est rare, mais la mortalité et la morbidité sont élevées[1] .
- L'infection herpétique dite Forme « cutanéo-muqueuse » peut toucher la peau, les yeux et/ou la bouche du nouveau-né ; elle est rarement mortelle ;
- Les formes dites disséminée et neurologique (ciblant le système nerveux central) ont (si elles ne sont pas traitées - voir infra Le traitement de l'herpès néonatal) un taux de mortalité de 80 %, mais la plupart des nourrissons survivants conserveront des séquelles neurologiques à vie[4].
Herpès congénital
C'est l'étiologie la plus rare (3 % des cas environ). Le virus de l'herpès s'est alors développé dans l'embryon et/ou le foetus[25],[26], il est donc dit « congénital » chez le nouveau-né.
La maladie est alors consécutive à une primo-infection survenue chez la mère en début de grossesse. Une hypothèse non-démontrée à ce jour est que le virus pourrait aussi parfois être introduit avec les spermatozoïdes (car dès les années 1990 de l'ADN du virus Herpes simplex a été détecté dans le sperme[27], dans un peu plus de 3 % d'échantillons de sperme, et la plupart des échantillons positifs avaient été recueillis au moment d'une crise d'herpès (récurrence) ; Et on a montré qu'un traitement par acyclovir semble supprimer les traces du virus dans le sperme[28]. De plus, chez des hommes venant consulter pour infertilité, l'ADN du virus était détecté dans 49,5 % des cas par N Kapranos & al (2003)[29]. Une autre hypothèse non démontrée est que le virus pourrait aussi parfois contaminer l'ovule).
Les manifestations en sont l'encéphalite[30], a microcéphalie, des calcifications intra-crâniennes, des cicatrices cutanées, une choriorétinite. Dans un cas le corps calleux (qui réunit les deux hémisphères cérébraux était absent à la naissance[31]. Underwood dite en 2012 un cas d'hyperleucocytose chez un prématuré (né à la 29e semaine de gestation) porteur d'un herpès néonatal, avec encéphalite et encéphalomalacie (c'est-à-dire un infarctus du cerveau)[32].
Facteurs de risques
L'absence totale de signes d'herpès chez la mère ou le couple ne garantit pas l'absence de risque : 70 % des nourrissons infectés sont nés de femmes asymptomatiques à l'accouchement et n'ayant pas d'antécédents repérés d'herpès génital[33], et les cas les plus graves proviennent souvent de primo-infections ayant eu lieu en fin de grossesse[5].
À titre indicatif pour les États-Unis, il a été statistiquement constaté que le risqué d'herpès neonatal (à HSV-1) augmente dans ce pays chez les enfants issus de classes socio-économiques défavorisées[5], de femmes blanches d'origine non-hispanique[34], pour les femmes âgées de moins de 25 ans au moment de la maternité, pour une infection herpétique ayant eu lieu lors du troisième trimestre de grossesse [35], en cas de première grossesse, de séronégativité HSV (1&2) [36],[37], discordant partner[5], gestation de moins 38 semaines[35] et de sexe oral au troisième trimestre[38].
Concernant le HSV-2, des facteurs de risques maternels sont pour les États-Unis le faire partie de la population noire[39] d’être âgée de moins de 21 ans lors de la grossesse[36],[35], d’avoir eu 4 partenaires sexuels ou plus[39], d’avoir eu une primo-infection ou une récurrence d’infection durant le 3e trimestre de grossesse[40], d’avoir un faible niveau d’éducation[39] d’avoir des antécédents d’infections sexuellement transmissibles, et de fausse couche, d’être en situation de première grossesse viable, d’avoir une gestation interrompue avant 38 semaines[36],[35].
Diagnostic
Hormis dans le cas d'un Herpès congénital, au moment de la naissance le nouveau-né infecté semble généralement en parfaite santé ; les signes de la maladie n'apparaitront généralement que dans les 5 à 15 jours qui suivent[2],[18].
Ces signes doivent alerter aussi vite que possible, car la précocité de la prise en charge par un service d’urgence pédiatrique sera décisive pour la santé et survie du nouveau–né (sachant que même avec un traitement précoce, certains nourrissons développent quand même une infection disséminée ou des complications du système nerveux central[4]).
Dans un cas sur deux environ, la naissance est prématuré (à 38 semaines ou moins), ce qui complique les soins ; et dans un quart des cas un autre sepsis est constaté, qui parfois retarde aussi le diagnostic rapide de l’herpès[réf. nécessaire].
Une difficulté est que quand (et tant que) les lésions cutanées caractéristiques de l'herpès sont absentes, les signes du début de l’infection ne sont pas spécifiques. Or, ces lésions, qui sont le symptôme le plus évocateur, manquent dans 14 % des formes localisées, dans 37 % des formes neurologiques et dans 42 % des formes disséminées[18].
De plus comme il est très fréquent que la mère n'ait jamais eu connaissance du fait qu’elle était porteuse du virus, ou que sa primo-infection était asymptomatique lors de l'accouchement (70 % des cas) le diagnostic est souvent « retardé » [2],[18].
Ces signes sont ensuite externes (vésicules cutanées, œil rouge ou larmoyant, ictère ne diminuant pas, saignement du nez, de la bouche ou de l'anus) ; et/ou comportementaux (perte d’appétit, somnolence excessive, hyporéactivité ou au contraire irritabilité, sursauts très fréquents non causés par des bruits, et/ou convulsions) ; ou internes (fièvre dépassant 37,8 °C et syndrome fébrile sans cause bactérienne apparente, avec troubles neurologiques ; présents dans 47 % des cas : troubles de la conscience, crises de convulsions, c'est-à-dire séquences rythmées de d’un ou plusieurs membres, parfois accompagnées d'une révulsion des yeux vers le haut ou vers le bas), insuffisance hépatique et/ou pneumonie [22]. La fontanelle est parfois enflée (dans 10 % des cas environ[41],[36]).
L’herpès néonatal doit être évoqué devant tout cas de fièvre isolée ou de cytolyse inexpliquée, en tenant compte du fait que les antécédents maternels sont la plupart du temps méconnus, y compris de la patiente elle-même et de son entourage[22].
Le pédiatre cherchera à savoir s'il s'agit pour la mère d'une primo-infection (PI). En effet, ce cas est plus préoccupant car il est caractérisé par l’excrétion de virions contaminants durant 14 jours en moyenne (et jusqu’à 20 jours parfois) alors que les crises d’herpès récurrentes qui surviendront ensuite ne dureront que 2 à 3 jours[22].
De premiers symptômes décalés après la naissance justifient un diagnostic génomique urgent par PCR sang (1 ml sur tube EDTA) + liquide céphalorachidien (LCR ; 10 gouttes ; sensibilité 90 %) en demandant au labo un retour rapide (moins de 24h en jour ouvré) [22]. Ce mode d’analyse est couteux mais considéré comme le meilleur par la haute autorité de santé en 2016[22],[17].
Lors d'une étude (2005) concernant Seattle seuls 47 % des partenaires masculins de femmes enceintes avaient consenti à être testés pour l'herpès et quatre d'entre elles avaient contracté un herpès dont les anticorps ne correspondaient pas à ceux de leurs partenaires testés (suggérant une autre source, un problème social compliquant la gestion des maladies sexuellement transmissibles)[5].
En 2014, en France l’Assurance maladie a proposé[17],[42] de modifier la liste des actes de biologie médicale remboursés dans le champ de la transmission mère - enfant pour ce qui concerne les tests de diagnostic d’infections par les virus herpe s simplex (types 1 et 2, aussi dénommés HSV-1/-2) ainsi qu’un virus de la même famille (Herpesviridae) : celui de la varicelle/zona (varicella zoster virus, VZV). L’Assurance maladie proposait alors d’uniquement rechercher l’ADN viral par PCR en abandonnant le diagnostic immunologique direct et la culture orientée et d’autres modifications concernant l’inscription, la suppression ou la restriction de recherches sérologiques. La HAS a donné un avis favorable à la plupart des propositions faites par l’Assurance maladie[17].
La PCR et donc maintenant recommandée (et remboursée) pour tester la présence de virus sur les lésions génitales chez la mère à l’accouchement, et chez le nouveau - né, en cas de situation à risque d’herpès néonatal[17]:
- sur les muqueuses (conjonctives, oropharynx, fosses nasales)
- sur des lésions cutanées situées dans le liquide cérébrospinal et le sang (mais uniquement chez les nouveau-nés présentant des signes de suspicion diagnostique d’herpès néonatal, d’origine clinique (enfant symptomatique) et/ou biologique (résultat de prélèvement cutanéo-muqueux positif) [17],
- dans les conditions suivantes :
- respect d’un délai minimum de 24h après la naissance, préalablement à la réalisation des prélèvements
- Diagnostic biologique des infections HSV et VZV dans le cadre mère-enfant
Un même écouvillon doit être utilisé sur les différentes muqueuses pour encore améliorer la sensibilité de la détection virale[17] ; l’écouvillonnage portera sur l’œil, l’intérieur du nez, le pharynx. L’écouvillon sera laissé dans le tube et son milieu de transport pour virus).
Une recherche des IgG anti-HSV-1 et anti-HSV-2 spécifiques de type (visant à déterminer le sous-type viral en cause (1 ou 2), est recommandée dans le contexte d’un premier épisode d’herpès génital connu lors de la grossesse ou de l’accouchement, pour savoir s’il s’agit d’une primo-infection ou d’une récurrence ; connaitre le sérotype du HSV en cause dans ces lésions est en effet important pour interprétation les résultats de cette recherche[17] ;
La nomenclature des actes de biologie médicale (NABM) exclut désormais[17] :
- les tests de diagnostic immunologique direct des HSV
- la culture cellulaire orientée et la culture non orientée (CNO) antérieurement aussi utilisée pour l’identification virale (la CNO restant toutefois utile et nécessaire pour les antivirogramme, qui sont des examens non remboursés),
- la recherche des IgM anti-HSV-1/ -2 non spécifiques de type pour le diagnostic de primo - infection HSV chez la femme enceinte,
- la recherche des IgG anti-HSV- 1/ -2 non spécifiques de type chez la femme enceinte,
- la recherche des IgM et IgG anti-HSV- 1/ -2 non spécifiques de type chez le nouveau-né ;
Le traitement de l’herpès néonatal
Remarque : ci-dessous les posologies ne sont données qu'à titre indicatif. C'est au médecin de la fixer au cas par cas
- Préventivement pour la future mère présentant un développement initial (c'est-à-dire sans antécédents connus) d'herpès génital lors de la grossesse, une prophylaxie antivirale est recommandée à partir de 36 semaines d'aménorrhée.
Le médicament sera l’aciclovir (400 mg × 3 par jour ou 200 mg × 5 par jour[43]) ou le valaciclovir (500 mg × 2 par jour ou 1 000 mg × 2 par jour[43]) pendant 5 à 10 jours.
S’il s’agit d’« une récurrence herpétique survenue en cours de grossesse, un traitement par aciclovir (200 mg × 5 par jour) ou valaciclovir (500 mg × 2 par jour) » est prescrit[43]. En 2017, aucune preuve formelle ne montre que ces médicaments peuvent diminuer le risque d’herpès néonatal (en cas d’herpès génital pendant la grossesse) mais ils peuvent contribuer à limiter l’importance des symptômes et le risque de récurrence à terme (et le taux de césariennes réalisées pour lésions herpétiques).
La césarienne est pratiquée en cas de suspicion d’épisode initial d’herpès génital au moment du travail ou en cas de rupture de la poche des eaux à terme ou en cas d’épisode initial d’herpès génital survenu moins de 6 semaines avant l’accouchement. Si cet épisode initial a été découvert en post-partum (après accouchement) le pédiatre doit être prévenu et la patiente pourra recevoir le traitement préconisé ci-dessus.
- Chez le nouveau né c’est l'Aciclovir intraveineux qui est utilisé
- Posologie :
- 60 mg/kg/j (= forte dose, répartie en 3 injections[43]
- Durée :
- 14 jours pour la forme cutanéomuqueuse[43],
- 21 jours pour les autres formes) (Accord professionnel)[43].
Parfois un système d'oxygénation par membrane extra-corporelle doit être mis en place pour la survie du nourrisson. L traitement a pu, dans un cas au moins être adapté à ce système[44]
Prévention
Outre la prévention générale des MST et de toutes les formes d’herpès, une surveillance attentive du statut sérologique de la mère durant la grossesse, mais aussi de son (ses) partenaire(s) sexuel(s) permet de mieux évaluer le risque d'infection et de ses conséquences [4]. « Les femmes chez lesquelles la présence d’une infection génitale récurrente au virus de l’herpès simplex (VHS) est connue devraient être avisées des risques de transmission (au moment de l’accouchement) du VHS à leur nouveau-né »[45] et les femmes enceintes sans antécédents d’infection au VHS, mais ayant connu un(e) partenaire porteur(porteuse) d'une infection génitale au VHS devraient avant leur grossesse (ou tôt durant la grossesse) bénéficier d'un dépistage sérologique spécifique de type pour évaluer leurs risques, dépistage à répéter de la 32e à la 34e semaine de gestation[45]. Si elle n’a pas déjà été faite, une sérologie VIH est recommandée, car le VIH aggrave l’infection par l’herpes et l’excrétion de virus, ce qui accroit le risque de contamination du nouveau-né lors de l’accouchement[46]. En cas de récurrence herpétique lors de l’accouchement (c'est-à-dire en cas de nouvelle crise d’herpès survenant chez une femme en ayant déjà eu avant sa grossesse), le risque d’herpès néonatal est estimé faible (environ 1 % des cas) . Il existe un accord professionnel depuis 2016 sur le fait qu’une prophylaxie antivirale doit dans ce cas être proposée aux femmes (pour toute récurrence herpétique en cours de grossesse, à partir de 36 SA et jusqu’à l’accouchement)[47]. Par contre ce traitement ne semble apporter aucun bénéfice prophylactique aux femmes ayant un antécédent d’herpès génital connu mais pour lesquelles la dernière crise herpétique de récurrence s’est produite avant la grossesse ; Dans ce contexte, au début du « travail » (d’accouchement) le médecin ne pratiquera un prélèvement que s’il observe une lésion de type herpétique[47].
« En cas de récurrence herpétique en début de travail, une césarienne sera d’autant plus à considérer que les membranes sont intactes, et/ou en cas de prématurité et/ou de séropositivité au VIH (Accord professionnel). En revanche, un accouchement par voie vaginale sera d’autant plus à considérer qu’il existe une rupture des membranes prolongée, après 37 SA et en l’absence de séropositivité au VIH (Accord professionnel) » [47].
Les cultures virales hebdomadaires ne sont néanmoins plus recommandées chez les femmes enceintes présentant un herpès génital confirmé car délicates, n’étant plus faites en routine, longues (résultat en 2 à 15 jours) et coûteuses pour les systèmes de sécurité sociale et enfin parce qu’elles ne prédisent pas le risque d'acquisition du VHS à l'accouchement.
Elles permettent néanmoins le sous-typage de la souche à partir d’un échantillon, provenant d’une lésion fraiche ou d’une muqueuse (œil, nez, pharynx) [22].
En amont (avant les grossesses) l’utilisation du préservatif (masculin ou féminin), s'il diminue faiblement le risque d’infection initiale[48], ne représente pas à lui seul un moyen de protection efficace. Les femmes sensibles et à haut risque devraient être encouragées à l'abstinence sexuelle et à éviter les contacts oraux-génitaux non protégés avant la grossesse et durant le temps de périnatalité[4].
Si l’herpès est diagnostiqué peu avant l’accouchement ;
- Le traitement de la future mère diminue significativement le risque de récurrence à l’accouchement ainsi que l’excrétion de virions au moment de l’accouchement… Il diminue donc les risques pour l’enfant de contracter le virus lors d’une naissance par la voie naturelle (vaginale) [20];
- la césarienne peut réduire la transmission de l'herpès néonatal. Elle est justifiée chez les femmes qui excrètent le VHS au moment de l'accouchement. Un traitement antiviral maternel est envisagé au vu des bénéfices potentiels pour la mère et le fœtus[4].
La surveillance fœtale invasive est à éviter, car elle peut augmenter le risque d'herpès néonatal (Selon Brown, elle devrait être réservée aux femmes séropositives au HSV-2 et uniquement pour des indications obstétricales définies) [4].
D’éventuelles infections primaires asymptomatiques peuvent être recherchées par identification rapide de l'antigène viral génital lors de l'accouchement
En cas d'herpès maternel effectif en fin de grossesse ou à l'accouchement, afin d’éviter une contamination indirecte après une naissance qui n’a pas contaminé le nouveau-né, une bonne prise en charge du couple mère-nourrisson est à prévoir, en tenant compte du partenaire sexuel de la mère ou de la fratrie de l’enfant le cas échéant[49].
Soins et précautions post-grossesse
Les parents et l’entourage doivent recevoir des recommandations et explications sur les signes cliniques à surveiller, et sur les précautions à prendre. Il a été constaté que les lésions pouvaient apparaitre préférentiellement sur des zones de la peau ou du cuir chevelu du nouveau-né qui ont été traumatisées (par exemple par des forceps ou par la pose d'électrodes de monitoring sur le crâne du fœtus[50]), ces zones si elles existent doivent être surveillées.
La prescription médicamenteuse et de soins doit être respectée durant le temps imparti (pour le nouveau-né comme pour la mère).
Des précautions supplémentaires d’hygiène sont à prendre par la mère (le père ou la fratrie) en cas de récidive herpétique post-partum (après l’accouchement)
L’allaitement maternel, qui contribue à l’immunité et à la maturation du système immunitaire du bébé, n’est aucunement contre-indiqué (sauf si des lésions herpétiques sont présentes au niveau des seins[22].
Les semaines suivant le retour au domicile certains facteurs de stress doivent être évités pour le bébé (ex : refroidissement, toute blessures ou microtraumatisme de la peau (pose d'électrodes sur le cuir chevelu[50]) et donc la circoncision[22],[50]).
Recherche
Au début des années 2000 la recherche portait notamment sur des tests sérologiques spécifiques pour la femme enceinte et son partenaire sexuel, sur de nouveaux traitements topiques génitaux, la vaccination des femmes à risque, les anticorps monoclonaux, de nouveaux antiviraux (à mécanismes non-dépendants de la thymidine kinase virale)…
On cherche aussi à mieux comprendre l’impact des infections herpétiques pendant la grossesse sur la femme et/ou le fœtus et/ou le nouveau-né, dont en France[48], ainsi qu’à expliquer la forte discordance qui existe entre la prévalence de l’excrétion herpétique au moment de l’accouchement et la rareté des infections néonatale[48].
En France un « Centre national de référence cytomégalovirus » (CNR cytomégalovirus) est chargé du suivi des virus de l'herpès (HSV-1, HSV-2) et de la varicelle/zona[17].
Notes et références
- RCOG (2014) Management of Genital Herpes in Pregnancy| Royal College of Obstetricians and Gynaecologists. London
- Rozenberg F (2002) « Signification et limites des moyens diagnostiques fondés sur la PCR dans l'herpès oro-facial, génital, de la femme enceinte, du nouveau-né à risque »| Ann Dermatol Venereol|129(4 Pt 2)|617 24
- Renesme L (2017) Herpès néonatal : épidémiologie, manifestations cliniques et prise en charge. Recommandations pour la pratique clinique du Collège national des gynécologues et obstétriciens français (CNGOF). Gynécologie Obstétrique Fertilité & Sénologie, 45(12), 691-704|résumé.
- Brown Z (2004) « Preventing herpes simplex virus transmission to the neonate ».|Herpes. 11 aout 2004;11 Suppl 3:175A-186A
- Baker DA, « Risk factors for herpes simplex virus transmission to pregnant women: a couples study », Am. J. Obstet. Gynecol., vol. 193, no 6, , p. 1887–8 (PMID 16325587, DOI 10.1016/j.ajog.2005.08.007, lire en ligne)
- (en) Martin ET, Krantz E, Gottlieb SL. et al. « A pooled analysis of the effect of condoms in preventing HSV-2 acquisition » Arch Intern Med. 2009;169:1233-1240.
- Chiffres de l'OMS
- Pinninti S.G & Kimberlin D.W (2014) Preventing herpes simplex virus in the newborn. Clinics in perinatology, 41(4), 945-955.|URL:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4386734/
- Société des obstétriciens et gynécologues du Canada (2008). Directive clinique sur la prise en charge du virus de l’herpès simplex pendant la grossesse. J Obstet Gynaecol Can ;30(6):520-6
- Société canadienne de pédiatrie (2014) La prévention et la prise en charge des infections par le virus de l’herpès simplex. Ottawa: CPS;. http://www.cps.ca/fr/docume nts/position/prevention - prise - en - charge - infections - le - virus - herpes - simplex
- Nicolle L.E, Minuk G.Y, Postl B, Ling N, Madden D.L & Hoofnagle J.H (1986) Cross-sectional seroepidemiologic study of the prevalence of cytomegalovirus and herpes simplex virus infection in a Canadian Inuit (Eskimo) community. Scandinavian journal of infectious diseases, 18(1), 19-23.
- Culman K.N, Ward B.J, Pekeles G.S & Mills E.L (1999) Evidence of early acquisition of herpesviruses in Inuit infants compared to non-Inuit Canadian infants. Pediatric Research, 45, 159A-159A.résumé
- Kjaer, S. K., de Villiers, E. M., Haugaard, B. J., Christensen, R. B., Teisen, C., Møller, K. A., ... & Jensen, O. M. (1988). Human papillomavirus, herpes simplex virus and cervical cancer incidence in greenland and denmark. A population‐based cross‐sectional study. International journal of cancer, 41(4), 518-524|résumé.
- James SH, Sheffield JS, Kimberlin DW (2014) « Mother-to-Child Transmission of Herpes Simplex Virus ». J Pediatric Infect Dis Soc;3(Suppl 1):S 19-S23
- Bloomberg News (2009). "Neonatal herpes simplex". Boston Children's Hospital, 14 juillet 2009 (en).
- Sampath A, Maduro G & Schillinger J.A (2016) Infant deaths due to herpes simplex virus, congenital syphilis, and HIV in New York city|Pediatrics| 137(4), e20152387.
- Haute Autorité de santé / HAS (2016) Un argumentaire de la HAS sur le diagnostic des infections liées aux virus de l'herpès et de la varicelle , validé par le Collège de la Haute Autorité de santé en mai2016
- Aujard Y (2015). » Infections néonatales ». Paris: Elsevier Masson;
- Aujard Y (2002) « Modalités des traitements locaux et généraux, médicamenteux ou non, dans la prise en charge du nouveau-né suspect d'être infecté/contaminé par HSV1 ou HSV2 ». Ann Dermatol Venereol ;129(4 Pt 2):655 - 61.
- Bénard Mélinda (2010) Peut-on prévenir l’Herpès néonatal ? | GEN Midi-Pyrénées |19 mars |PDF, 71 pages
- Thomas E.A & Williams A (2014) Herpes zoster in a six month old infant: A case report. pediatric infectious disease, 6(4), 145-146.
- Réseau de périnatalité Méditerranée (2016) Protocole pédiatrique N°4 : Herpès néonatal |Version validée le 1er octobre 2016|Consulté le 14 janvier 2018| RPM/PR/REA.P/00/A ; PDF, 11p
- Edwards M.S, Popek E.J, Wise B, Hatzenbuehler L, Arunachalam A.R & Hair A.B (2015) Ascending in utero herpes simplex virus infection in an initially healthy-appearing premature infant. Pediatric and Developmental Pathology, 18(2), 155-158.
- Pichler & al. (2015) Premature newborns with fatal intrauterine herpes simplex virus‐1 infection: first report of twins and review of the literature. Journal of the European Academy of Dermatology and Venereology, 29(6), 1216-1220. résumé
- Hutto C, Arvin A, Jacobs R, Steele R, Stagno S, Lyrene R et al. (1987) Intrauterine herpes simplex virus infections. J Pediatr ; 110(1): 97–101.
- Baldwin S, Whitley RJ. (1989) Intrauterine herpes simplex virus infection. Teratology ; 39(1): 1–10.
- Kotronias D, Kapranos N (1998) Detection of herpes simplex virus DNA in human spermatozoa by in situ hybridization technique. In Vivo ; 12 : 391-4
- Wald A, Matson P, Ryncarz A & Corey L (1999) Detection of Herpes Simplex Virus DNA in Semen of Men With Genital HSV‐2 Infection. Sexually transmitted diseases, 26(1), 1-3|résumé.
- Kapranos, N., Petrakou, E., Anastasiadou, C., & Kotronias, D. (2003). Detection of herpes simplex virus, cytomegalovirus, and Epstein-Barr virus in the semen of men attending an infertility clinic. fertility and sterility, 79, 1566-1570.
- Kimberlin DW (2007) Management of HSV encephalitis in adults and neonates: diagnosis, prognosis and treatment. Herpes ; 14(1): 11–16
- Jayaram, PM, Wake, CR. (2010) A rare case of absent corpus callosum with severe ventriculomegaly due to congenital herpes simplex infection. J Obstet Gynaecol ;30:316
- Underwood, MA, Wartell, AE, Borghese, RA (2012). Hyperleukocytosis in a premature infant with intrauterine herpes simplex encephalitis. J Perinatol ;32:469–472
- Guidelines for perinatal care: Atlanta, GA: American Academy of Pediatrics and the American College of Obstetricians and Gynecologists; 2002. p. 292-7
- F. Xu, L. E. Markowitz, S. L. Gottlieb et S. M. Berman, « Seroprevalence of herpes simplex virus types 1 and 2 in pregnant women in the United States », Am. J. Obstet. Gynecol., vol. 196, no 1, , p. 43.e1–6 (PMID 17240228, DOI 10.1016/j.ajog.2006.07.051, lire en ligne)
- Whitley R, « Neonatal herpes simplex virus infection », Curr. Opin. Infect. Dis., vol. 17, no 3, , p. 243–6 (PMID 15166828, DOI 10.1097/00001432-200406000-00012)
- (en) Z.A. Brown, A. Wald, R.A. Morrow, S.Selke, J. Zeh et L. Corey, « Effect of serologic status and cesarean delivery on transmission rates of herpes simplex virus from mother to infant », Journal of the American Medical Association, no 289 (2), , p. 203-209 (PMID 12517231, DOI 10.1001/jama.289.2.203).
- Nahmias AJ, « Neonatal HSV infection Part II: Obstetric considerations -- a tale of hospitals in two cities (Seattle and Atlanta, USA) », Herpes, vol. 11, no 2, , p. 41–4 (PMID 15955267, lire en ligne)
- Nahmias AJ, « Neonatal HSV infection Part I: continuing challenges », Herpes, vol. 11, no 2, , p. 33–7 (PMID 15955265, lire en ligne)
- Mertz GJ, « Epidemiology of genital herpes infections », Infect. Dis. Clin. North Am., vol. 7, no 4, , p. 825–39 (PMID 8106731)
- C. Gardella, Z. A. Brown, A. Wald et al., « Poor correlation between genital lesions and detection of herpes simplex virus in women in labor », Obstetrics and gynecology, vol. 106, no 2, , p. 268–74 (PMID 16055574, DOI 10.1097/01.AOG.0000171102.07831.74)
- Toth C, Harder S & Yager J (2003) Neonatal herpes encephalitis: a case series and review of clinical presentation. Canadian journal of neurological sciences, 30(1), 36-40.
- Cette proposition s’inscrivait dans un projet plus large concernant la bactériologie et la virologie, réunis dans une demande déposée en juin 2014 par la CNAMTS. La partie virologie de cette demande portait aussi sur le cytomégalovirus dans d’autres contextes et sur les virus HSV-1/-2 et VZV également dans des contextes différents de celui de la périnatalité
- Sénat, M. V., Anselem, O., Picone, O., Renesme, L., Sananès, N., Vauloup-Fellous, C., ... & Sentilhes, L. (2017). Prévention et prise en charge de l’infection herpétique au cours de la grossesse et de l’accouchement: recommandations pour la pratique clinique–texte des recommandations (texte court). Gynécologie Obstétrique Fertilité & Sénologie, 45(12), 705-714|résumé
- Cies, J. J., Moore, W. S., Miller, K., Small, C., Carella, D., Conley, S., ... & Chopra, A. (2015). Therapeutic Drug Monitoring of Continuous‐Infusion Acylovir for Disseminated Herpes Simplex Virus Infection in a Neonate Receiving Concurrent Extracorporeal Life Support and Continuous Renal Replacement Therapy. Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy, 35(2), 229-233.
- Money D.M & Steben M (2017) No 208-Directive clinique sur la prise en charge du virus de l’herpès simplex pendant la grossesse. Journal of Obstetrics and Gynaecology Canada, 39(8), e192-e198./fulltext résumé
- Sananes, N. (2017). « Suspicion de lésion d’herpès génital chez une patiente enceinte sans antécédent connu d’herpès génital. Recommandations pour la pratique clinique du Collège national des gynécologues obstétriciens français (CNGOF) ». Gynécologie Obstétrique Fertilité & Sénologie, 45(12), 664-676 |résumé
- Anselem, O. (2017). « Suspicion de lésion d’herpès génital chez une femme enceinte ayant un antécédent d’herpès génital connu. Recommandations pour la pratique clinique du Collège national des gynécologues obstétriciens français (CNGOF) ». Gynécologie Obstétrique Fertilité & Sénologie, 45(12), 677-690.
- Picone, O. (2017). « Herpès génital et grossesse: épidémiologie, manifestations de la maladie, prévention et dépistage. Recommandations pour la pratique clinique du Collège national des gynécologues obstétriciens français (CNGOF) ». Gynécologie Obstétrique Fertilité & Sénologie, 45(12), 642-654 |résumé
- Henrot A (2002) [Mother-infant and indirect transmission of HSV infection: treatment and prevention] |Ann Dermatol Venereol avril 2002 ;129(4 Pt 2):533-49 |résumé (en anglais)
- Long SS, Pickering LK, Prober CG, eds. (1997) Herpes simplex virus. Churchhill Livingstone, New York. p. 1138.
Voir aussi
Bibliographie
- Allen UD, Robinson JL. (2014) La prévention et la prise en charge des infections par le virus de l’herpès simplex. Paediatr Child Health;19 : 207 –
- Aujard Y , Alain S, Faye A . (2015) Infections néonatales virales dans Infections néonatales . Elsevier Masson ed., p. 139 – 165
- Bénard Mélinda (2010) Peut-on prévenir l’Herpès néonatal ? | GEN Midi-Pyrénées | |PDF, 71 pages
- Guttierez KM, Whitley RJ, Arvin AM (2011) Herpes simplex virus infection. In: Remington JS, Klein JO, Wilson CB, editors. “Infections diseases of the fetus and the newborn infant”.7 th ed.Elsevier Saunders ed;, p. 813 - 33
- HAS (2016) « Diagnostic par détection virale et/ou sérologie des infections à virus herpes simplex et varicelle - zona dans le cadre mère-enfant ».
- Henrot, A. (2002). « Transmission materno-fœtale et indirecte de l'infection HSV, traitement et prévention ». In Annales de Dermatologie et de Vénéréologie (Vol. 129, No. 4-C2, p. 533–549) ; .
- Jones CA, Walker KS, Badawi N. (2009) Antiviral agents for treatment of herpes simplex virus infection in neonates.| Cochrane Database Syst Rev. ; (3):CD004206. Epub .
- Kimberlin DW, Baley J (2013) “Guidance on management of asymptomatic neonates born to women with active genital herpes lesions”. Pediatrics;131:e635 - 4 –
- Laboureau, J. P., Le Touze, P., Caldera, R., Lallemand, D., & Rossier, A. (1973). Les lésions œsophagiennes dans l'herpès néonatal. Ann Pediatr, 20, 335-340.
- Lopez - Medina E, Cantey JB, Sánchez PJ. (2015) The mortality of neonatal herpes simplex virus infection. J Pediatr. Juin;166(6):1529-32
- Makhlouf, S., Achour, N. B., Benrhouma, H., Rebai, I., Klaa, H., Kraoua, I., & Turki, I. (2017) Encéphalites limbiques auto-immunes post-herpétiques: un véritable challenge diagnostique. Revue Neurologique, 173, S159-S160|résumé.
- Málaga I, Roncero I, Santovena-Gonzalez L, Blanco-Lago R, Rekarte S, Armangué T & Dalmau J (2015) PP13. 2–3042: Infantile spasms in an infant with anti-NMDA receptor encephalitis secondary to HSV-1 encephalitis. European Journal of Paediatric Neurology, 19, S82|résumé.
- Olkhovska O.N, Kirsanova T.A, Zarkova T.S, Kucherenko E.O & Tatarkina A.N (2014). Herpes viral infections in children|Manuel pour étudiants en médecine |PDF|22 pages
- Pichler M, Staffler A, Bonometti N, Messner H, Deluca J, Thuile T, ... & Eisendle K (2015). Premature newborns with fatal intrauterine herpes simplex virus‐1 infection: first report of twins and review of the literature. Journal of the European Academy of Dermatology and Venereology, 29(6), 1216-1220|résumé.
- Réseau de périnatalité Méditerranée (2016) Protocole pédiatrique n°4 : Herpès néonatal Version validée le RPM/PR/REA.P/00/A ; PDF, 11p (à destination des pédiatres, avec une annexe pour la surveillance par les parents)
- Vauloup-Fellous C (2017). « Herpès génital et grossesse: outils du diagnostic virologique. Recommandations pour la pratique clinique du Collège national des gynécologues obstétriciens français » (CNGOF). Gynécologie Obstétrique Fertilité & Sénologie, 45(12), 655-663|résumé.
- Wilcox D.R, Wadhwani N.R, Longnecker R & Muller W.J (2015) Differential reliance on autophagy for protection from HSV encephalitis between newborns and adults. PLoS pathogens, 11(1), e1004580.
- Wilcox D.R, Muller W.J & Longnecker R (2015) HSV targeting of the host phosphatase PP1α is required for disseminated disease in the neonate and contributes to pathogenesis in the brain. Proceedings of the National Academy of Sciences, 112(50), E6937-E6944.
Articles connexes
- Portail de l'enfance
- Portail de la médecine
- Portail de la virologie
- Portail des maladies infectieuses