Hexachlorodisilane
L'hexachlorodisilane est un composé chimique de formule Si2Cl6. Il se présente comme un liquide incolore et transparent qui fume au contact de l'air et est sensible à l'hydrolyse[3]. Comme tous les perchlorosilanes SinCl2n+2 avec n compris entre 2 et 6, il peut être obtenu en faisant réagir du siliciure de calcium CaSi2 avec du chlore Cl2 entre 230 et 250 °C[3],[4] :
| Hexachlorodisilane | |||
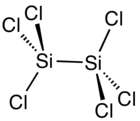
| |||
| Structure de l'hexachlorodisilane | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.033.353 | ||
| No CE | 236-704-1 | ||
| PubChem | 83497 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore[1] | ||
| Propriétés chimiques | |||
| Formule | Si2Cl6 | ||
| Masse molaire[2] | 268,889 ± 0,013 g/mol Cl 79,11 %, Si 20,89 %, |
||
| Propriétés physiques | |||
| T° ébullition | 144 à 145,5 °C[1] | ||
| Masse volumique | 1,562 g·cm-3[1] à 25 °C | ||
| Précautions | |||
| SGH[1] | |||
 Danger |
|||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il est également possible de le produire en faisant réagir du dichlorure de silicium SiCl2 ou du silicium avec du chlore Cl2 :
Il est stable dans l'air et l'azote jusqu'à des températures d'au moins 400 °C pendant plusieurs heures, mais se décompose même à température ambiante en dodécachloronéopentasilane Si(SiCl3)4 et en tétrachlorure de silicium SiCl4 lorsqu'il est mis en présence de bases de Lewis[5] :
- 4 Si2Cl6 ⟶ 3 SiCl4 + Si(SiCl3)4.
Cette conversion est utilisée pour la réalisation de certains composants en silicium dans l'industrie des semiconducteurs, notamment des cellules photovoltaïques[6].
Notes et références
- Fiche Sigma-Aldrich du composé Hexachlorodisilane 96%, consultée le 12 février 2021.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 1, Ferdinand Enke, Stuttgart 1975, p. 657. (ISBN 3-432-02328-6)
- (en) E. S. M. Seo, M. Andreoli et R. Chiba, « Silicon tetrachloride production by chlorination method using rice husk as raw material », Journal of Materials Processing Technology, vol. 141, no 3, , p. 351-356 (DOI 10.1016/S0924-0136(03)00287-5, lire en ligne)
- (en) H. J. Emeléus et Muhammad Tufail, « Reaction of hexachlorodisilane with bases and alkyl halides », Journal of Inorganic and Nuclear Chemistry, vol. 29, no 8, , p. 2081-2084 (DOI 10.1016/0022-1902(67)80468-8, lire en ligne)
- (en) Walter Simmler, « Silicon Compounds, Inorganic », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a24_001, lire en ligne)
- Portail de la chimie
