Hydrure de diisobutylaluminium
L'hydrure de diisobutylaluminium, ou DIBAL, est un composé organoaluminique de formule chimique ((CH3)2CHCH2)2AlH, généralement sous forme dimère (((CH3)2CHCH2)2AlH)2 unie par deux ligands hydrure pontants[3]. Il s'agit d'un liquide incolore qui réagit très violemment au contact de l'humidité et est généralement distribué en solution dans le toluène, l'hexane ou le tétrahydrofurane (THF). C'est un réducteur électrophile principalement utilisé en synthèse organique sur les composés riches en électrons, avec une réactivité intermédiaire entre celles de l'aluminohydrure de lithium LiAlH4 et du borohydrure de sodium NaBH4. Il peut être obtenu en chauffant le triisobutylaluminium (((CH3)2CHCH2)3Al)2 pour induire une élimination de β-hydrure[4] :
- (((CH3)2CHCH2)3Al)2 ⟶ (((CH3)2CHCH2)2AlH)2 + 2 CH2=C(CH3)2.
| Hydrure de diisobutylaluminium (DIBAL) | |||
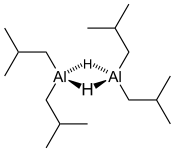
| |||
| Structure du dimère de DIBAL | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | bis(2-méthylpropyl)alumane | ||
| Synonymes |
DIBAL, DIBAL-H |
||
| No CAS | |||
| No ECHA | 100.013.391 | ||
| No CE | 214-729-9 | ||
| PubChem | 14487 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore[1] | ||
| Propriétés chimiques | |||
| Formule | ((CH3)2CHCH2)2AlH | ||
| Masse molaire[2] | 142,218 ± 0,007 7 g/mol C 67,56 %, H 13,47 %, Al 18,97 %, |
||
| Propriétés physiques | |||
| T° ébullition | 110 °C[1] | ||
| Solubilité | réagit violemment au contact de l'eau | ||
| Masse volumique | 0,848 g/cm3[1] | ||
| Point d’éclair | 4 °C[1] | ||
| Précautions | |||
| SGH[1] | |||
   Danger |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le DIBAL permet de réaliser diverses réductions en synthèse organique, y compris la conversion en aldéhydes de divers acides carboxyliques, de leurs dérivés et de nitriles. Il réduit efficacement les esters α,β-insaturés en leur alcool allylique correspondant[5]. Le LiAlH4 réduit en revanche les esters et les chlorures d'acyle en alcools primaires et les nitriles en amines primaires. Le DIBAL réagit lentement avec les composés pauvres en électrons, ce qui en fait un réducteur électrophile, alors que le LiAlH4 peut être considéré comme un réducteur nucléophile.
Bien que le DIBAL réduise les nitriles en aldéhydes avec une bonne fiabilité, la réduction des esters en aldéhydes est plus aléatoire et conduit souvent en pratique à des mélanges d'alcools et d'aldéhydes ; il est néanmoins possible de fiabiliser la réaction à travers un contrôle rigoureux des conditions de réaction par flux continu.
L'hydrure de diisobutylaluminium a été initialement étudié comme cocatalyseur pour la polymérisation des alcènes[6].
Notes et références
- « Fiche du composé Diisobutylaluminum hydride, 1.2M solution in toluene, packaged under Nitrogen in resealable AcroSeal[t bottles », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Mark F. Self, William T. Pennington et Gregory H. Robinson, « Reaction of diisobutylaluminum hydride with a macrocyclic tetradentate secondary amine. Synthesis and molecular structure of [Al(i-Bu)]2[C10H20N4] [Al(i-Bu)3]2: Evidence of an unusual disproportionation of (i-Bu)2AlH », Inorganica Chimica Acta, vol. 175, no 2, , p. 151-153 (DOI 10.1016/S0020-1693(00)84819-7, lire en ligne)
- (en) J. J. Eisch, Organometallic Syntheses, vol. 2, Academic Press, 1981. (ISBN 0-12-234950-4)
- (en) Paul Galatsis, Matthieu Sollogoub et Pierre Sinaÿ, « Diisobutylaluminum Hydride », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rd245.pub2, lire en ligne)
- (de) Karl Ziegler, Heinz Martin et Felix Krupp, « Metallorganische Verbindungen, XXVII Aluminiumtrialkyle und Dialkyl-Aluminiumhydride Aus Aluminiumisobutyl-Verbindungen », Justus Liebigs Annalen der Chemie, vol. 629, no 1, , p. 14-19 (DOI 10.1002/jlac.19606290103, lire en ligne)
- Portail de la chimie

