Immunofluorescence
L’immunofluorescence est une technique d’immunomarquage, qui utilise des anticorps ainsi que des fluorochromes. L'immunofluorescence permet de révéler une protéine spécifique directement dans la cellule, par émission de fluorescence. Elle permet donc de déterminer non seulement la présence, ou l'absence d'une protéine, mais aussi sa localisation dans la cellule, ou le tissu analysé.
Historique
Le phénomène de fluorescence fut découvert au milieu du XIXe siècle par le scientifique anglais Sir George Gabriel Stokes. Il fut le premier à observer que la fluorine, un minéral, devient fluorescente lorsque exposée à des rayons ultraviolets, et il lui donna le nom de "fluorescence".
Les premiers travaux utilisant l'immunofluorescence datent des années 1950, où des anticorps étaient conjugués à des fluorochromes de nature chimique, tels que la fluorescéine[1].
Les premières protéines fluorescentes (semblables aux fluorochromes utilisées en immunofluorescence) furent découvertes bien plus tard, avec le GFP (Green Fluorescent Protein), dans les années 1960, par Osamu Shimomura et Roger Y. Tsien. Issue d'une méduse (Aequorea victoria), la découverte de cette protéine leur valu le prix nobel de chimie en 2008[2]. De nos jours, de nombreux fluorochromes utilisés en immunofluorescence sont des dérivés de la GFP.
Principes[3],[4],[5].
Il existe deux types de fluorescence. Tout d’abord, la fluorescence dite « naturelle », ou auto-fluorescence, émise spontanément par la cellule. On peut citer par exemple la chlorophylle des cellules végétales. Ensuite il y a la fluorescence conférée par un fluorochrome, substance chimique qui émet de la lumière si elle est excitée à une certaine longueur d’onde.
Immunofluorescence directe
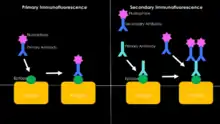
En immunofluorescence, on peut réaliser deux types de marquages. Le premier est l’immunofluorescence directe. Lors de ce marquage, on utilise un anticorps dirigé contre la molécule recherchée, appelée antigène. Cet anticorps est couplé à un fluorochrome. Ensuite pour révéler la préparation, on peut utiliser un microscope à épifluorescence ou un microscope confocal. Cette technique reste une des plus utilisées dans la recherche scientifique.
Immunofluorescence indirecte
Pour les articles homonymes, voir IFI.
L'immunofluorescence indirecte (IFI) est basée sur l'utilisation successive de 2 anticorps : le premier anticorps de type monoclonal reconnait spécifiquement la protéine d’intérêt. Le second anticorps de type polyclonal est dirigé contre l'anticorps primaire (le premier).
C'est le second marquage. Dans ce cas, on a deux anticorps. L’anticorps primaire est dirigé contre l’antigène recherché. Ensuite on utilise un deuxième anticorps, marqué par un fluorochrome, et possédant une haute affinité pour l’anticorps primaire (dirigé contre l’isotype de l’anticorps primaire, il s'agit alors d'une antiglobuline.)
Avantages et inconvénients
Comme avantages, il y a la possibilité de réaliser des marquages multiples sur un même échantillon de cellules, la rapidité et la facilité d'utilisation de cette méthode et aussi une bonne fiabilité de celle-ci. De plus en immunofluorescence indirecte, on a une augmentation de l’intensité lumineuse, car il y a plusieurs sites de fixation sur les anticorps primaires, ce qui permet d’avoir plusieurs anticorps secondaires fixés dessus.
Mais il y a quelques inconvénients. Par exemple, la possibilité de réactions faussement positives ou faussement négatives, l'appréciation subjective du degré de fluorescence et le phénomène de photo-blanchiment. Pour pallier ces inconvénients, il existe plusieurs techniques. Tout d’abord, réaliser un témoin négatif pour l’immunofluorescence indirecte, c'est-à-dire ne mettre que les anticorps secondaires (marqués) en contact avec l’échantillon à analyser. Après une étape de lavage, si le témoin négatif est bon, il ne doit pas avoir de fluorescence émise, car les anticorps secondaires n’ont pas pu se fixer, et ils sont donc partis après l’étape de lavage. Ensuite, l’utilisation de caméra haute résolution et haute sensibilité atténue le photoblanchiment et permet une étude quantitative de l'acquisition.
Technique
Bien que le principe de l'immunofluorescence soit simple, de nombreux facteurs sont à prendre en compte en pratique[6].
- La spécificité des anticorps. Il convient d'utiliser des anticorps monoclonaux autant que possible.
- Le blocage des sites non spécifiques.
- Les réactions croisées éventuelles, notamment dans le cas d'un double marquage par immunofluorescence indirecte. Il faut alors s'assurer que les anticorps secondaires ne seront spécifiques qu'à l'anticorps primaire associés.
- Les interactions biochimique entre protéine, notamment les interactions hydrophobes. Un détergent doux est souvent ajouté dans les tampons d'immunofluorescence pour éviter que ces interactions n'interfèrent avec le test.
- L'autofluorescence de l'échantillon. Si l'échantillon a une fluorescence naturelle, il faut alors effectuer un photoblanchiment avant de procéder à l'immunofluorescence.
- Dans le cas du marquage d'une protéine intra-cellulaire, les membranes doivent être perméabilisées auparavant, pour permettre à l'anticorps de rentrer dans la cellule pour trouver sa protéine cible.
- Il est préférable de n'observer qu'une seule fluorescence à la fois, et donc d'utiliser des fluorochromes dont les spectres d'excitation et d'émission ne se chevauchent pas.
Domaines d'utilisation[7]
On peut distinguer trois domaines :
Diagnostic
- En bactériologie, on utilise l’immunofluorescence pour une détection directe de bactéries dans les liquides biologiques. Mais aussi pour la recherche d’anticorps anti-microorganisme, par immunofluorescence indirecte.
- En virologie, l’immunofluorescence directe est utilisée pour réaliser des cinétiques d’apparition d’antigène cellulaire ou viral. Et l’immunofluorescence indirecte est employée pour une recherche d’un virus d’infection.
- En anatomie pathologique (réalisation d’une biopsie), l’immunofluorescence directe sert à déceler les dépôts d’immunoglobulines ou des protéines du complément dans les tissus. Ensuite en cancérologie, on peut quantifier l’expression d’oncogènes par cytofluorimétrie. Enfin, l’immunofluorescence peut servir à déterminer la qualité du sperme, afin de diagnostiquer une stérilité.
Recherche fondamentale
- Observation de la division cellulaire
- Analyse du cycle cellulaire, dont l'apoptose
- Activation cellulaire
- Hybridation moléculaire
- Localisation intracellulaire, on peut utiliser la vidéomicroscopie, mais aussi les protéines recombinantes.
Innovations
- Il existe des programmes de quantification et de reconstruction 3D, couplé à un microscope confocal ou à épifluorescence. Avec aussi, un programme de déconvolution, qui améliore la netteté de l’image ou de la vidéo.
- Phénotypage cellulaire en haut-débit, en plaque quatre-vingt-seize puits par exemple.
L'immunofluorescence est utilisée sur les cellules en culture (on parlera alors d'immunocytochimie) ou sur des coupes de tissus (immunohistochimie).
Articles connexes
Sources
- A. H. Coons et M. H. Kaplan, « Localization of antigen in tissue cells; improvements in a method for the detection of antigen by means of fluorescent antibody », The Journal of Experimental Medicine, vol. 91, no 1, , p. 1–13 (ISSN 0022-1007, PMID 15395569, PMCID PMC2135948, lire en ligne, consulté le )
- « Prix Nobel de Chimie 2008 : une méduse fluorescente récompensée. », sur culturesciences.chimie.ens.fr (consulté le )
- Immunologie, 4° Edition, EM inter
- Immunologie générale connaissance et pratique, 8° édition revue et complétée, MASSON
- Julie G. Donaldson, « UNIT 4.3 Immunofluorescence Staining », Current protocols in cell biology / editorial board, Juan S. Bonifacino ... [et al.], vol. 0 4, , Unit–4.3 (ISSN 1934-2500, PMID 18228363, PMCID PMC4709840, DOI 10.1002/0471143030.cb0403s00, lire en ligne, consulté le )
- Portail de la biologie