Lactulose
Le lactulose, également appelé Galactofructose, est un disaccharide de galactose et de fructose liés entre eux par une liaison osidique du type O β(1→4). Le lactulose peut être trouvé dans le lait de vache pasteurisé, stérilisé ou UHT (de 3,5 mg/L à 744 mg/L). Le lactulose est ainsi adéquat à l’alimentation humaine et animale.
| Lactulose | |
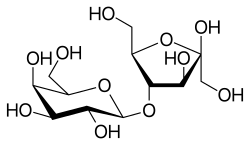
| |
| Structure du lactulose | |
| Identification | |
|---|---|
| Nom UICPA | 4-O-β-D-Galactopyranosyl- D-fructofuranose |
| Synonymes |
isolactose |
| No CAS | |
| No ECHA | 100.022.752 |
| No CE | 225-027-7 |
| Code ATC | A06 |
| PubChem | |
| Apparence | Solide blanc au goût sucré |
| Propriétés chimiques | |
| Formule | C12H22O11 [Isomères] |
| Masse molaire[1] | 342,296 5 ± 0,014 4 g/mol C 42,11 %, H 6,48 %, O 51,42 %, |
| Propriétés physiques | |
| T° fusion | 163 à 165 °C |
| Solubilité | Soluble dans l'eau. |
| Unités du SI et CNTP, sauf indication contraire. | |
Historique
Le lactulose a été décrit pour la première fois en 1929 comme lactoketose[2]. En 1957, le docteur Petuely[3] reconnaît l’activité bifidogéne du lactulose (augmentation des bifidobactéries chez les nourrissons) et l’appelle ainsi le “bifidogenic factor”. En 1959, Mayerhofer et Petuely[4] proposent son application dans la constipation, notamment chez les enfants. La production de lactulose sirop commence alors en 1960.
Structure et propriétés physiques
Le lactulose est un diholoside comprenant un galactose et un fructose liés par une liaison osidique du type O β(1→4).
Sa formule chimique est C12H22O11 et sa masse molaire 342,30 g·mol-1.
En solution à 25 °C, le lactulose est sous plusieurs formes tautomères[5] :
- 61,5 % β-D-pyranose ;
- 7,5 % α-D-pyranose ;
- 29 % β-D-furanose ;
- 1,6 % forme linéaire.
Le pouvoir sucrant du lactulose en solution dans l'eau est de 60%-70% quand le pouvoir sucrant du saccharose est de 100 %[6].
Production
Cette molécule est synthétisée par un réarrangement chimique à partir du lactose. Le lactulose peut également être produit à partir du lactose et du fructose par la β-galactosidase, une enzyme produite par la Sulfolobus solfataricus[7].
Métabolisme
Le lactulose ne peut pas être coupé par les enzymes de l’intestin grêle, et arrive donc intacte dans le gros intestin. A ce niveau, le lactulose est dégradé par des bactéries spécifiques. La liaison entre les deux sucres composant le lactulose est la raison pour laquelle le lactulose est non absorbable.
Dans l'intestin grêle, ces sucres attirent de l’eau suivant les lois de l’osmose. Arrivées dans le côlon, les bactéries dégradent le sucre et fabriquent des acides gras organiques volatils (acétate, butyrate, propionate), de l’H2 et du méthane (CH4). Ces acides gras organiques :
- acidifient le contenu intestinal ;
- ont un effet direct diarrhéogène (stimulant le transit par augmentation du péristaltisme) ;
- possèdent un pouvoir osmotique propre.
Cependant, cet effet est maximum pendant 8 à 15 jours : par la suite, les bactéries s’adaptent et la production d’acides gras volatils diminue, ce qui fait baisser d’autant le pouvoir laxatif de ces produits.
Indications
Les indications du lactulose sont multiples :
- Alimentaire, pour l’amélioration du transit et du confort digestif mais également pour ses effets prébiotiques sur le microbiote intestinal;
- Médicale;
- Comme outils de diagnostic.
Les effets secondaires pouvant survenir après une prise de lactulose sont les crampes abdominales, des ballonnements et des flatulences. Cependant, ces manifestations sont individu et dose dépendantes.
Utilisation alimentaire
Issu du lait et ayant un goût sucré, le lactulose (Galactofructose) est d’abord un ingrédient alimentaire. Étant sur le marché alimentaire et consommé avant 1997, le lactulose n’est pas sujet à la réglementation “Novel Food” de l’EFSA pour l’Europe.
Comportements dans les matrices alimentaires
D'un point de vue technologique, le galactofructose est un ingrédient qui peut être incorporé dans diverses matrices alimentaires : les produits laitiers[8],[9],[10], le pain[11], les biscuits[12], les produits carnés[13], etc.
Le galactofructose est un disaccharide ayant un pouvoir sucrant estimé à 0.6/0.7 comparé au sucrose, qui est stable et facile à intégrer dans de nombreux procédés (stabilité aux traitements thermiques[13] et aux pH, solubilité[14], viscosité). Il a donc également un impact sur l’aromatisation du produit ainsi que sur la conservation. En outre, diverses publications scientifiques témoignent de propriétés technologiques du galactofructose dans des matrices spécifiques telles que l'accélération de la durée de fermentation[14], la complémentarité avec des souches spécifiques d’intérêts[11] dans les produits laitiers fermentés ou encore le retardement du taux de rassissement dans le pain[15] (et en conséquence la prolongation de la durée de vie du produit).
Effet prébiotique
Depuis 2017, les prébiotiques sont définis par l’ISAP (International Scientific Association for Probiotics and Prebiotics) comme “un substrat qui est sélectivement utilisé par des micro-organismes de l'hôte et conférant un effet santé bénéfique”[16].
L’activité bifidogénique du lactulose est reconnue depuis 1957[3]. Il permet de stimuler sélectivement la croissance des bifidobactéries et lactobacilles et ainsi moduler la composition et la diversité du microbiote intestinal. Par ces actions sur ces bactéries d'intérêt, le lactulose peut induire :
- une stimulation de la réponse immunitaire[17],[18],
- la production de molécules inhibant certaines bactéries pathogènes[19],[20],[21],
- l'équilibre du microbiote intestinal après la prise d’antibiotiques[22],[23].
De plus, la Corée du Sud a reconnu l’effet prébiotique du Lactulose (Galactofructose) par le MFDS (Ministry of Food and Drug Safety).
Amélioration du transit
Chez des personnes présentant un transit ralenti, utiliser le lactulose comme ingrédient dans l’alimentation permet de réguler leur transit. La dégradation du lactulose par des bactéries spécifiques dans le gros intestin conduit à la production d’acides organiques tels que le lactate, l’acétate, le butyrate et le propionate. Le contenu intestinal est également acidifié et la pression osmotique ainsi que le volume dans le côlon sont augmentés. Ces changements conduisent à une augmentation du péristaltisme et une diminution du temps de transit. Le lactulose a obtenu une allégation de santé de l’EFSA pour ses effets de diminution du temps de transit intestinal[24] pour une prise de 10 g par jour.
Populations spéciales
Depuis sa première utilisation il y a 40 ans, aucun risque ni aucun cas d’abus de lactulose n’a été répertorié. Le lactulose n’ayant aucun risque toxicologique, il s’agit d’une des molécules les plus sûres d’utilisation[25]. Pour cela, le lactulose peut être utilisé sans risque chez les nourrissons[26], les enfants[27], les femmes enceintes[28] et allaitantes[29] ainsi que chez les personnes âgées[30].
Utilisation médicale
Constipation
Le lactulose est utilisé dans le traitement de la constipation chronique chez des patients de tout âge comme traitement de longue durée[25]. Le dosage de 15 ml à 45 ml par jour chez l’adulte est adapté selon la sévérité de la constipation et l’effet voulu.
Encéphalopathie hépatique
L’encéphalopathie hépatique est un désordre fonctionnel du cerveau, qui peut apparaître à la suite d'une insuffisance hépatique. L’ammoniac joue un rôle prépondérant dans cette maladie. Il est produit au niveau intestinal par les cellules mucosales de l’intestin grêle ou par le microbiote dans le côlon. Avec une fonction hépatique normale, l’ammoniac est décontaminé par le passage dans le foie. De trop forte teneur en ammoniac dans le sang sont alors toxiques pour le cerveau.
Le lactulose est également utilisé dans le traitement de l’hyperammoniémie. La diminution du pH conduit également à une ionisation de l'ammoniac (NH3 > NH4+) qui devient alors non absorbable et donc des ions ammonium non toxiques. En diminuant le pH de la lumière intestinale, le lactulose permet un passage direct de l’ammoniac produit dans le contenu intestinal. De plus, la réduction du pH a un effet bactériostatique sur les bactéries productrices d’ammoniac.
L’utilisation du lactulose dans le cas de l’encéphalopathie hépatique nécessite des dosages élevés jusqu’à 180 ml par jour dans les cas les plus sévères (coma).
Test respiratoire à l'hydrogène
Le test à l’hydrogène mesure le temps de transit de l’intestin grêle. L’hydrogène est formé par dégradation bactérienne du lactulose dans le côlon, les cellules humaines ne formant pas d’hydrogène. L’hydrogène alors formé dans le côlon est absorbé dans le sang puis relâché au niveau des poumons par la respiration. Ce test peut être utilisé pour plusieurs diagnostics tels que la malabsorption ou intolérance au lactose et la sur-croissance bactérienne dans l’intestin grêle. Dans la malabsorption, le test à l’hydrogène avec lactulose est couplé à un test à l’hydrogène avec le lactose. Chez les patients intolérants au lactose, le pic d’hydrogène apparaît à peu près en même temps que lors du test au lactulose, puisque le lactose n’est pas assimilé par le corps.
Dans la sur-croissance bactérienne dans l’intestin grêle, une grosse quantité de lactulose est administrée puis l’hydrogène exhalé est mesuré. Le test est positif si on observe une augmentation de l’hydrogène exhalé avant le temps attendu par une dégradation normale dans le côlon. Ceci indiquerait une quantité et une population anormale de bactéries dans l’intestin grêle.
Test de perméabilité
Des sucres avec différents taux d’absorption intestinale sont utilisés pour diagnostiquer une perméabilité intestinale (maladie cœliaque entre autres). Quand la muqueuse intestinale est abîmée, la perméabilité pour de petites molécules diminue due à la diminution de la surface et la perméabilité pour de grosses molécules augmente due à un épithélium plus perméable.
L’utilisation du lactulose et du mannitol, ayant des poids moléculaires différents, permet de mettre en avant différents taux d’absorption dans le cas d’une perméabilité. Après administration orale des sucres, les urines sont collectées et les concentrations absorbées sont calculées.
Spécialités
Le lactulose pharmaceutique est disponible sous diverses dénominations commerciales : Duphalac, Melaxib, Melaxose, Transulose[31].
Dosage
La norme ISO 11868:2007 établit la méthode de référence pour la détermination de la teneur en lactulose par la méthode de chromatographie liquide à hautes performances.
Divers
Le lactulose fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[32].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Mongomery E., Hudson A. & Tojo S., « Lactulose therapy for chronic renal failure », Jap Nephrol, 1984;8, p. 101-8
- (en) Petuely F., « The Bifidogenic factor Lactulose », Bifidobacteria Microflora, 1986;5, p. 1986;5:3-11.
- (de) Mayerhofer F. & Petuely F., « Untersuchungen zur Regulation der Darmträgheit des Erwachsenen mit Hilfe der Lactulose (Bifidus-Faktor) », Wien Klin Wochenchr, 1959;71, p. 865-869
- (en) Peter M. Collins, Dictionary of carbohydrates, CRC Press, (réimpr. 2005), 1282 p. (ISBN 978-0-8493-3829-8 et 0-8493-3829-8), p. 678
- (en) Tsuneyuki Oku & Sadako Nakamura, « Digestion, absorption, fermentation, and metabolism of functional sugar substitutes and their available energy », Pure Appl Chem, vol. 74, no 7, , p. 1253–61. (lire en ligne) [PDF]
- (en) Y Kim, C Park & D Oh, « Lactulose production from lactose and fructose by a thermostable β-galactosidase from Sulfolobus solfataricus », Enzyme and microbial technology, vol. 39, no 4, , p. 903-908 (ISSN 0141-0229, résumé)
- (en) De Souza Oliveira R.P., Florence A.C.R, Perego P., Nogueira De Oliveira M., Converti A., « Use of lactulose as prebiotic and its influence on the growth, acidification profile and viable counts of different probiotics in fermented skim milk », International Journal of Food Microbiology, 2011 jan 31;145(1), p. 22-7
- (en) Hashemi, M., Gheisari H.R. and Shekarforoush S., « Preparation and evaluation of low-calorie functional ice cream containing inulin, lactulose and Bifidobacterium lactis », Int J Dairy Technol., vol 68, no 2 may 2015, p. 183–189
- (en) Özer D., Akin S. and Özer B., « Effect of Inulin and Lactulose on Survival of Lactobacillus Acidophilus LA-5 and Bifidobacterium Bifidum BB-02 in Acidophilus-Bifidus Yoghurt », Food Sci Tech Int;, 2005; 11(1), p. 019–6
- Tat Toai Nguyen, Mémoire en vue de l’obtention d’une maîtrise en génie alimentaire. Contribution à l’utilisation du lactulose comme additif fonctionnel dans la fabrication de pain riche en son de blé, Québec, Canada,
- (en) Hiroshi Miura, Lactulose : séries : Beneficial use of news materials for food, Japan confectionery research center,
- (en) Oliveira C.A., Massingue A.A., Moura A.P.R., Fontes P.R., Ramos A.L. and Ramos E.M., « Restructured low-fat cooked ham containing liquid whey fortified with lactulose », J Sci Food Agric., 2018 jan;98(2), p. 807-816
- Battermann W. “Lactulose powder – main technological properties and its relevance in functional food.” Internal Report Solvay Deutschland GmbH (Report no. AWTLAC 12.041.97), 1997.
- Ajo R.Y., Amr A.S., Haddadin M.S. Effect of lactulose on the quality of hamam bread and its stability during baking. 2009 Conference paper “Proceedings of the 5th International Congress Flour-Bread '09. 7th Croatian Congress of Cereal Technologists”, University of Osijek, Croatia.
- (en) Gibson G.R., Hutkins R., Sanders M.E., Prescott S.L., Reimer R.A., Salminen S.J., Scott K., Stanton C., Swanson K.S., Cani P.D., Verbeke K., Reid G., « Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics », Nat Rev Gastroenterol Hepatol., 2017 aug;14(8), p. 491-502
- (en) Ruiz L, Delgado S, Ruas-Madiedo P, Sánchez B and Margolles A., « Bifidobacteria and Their Molecular Communication with the Immune System. », Front Microbiol., 2017; 8, p. 2345 (lire en ligne)
- (en) Azad AK, Sarker M, Li T and Yin J., « Probiotic Species in the Modulation of Gut Microbiota: An Overview », Biomed Res Int., 2018 may 8 (lire en ligne)
- (en) Levine MM, Hornick RB., « Lactulose therapy in Shigella carrier state and acute dysentery », Antimicrob Agents Chemother., 1975 nov;8(5), p. 581-4 (lire en ligne)
- (en) Bovee-Oudenhoven I, Van der Meer R., « Protective effects of dietary lactulose and calcium phosphate against Salmonella infection », Scand J Gastroenterol Suppl., 1997;222, p. 112-4
- (en) Ito Y, Moriwaki H, Muto Y, Kato N, Watanabe K, Ueno K., « Effect of lactulose on short-chain fatty acids and lactate production and on the growth of faecal flora, with special reference to Clostridium difficile », J Med Microbiol., 1997 jan;46(1), p. 80-4 (lire en ligne)
- (en) Dethlefsen L, Huse S, Sogin ML, Relman DA., « The pervasive effects of an antibiotic on the human gut microbiota, as revealed by deep 16S rRNA sequencing », PLoS Biol., 2008 nov 18;6(11) (lire en ligne)
- (en) O'Sullivan O, Coakley M, Lakshminarayanan B, Conde S, Claesson MJ, Cusack S, Fitzgerald AP, O'Toole PW, Stanton C, Ross RP; ELDERMET Consortium, « Alterations in intestinal microbiota of elderly Irish subjects post-antibiotic therapy », J Antimicrob Chemother., 2013 jan;68(1), p. 214-21
- (en) EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA), « Scientific Opinion on the substantiation of health claims related to lactulose and decreasing potentially pathogenic gastro‐intestinal microorganisms (ID 806) and reduction in intestinal transit time (ID 807) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. », EFSA Journal., 2010 volume 8, issue 10
- (en) Hallmann F., « Toxicity of commonly used laxatives », Med Sci Monit., 2000 may-jun;6(3), p. 618-28
- (en) Ziegler E, Vanderhoof JA, Petschow B, Mitmesser SH, Stolz SI, Harris CL, Berseth CL., « Term infants fed formula supplemented with selected blends of prebiotics grow normally and have soft stools similar to those reported for breast-fed infants », J Pediatr Gastroenterol Nutr., 2007 mar;44(3), p. 359-64
- (en) Kokke FT, Scholtens PA, Alles MS, Decates TS, Fiselier TJ, Tolboom JJ, Kimpen JL, Benninga MA., « A dietary fiber mixture versus lactulose in the treatment of childhood constipation: a double-blind randomized controlled trial », J Pediatr Gastroenterol Nutr., 2008 nov;47(5), p. 592-7
- (en) Shafe AC, Lee S, Dalrymple JS, Whorwell PJ., « The LUCK study: Laxative Usage in patients with GP-diagnosed Constipation in the UK, within the general population and in pregnancy. An epidemiological study using the General Practice Research Database (GPRD). », Therap Adv Gastroenterol., 2011 nov;4(6), p. 343-63
- (en) Yu Zhou, Xinghua Yang, Ling Fan, Yuanfang Zhu, Yurong Jiang, Zhen Li, Guoping Xiong, Jingxin Shen, Zhihong Su, Ping Wu, Danrui Wang, and Xietong Wang, « Observations on the curative effect of lactulose for postpartum constipation based on a large sample study. », Int J Clin Exp Med., 2015; 8(10), p. 19167–19171
- (en) Lederle FA, Busch DL, Mattox KM, West MJ, Aske DM., « Cost-effective treatment of constipation in the elderly: a randomized double-blind comparison of sorbitol and lactulose. », Am J Med., 1990;89, p. 597–601
- « VIDAL - Recherche : lactulose », sur www.vidal.fr (consulté le )
- WHO Model List of Essential Medicines, 18th list, avril 2013
Voir aussi
Articles connexes
Bibliographie
- (en) Deglin, J. H., & Vallerand A. H. (2003). Lactulose. In Davis's drug guide for nurses (9th ed.) (pp. 589-590). Philadelphia:F. A. Davis.
Liens externes
- (en) Substance Lactulose NCBI database
- (en) COMPOUND: C07064 Lactulose www.Genome.net
- (en) Medline Plus
- (en) GLYCAN: G03573 sur www.Genome.net
- (en) Organisation Internationale de Normalisation (ISO)
- Compendium suisse des médicaments : spécialités contenant Lactulose
- Portail de la chimie
- Portail de la médecine
- Portail de la pharmacie