Leucotriène A4 hydrolase
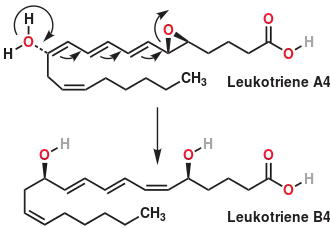
La leucotriène A4 hydrolase ou LTA4H est une enzyme ubiquitaire, la forme humaine étant particulièrement caractérisée. L'ADNc code une protéine bifonctionnelle car elle présente deux activités enzymatiques différentes. En effet, elle peut convertir le leucotriène A4 (LTA4) en leucotriène B4 (LTB4), un puissant médiateur lipidique de l'inflammation. Elle présente également une activité aminopeptidase B (EC ) avec une spécificité assez large pour le résidu situé en P1 du substrat (Arg, Ala, Pro...). Sa séquence permet de la classer dans la famille M1 des aminopeptidases qui nécessitent un atome de zinc dans leur site actif.
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | Zinc |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Structure
Les acides aminés 295, 299 et 318 chélatent le zinc. L'acide aminé D375 joue un rôle essentiel dans le mécanisme catalytique d'hydrolyse de la liaison époxyde du LTA4 en LTB4. Pour l'activité aminopeptidase, les résidus E296 et Y383 sont fondamentaux dans le mécanisme. D'autres résidus sont importants pour positionner les substrats tels que E271 et R563.
Fonction
Le rôle de conversion de la LTA4H libère le Leucotriène B4 qui est un lipide chimioattractant impliqué dans l’inflammation et la réponse immunitaire[1]. À l'inverse, l'activité aminopeptidase de la LTA4H diminuerait la réponse inflammatoire. Il est donc supposé que la réponse inflammatoire induite par la LTA4H serait modulée en fonction de la localisation subcellulaire de la protéine.
Notes et références
- (en) Marjolein M.G.M. Thunnissen, Pär Nordlund et Jesper Z. Haeggström, « Crystal structure of human leukotriene A4 hydrolase, a bifunctional enzyme in inflammation », Nature Structural Biology, vol. 8, no 2, , p. 131-135 (PMID 11175901, DOI 10.1038/84117, lire en ligne)
- Portail de la biochimie