Liaison peptidique
Une liaison peptidique est une liaison covalente qui s'établit entre la fonction carboxyle portée par le carbone α d'un acide aminé et la fonction amine portée par le carbone α de l'acide aminé suivant dans la chaîne peptidique. La liaison peptidique correspond à une fonction amide dans le cas particulier de certaines molécules biologiques. La liaison peptidique est une liaison plane et rigide[1].
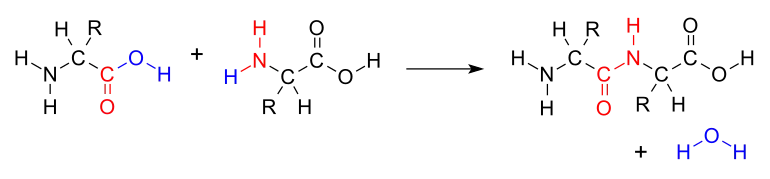
Formation
La liaison est le résultat de la réaction de condensation entre la fonction acide carboxylique COOH du premier acide aminé et la fonction amine NH2 du deuxième, avec comme produit secondaire une molécule d'eau H2O.
La liaison peptidique est fondamentale dans la formation des peptides, des polypeptides et des protéines. Après la constitution de la liaison peptidique, une extrémité est porteuse d'un groupe amine libre - l'extrémité N - ou amino-terminale, et l'autre d'un groupe carboxyl - extrémité C - ou carboxyl-terminale.
Configurations
La liaison peptidique peut exister sous deux configurations : cis et trans. Cependant, dans la forme cis, les chaînes latérales et les atomes de carbone alpha de résidus adjacents se gênent mutuellement et, du fait de cet encombrement stérique, le rapport cis/trans est de l'ordre 1:1000. Une exception notable de cette règle est la proline, pour laquelle la forme atypique du groupe latéral rend la configuration cis plus accessible[2].
Propriétés
- Stabilité

La liaison peptidique est stabilisée par mésomérie et ne peut subir de libre rotation, propriété très importante dans l'établissement de la conformation tridimensionnelle des chaînes polypeptidiques. Cette résonance implique la planéité de la liaison peptidique.
De cette structure, il découle que les groupements R des deux acides aminés sont alternés de part et d'autre de la liaison peptidique.
- Longueurs et angles
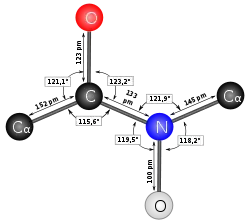
La longueur d'une liaison peptidique est de 1,33 Å = 133 pm (= 1,33 × 10−10 m).
Elle est donc plus courte qu'une liaison simple ordinaire mais plus longue qu'une liaison double.
De plus, la liaison peptidique est polaire, en raison de l'électronégativité de l'oxygène et de la charge + portée par l'azote.
Rupture
Les liaisons peptidiques peuvent être cassées par protéolyse grâce à des enzymes appelées peptidases.
Références
- (en) Pauling, Linus, 1901-1994., The nature of the chemical bond and the structure of molecules and crystals : an introduction to modern structural chemistry, Ithaca/New York, Cornell University Press, , 644 p. (ISBN 0-8014-0333-2, OCLC 545520, lire en ligne)
- L'Actualité chimique, juillet 2002, p. 12.
Voir aussi
- Portail de la biochimie
- Portail de la chimie
- Portail de la biologie