Major facilitator superfamily
En biochimie, la major facilitator superfamily (MFS, littéralement « superfamille majeure de facilitateurs ») est un ensemble de transporteurs membranaires qui facilitent la circulation de petites molécules dissoutes à travers les membranes cellulaires à l'aide de gradients de concentation chimiosmotiques[2],[3].
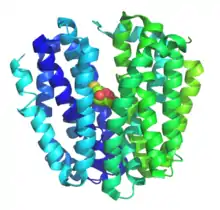
Ce sont des protéines membranaires qui sont exprimées universellement dans tous les règnes du vivant, où elles assurent l'importation et l'exportation de substrats spécifiques dans et hors des cellules. Lorsqu'elles ont été découvertes, on pensait que ces protéines intervenaient principalement dans l'absorption des sucres, mais des études plus approfondies ont montré que des métabolites, des médicaments, des oligosaccharides, des acides aminés et des oxyanions sont également transportés à travers les membranes biologiques par des protéines de la famille des MFS[4]. Ces protéines assurent le transport de leurs substrats essentiellement de deux manières différentes : en utilisant le propre gradient de concentration du substrat — il s'agit dans ce cas d'un uniport — ou en utilisant le gradient de concentration d'une autre molécule — il s'agit dans ce cas d'un cotransporteur, de type symport ou antiport, assurant le transport actif du substrat principal.
Structure et fonctionnement
On a pu caractériser par cristallographie aux rayons X la structure d'un grand nombre de transporteurs de la MFS. Les premiers à l'avoir été sont l'antiport glycérol-3-phosphate/phosphate GlpT[5] et le symport lactose/proton LacY[6] (lactose perméase) chez E. coli. La structure de ces protéines a permis de comprendre le fonctionnement de l'ensemble des transporteurs de la MFS en permettant de modéliser leur mécanisme de transport. Depuis lors, de nombreuses autres structures de transporteurs de la MFS ont été élucidées, illustrant la spécificité à divers substrats et différents états au cours du cycle de changements conformationnels[7],[8]. La structure de transporteurs de la MFS issus d'eucaryotes a par la suite été élucidée, dont un transporteur de phosphate PiPT de champignon[9], un transporteur de nitrate NRT1.1 de plante[10],[11] et le transporteur de glucose humain GLUT1[12].
Le mode de repliement principal des protéines MFS, homologues entre elles[13], repose sur douze hélices α transmembranaires[14], avec deux groupes de six hélices constitués par les domaines N-terminal et C-terminal, reliés entre eux par une longue boucle cytoplasmique. Les deux moitiés de la protéine se referment à la façon de la coquille d'un bivalve à l'aide d'interactions aux extrémités des hélices transmembranaires et des boucles extracellulaires[6],[5]. Il se forme ainsi une cavité aqueuse à l'intérieur de la membrane, qui s'ouvre alternativement sur le cytoplasme ou sur le périplasme ou le milieu extracellulaire. Les résidus d'acides aminés qui tapissent la paroi de cette cavité déterminent la spécificité du transporteur vis-à-vis de substrats particuliers[15],[16]. On pense que de nombreux transporteurs de la MFS sont des dimères à la fois in vitro et in vivo, certaines observations suggérant que cette oligomérisation joue également un rôle dans le fonctionnement de ces protéines[10].
Mécanisme dit « d'interrupteur à bascule »

Le mécanisme d'ouverture alternativement d'un côté et de l'autre de la membrane qui sous-tend le transport des substrats de la plupart des transporteurs de la MFS est généralement appelé mécanisme rocker switch[6],[5], c'est-à-dire d'interrupteur à bascule. Dans ce modèle, le transporteur s'ouvre tantôt du côté cytoplasmique, tantôt du côté extracellulaire, en refermant son côté opposé, agissant comme un sas qui empêche l'ouverture d'un conduit traversant directement la membrane. Ainsi, dans le cas de la lactose perméase, l'un des transporteurs de la MFS les plus étudiés, le lactose et les protons se lient à des sites spécifiques dans la fosse aqueuse du côté périplasmique ; ceci conduit à la fermeture du côté extracellulaire et à l'ouverture du côté cytoplasmique, libérant le substrat dans la cellule tandis que la protéine retrouve sa configuration initiale en se refermant du côté cytoplasmique et en s'ouvrant du côté extracellulaire.
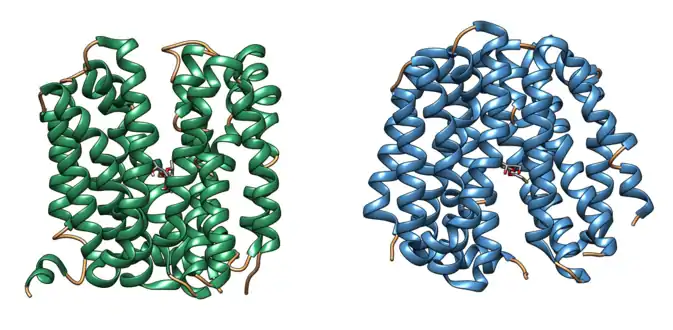 Conformation de la lactose perméase (LacY) en ouverture extracellulaire (à gauche) et cytoplasmique (à droite) (PDB 4OAA[8] et PDB 2Y5Y[1]).
Conformation de la lactose perméase (LacY) en ouverture extracellulaire (à gauche) et cytoplasmique (à droite) (PDB 4OAA[8] et PDB 2Y5Y[1]).
Les protéines d'export et les antiports de la MFS suivent le même genre de cycle, bien que les protéines d'export se lient au substrat côté cytoplasmique et le libère côté extracellulaire, tandis que les antiports se lient aux substrats des deux côtés et les libèrent chacun de l'autre côté. Bien que, dans la plupart des cas, la structure des protéines de la MFS suggère d'importantes modifications structurelles lors de la liaison au substrat, ces modifications peuvent être assez limitées dans le cas de substrats de petite taille, comme c'est le cas pour le transporteur de nitrate NarK[17].
Spécificité envers les substrats
Si les transporteurs de la major facilitator family ont été initialement identifiés pour leur rôle dans le transport des sucres depuis les procaryotes[16] jusqu'aux mammifères[18], ils sont en réalité remarquables par la diversité de substrats qu'ils sont à même de transporter, depuis de petits oxyanions[19],[20],[9] jusqu'à de grands fragments peptidiques[21]. Certains transporteurs de la MFS sont remarquables par leur manque de sélectivité, ce qui leur permet de transporter un large éventail de drogues, médicaments et xénobiotiques[22],[23],[24]. La spécificité au substrat est déterminée essentiellement par les chaînes latérales des résidus d'acides aminés tapissant la cavité centrale creusée par le transporteur dans la bicouche lipidique de la membrane[15],[16]. Si l'on nomme généralement les transports en fonction du substrat transporté présentant le plus grand intérêt physiologique ou métabolique, cela ne signifie pas qu'ils ne transportent que ces substrats-là : il peut également y avoir des ions ou des molécules co-transportées (dans le même sens) ou anti-portées (en sens opposés) ; il peut s'agir par exemple de molécules d'eau[25],[26] ou d'ions réalisant un couplage chimiosmotique fournissant l'énergie nécessaire au transport actif du substrat.
Origine et évolution
L'origine du mode de repliement particulier des transporteurs de la MFS fait l'objet d'intenses débats. Toutes les perméases de ce type connues au début du XXIe siècle possèdent deux domaines à six hélices transmembranaires sur une seule chaîne polypeptidique, bien que certaines familles de protéines de la MFS possèdent deux hélices transmembranaires supplémentaires. Des indices laissent penser que les perméases de la MFS sont apparues par duplication intragénique en tandem chez les tout premiers procaryotes à partir de ce qu'on suppose avoir été à l'origine un dimère à six hélices. De plus, le motif spécifique hautement conservé entre les segments transmembranaires 2 et 3 des transporteurs de la MFS, ainsi que le motif apparenté mais moins conservé entre les segments transmembranaires 8 et 9, s'avère être une caractéristique de pratiquement tous — plus de 300 — les transporteurs dont la structure a été établie[27]. Cependant, l'origine du domaine primordial à six hélices demeure largement débattue. Certains éléments fonctionnels et structurels laissent penser qu'il proviendrait d'un domaine plus simple à trois hélices[28],[29], mais les données phylogéniques manquent pour étayer cette hypothèse par une analyse bioinformatique probante[30],[31].
Pathologies humaines associées
Les transporteurs de la major facilitator superfamily jouent un rôle central dans la physiologie humaine et interviennent dans un certain nombre de maladies, que ce soit à travers une action aberrante, le transport de médicaments ou au contraire en induisant une pharmacorésistance (en) contre ces médicaments. Le transporteur OAT1 transport un certain nombre d'analogues de nucléosides très importants comme antiviraux[32]. La résistance aux antibiotiques est fréquemment le résultat de l'action de gènes de résistance MFS[33]. On a également pu montrer que des mutations de transporteurs de la MFS sont responsables de maladies neurodégénératives[34], de troubles vasculaires cérébraux[35] et de maladies de stockage du glucose[36].
Notes et références
- (en) Vincent Chaptal, Seunghyug Kwon, Michael R. Sawaya, Lan Guan, H. Ronald Kaback et Jeff Abramson, « Crystal structure of lactose permease in complex with an affinity inactivator yields unique insight into sugar recognition », Proceedings of the National Academy of Sciences of the United States of America, vol. 108, no 23, , p. 9361-9366 (PMID 21593407, PMCID 3111295, DOI 10.1073/pnas.1105687108, Bibcode 2011PNAS..108.9361C, lire en ligne)
- (en) Stephanie S. Pao, Ian T. Paulsen et Milton H. Saier Jr., « Major Facilitator Superfamily », Microciology and Molecular Biology Reviews, vol. 62, no 1, , p. 1-34 (PMID 9529885, PMCID 98904, lire en ligne)
- (en) Adrian R. Walmsley, Michael P. Barrett, Frédéric Bringaud et Gwyn W. Gould, « Sugar transporters from bacteria, parasites and mammals: structure–activity relationships », Trends in Biochemical Sciences, vol. 23, no 12, , p. 476-481 (PMID 9868370, DOI 10.1016/S0968-0004(98)01326-7, lire en ligne)
- (en) Michael D. Marger et Milton H. Saier Jr., « A major superfamily of transmembrane facilitators that catalyse uniport, symport and antiport », Trends in Biochemical Sciences, vol. 18, no 1, , p. 13-20 (PMID 8438231, DOI 10.1016/0968-0004(93)90081-W, lire en ligne)
- (en) Yafei Huang, M. Joanne Lemieux, Jinmei Song, Manfred Auer et Da-Neng Wang, « Structure and Mechanism of the Glycerol-3-Phosphate Transporter from Escherichia coli », Science, vol. 301, no 5633, , p. 616-620 (PMID 12893936, DOI 10.1126/science.1087619, lire en ligne)
- (en) Jeff Abramson, Irina Smirnova, Vladimir Kasho, Gillian Verner, H. Ronald Kaback et So Iwata, « Structure and Mechanism of the Lactose Permease of Escherichia coli », Science, vol. 301, no 5633, , p. 610-615 (PMID 12893935, DOI 10.1126/science.1088196, lire en ligne)
- (en) Shangyu Dang, Linfeng Sun, Yongjian Huang, Feiran Lu, Yufeng Liu, Haipeng Gong, Jiawei Wang et Nieng Yan, « Structure of a fucose transporter in an outward-open conformation », Nature, vol. 467, no 7316, , p. 734-738 (PMID 20877283, DOI 10.1038/nature09406, lire en ligne)
- (en) Hemant Kumar, Vladimir Kasho, Irina Smirnova, Janet S. Finer-Moore, H. Ronald Kaback et Robert M. Strouda, « Structure of sugar-bound LacY », Proceedings of the National Academy of Sciences of the United States of America, vol. 111, no 5, , p. 1784-1788 (PMID 24453216, PMCID 3918835, DOI 10.1073/pnas.1324141111, Bibcode 2014PNAS..111.1784K, lire en ligne)
- (en) Bjørn P. Pedersen, Hemant Kumar, Andrew B. Waight, Aaron J. Risenmay, Zygy Roe-Zurz, Bryant H. Chau, Avner Schlessinger, Massimiliano Bonomi, William Harries, Andrej Sali, Atul K. Johri et Robert M. Stroud, « Crystal structure of a eukaryotic phosphate transporter », Nature, vol. 496, no 7446, , p. 533-536 (PMID 23542591, DOI 10.1038/nature12042, lire en ligne)
- (en) Ji Sun, John R. Bankston, Jian Payandeh, Thomas R. Hinds, William N. Zagotta et Ning Zheng, « Crystal structure of the plant dual-affinity nitrate transporter NRT1.1 », Nature, vol. 507, no 7490, , p. 73-77 (PMID 24572362, DOI 10.1038/nature13074, lire en ligne)
- (en) Joanne L. Parker et Simon Newstead, « Molecular basis of nitrate uptake by the plant nitrate transporter NRT1.1 », Nature, vol. 507, no 7490, , p. 68-72 (PMID 24572366, DOI 10.1038/nature13116, lire en ligne)
- (en) Dong Deng, Chao Xu, Pengcheng Sun, Jianping Wu, Chuangye Yan, Mingxu Hu et Nieng Yan, « Crystal structure of the human glucose transporter GLUT1 », Nature, vol. 510, no 7503, , p. 121-125 (PMID 24847886, DOI 10.1038/nature13306, lire en ligne)
- (en) Martin C. J. Maiden, Elaine O. Davis, Stephen A. Baldwin, Duncan C. M. Moore et Peter J. F. Henderson, « Mammalian and bacterial sugar transport proteins are homologous », Letters to Nature, vol. 325, no 6105, , p. 641-643 (PMID 3543693, DOI 10.1038/325641a0, lire en ligne)
- (en) D. L. Foster, M. Boublik et H. R. Kaback, « Structure of the lac carrier protein of Escherichia coli », Journal of Biological Chemistry, vol. 258, no 1, , p. 31-34 (PMID 6336750, lire en ligne)
- (en) Nieng Yan, « Structural advances for the major facilitator superfamily (MFS) transporters », Trends in Biochemical Sciences, vol. 38, no 3, , p. 151-159 (PMID 23403214, DOI 10.1016/j.tibs.2013.01.003, lire en ligne)
- (en) H. Ronald Kaback, Miklós Sahin-Tóth et Adam B. Weinglass, « The kamikaze approach to membrane transport », Nature Reviews. Molecular Cell Biology, vol. 2, no 8, , p. 610-620 (PMID 11483994, DOI 10.1038/35085077, lire en ligne)
- (en) Hongjin Zheng, Goragot Wisedchaisri et Tamir Gonen, « Crystal structure of a nitrate/nitrite exchanger », Nature, vol. 497, no 7451, , p. 647-651 (PMID 23665960, DOI 10.1038/nature12139, lire en ligne)
- (en) M. Mueckler, C. Caruso, S. A. Baldwin, M. Panico, I. Blench, H. R. Morris, W. J. Allard, G. E. Lienhard et H. F. Lodish, « Sequence and structure of a human glucose transporter », Science, vol. 229, no 4717, , p. 941-945 (PMID 3839598, DOI 10.1126/science.3839598, lire en ligne)
- (en) Hanchi Yan, Weiyun Huang, Chuangye Yan, Xinqi Gong, Sirui Jiang, Yu Zhao, Jiawei Wang et Yigong Shi, « Structure and Mechanism of a Nitrate Transporter », Cell Reports, vol. 3, no 3, , p. 716–723 (PMID 23523348, DOI 10.1016/j.celrep.2013.03.007, lire en ligne)
- (en) Yi-Fang Tsay, Julian I. Schroeder, Kenneth A. Feldmann et Nigel M. Crawford, « The herbicide sensitivity gene CHL1 of arabidopsis encodes a nitrate-inducible nitrate transporter », Cell, vol. 72, no 5, , p. 705-713 (PMID 8453665, DOI 10.1016/0092-8674(93)90399-B, lire en ligne)
- (en) Shintaro Doki, Hideaki E. Kato, Nicolae Solcan, Masayo Iwaki, Michio Koyama, Motoyuki Hattori, Norihiko Iwase, Tomoya Tsukazaki, Yuji Sugita, Hideki Kandori, Simon Newstead, Ryuichiro Ishitani et Osamu Nureki, « Structural basis for dynamic mechanism of proton-coupled symport by the peptide transporter POT », Proceedings of the National Academy of Sciences of the United States of America, vol. 110, no 28, , p. 11343-11348 (PMID 23798427, DOI 10.1073/pnas.1301079110, lire en ligne)
- (en) Daohua Jiang, Yan Zhao, Xianping Wang, Junping Fan, Jie Heng, Xuehui Liu, Wei Feng, Xusheng Kang, Bo Huang, Jianfeng Liu et Xuejun Cai Zhang, « Structure of the YajR transporter suggests a transport mechanism based on the conserved motif A », Proceedings of the National Academy of Sciences of the United States of America, vol. 110, no 36, , p. 14664-14669 (PMID 23950222, DOI 10.1073/pnas.1308127110, lire en ligne)
- (en) Monique Putman, Hendrik W. van Veen et Wil N. Konings, « Molecular Properties of Bacterial Multidrug Transporters », Microbiology and Molecular Biology Reviews, vol. 64, no 4, , p. 672-693 (PMID 11104814, DOI 10.1128/MMBR.64.4.672-693.2000, lire en ligne)
- (en) Yong Yin, Xiao He, Paul Szewczyk, That Nguyen et Geoffrey Chang, « Structure of the Multidrug Transporter EmrD from Escherichia coli », Science, vol. 312, no 5774, , p. 741-744 (PMID 16675700, DOI 10.1126/science.1125629, lire en ligne)
- (en) Jing Li, Saher A. Shaikh, Giray Enkavi, Po-Chao Wen, Zhijian Huang et Emad Tajkhorshid, « Transient formation of water-conducting states in membrane transporters », Proceedings of the National Academy of Sciences of the United States of America, vol. 110, no 19, , p. 7696-7701 (PMID 23610412, DOI 10.1073/pnas.1218986110, lire en ligne)
- (en) J. Fischbarg, K. Y. Kuang, J. C. Vera, S. Arant, S. C. Silverstein, J. Loike et O. M. Rosen, « Glucose transporters serve as water channels », Proceedings of the National Academy of Sciences of the United States of America, vol. 87, no 8, , p. 3244-3247 (PMID 2326282, DOI 10.1073/pnas.87.8.3244, lire en ligne)
- (en) P. J. F. Henderson, « The homologous glucose transport proteins of prokaryotes and eukaryotes », Research in Microbiology, vol. 141, no 3, , p. 316-328 (PMID 2177911, DOI 10.1016/0923-2508(90)90005-B, lire en ligne)
- (en) M. Gregor Madej, Shangyu Dang, Nieng Yan et H. Ronald Kaback, « Evolutionary mix-and-match with MFS transporters », Proceedings of the National Academy of Sciences of the United States of America, vol. 110, no 15, , p. 5870-5874 (PMID 23530251, DOI 10.1073/pnas.1303538110, lire en ligne)
- (en) M. Gregor Madej et H. Ronald Kaback, « Evolutionary mix-and-match with MFS transporters II », Proceedings of the National Academy of Sciences of the United States of America, vol. 110, no 50, , E4831-E4838 (PMID 24259711, DOI 10.1073/pnas.1319754110, lire en ligne)
- (en) Å. Västermark, B. Lunt et M. Saier, « Major Facilitator Superfamily Porters, LacY, FucP and XylE of Escherichia col Appear to Have Evolved Positionally Dissimilar Catalytic Residues without Rearrangement of 3-TMS Repeat Units », Journal of Molecular Microbiology and Biotechnology, vol. 24, no 2, , p. 82-90 (PMID 24603210, DOI 10.1159/000358429, lire en ligne)
- (en) Åke Västermark et Milton H. Saier1, « Major Facilitator Superfamily (MFS) evolved without 3-transmembrane segment unit rearrangements », Proceedings of the National Academy of Sciences of the United States of America, vol. 111, no 13, , E1162-E1163 (PMID 24567407, DOI 10.1073/pnas.1400016111, lire en ligne)
- (en) Saiko Wada, Minoru Tsuda, Takashi Sekine, Seok Ho Cha, Miyako Kimura, Yoshikatsu Kanai et Hitoshi Endou, « Rat Multispecific Organic Anion Transporter 1 (rOAT1) Transports Zidovudine, Acyclovir, and Other Antiviral Nucleoside Analogs », Journal of Pharmacology and Experimental Therapeutics, vol. 294, no 3, , p. 844-849 (PMID 10945832, lire en ligne)
- (en) Nir Fluman et Eitan Bibi, « Bacterial multidrug transport through the lens of the major facilitator superfamily », Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, vol. 1794, no 5, , p. 738-747 (PMID 19103310, DOI 10.1016/j.bbapap.2008.11.020, lire en ligne)
- (en) M. A. Aldahmesh, Z. N. Al-Hassnan, M. Aldosari et F. S. Alkuraya, « Neuronal ceroid lipofuscinosis caused by MFSD8 mutations: a common theme emerging », Neurogenetics, vol. 10, no 4, , p. 307-311 (PMID 19277732, DOI 10.1007/s10048-009-0185-1, lire en ligne)
- (en) Esther Meyer, Christopher Ricketts, Neil V. Morgan, Mark R. Morris, Shanaz Pasha, Louise J. Tee, Fatimah Rahman, Anne Bazin, Bettina Bessières, Pierre Déchelotte, Mohamed T. Yacoubi, Mudher Al-Adnani, Tamas Marton, David Tannahill, Richard C. Trembath, Catherine Fallet-Bianco, Phillip Cox, Denise Williams et Eamonn R. Maher, « Mutations in FLVCR2 Are Associated with Proliferative Vasculopathy and Hydranencephaly-Hydrocephaly Syndrome (Fowler Syndrome) », American Journal of Human Genetics, vol. 86, no 3, , p. 471–478 (PMID 20206334, PMCID 2833392, DOI 10.1016/j.ajhg.2010.02.004, lire en ligne)
- (en) J. M. Pascual, D. Wang, B. Lecumberri, H. Yang, X. Mao, R. Yang et D. C. De Vivo, « GLUT1 deficiency and other glucose transporter diseases », European Journal of Endocrinology, vol. 150, no 5, , p. 627-633 (PMID 15132717, DOI 10.1530/eje.0.1500627, lire en ligne)
- Portail de la biochimie