Mérion à dos rouge
Malurus melanocephalus

mâle en livrée nuptiale
| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Classe | Aves |
| Ordre | Passeriformes |
| Famille | Maluridae |
| Genre | Malurus |

LC : Préoccupation mineure
Le Mérion à dos rouge (Malurus melanocephalus) est une espèce de passereaux de la famille des Maluridae. Il est endémique d’Australie où on le trouve près des rivières et des zones côtières depuis le long des côtes septentrionales et orientales de la région de Kimberley jusque dans le Nord-Ouest de la région de Hunter en Nouvelle-Galles du Sud. Comme les autres mérions, cette espèce affiche un dimorphisme sexuel marqué. Le mâle adopte un plumage nuptial frappant, avec une tête, le dessous et la queue noirs, avec un dos rouge vif et les ailes brunes. La femelle a les parties supérieures et inférieures beige. Le mâle hors plumage de reproduction et les juvéniles ressemblent à la femelle. Certains mâles restent en plumage normal en période de reproduction. Deux sous-espèces sont reconnues : M. m. melanocephalus, la forme rencontrée dans l'Est de l'Australie a le dos orange et la queue longue alors que M. cruentatus trouvé dans le Nord de l'Australie a le dos rouge et la queue courte.
Le mérion à dos rouge mange principalement des insectes et complète son alimentation avec des graines et de petits fruits. Son habitat préféré est les landes et la savane, en particulier lorsque les petits arbustes et de hautes herbes lui fournissent une couverture. Il peut être nomade dans des zones où il y a des feux de brousse fréquents, bien que deux individus ou un petit groupes d'oiseaux gardent et défendent leurs territoires pendant toute l'année dans d'autres parties de son domaine. Les groupes sont composés d'une paire socialement monogame avec un ou plusieurs oiseaux auxiliaires qui aident à élever les jeunes. Ces assistants sont des descendants qui ont atteint la maturité sexuelle tout en restant avec le groupe familial pour une ou plusieurs années après leur envol. Il a une certaine liberté sexuelle et chaque partenaire peut s'accoupler avec d'autres individus et même aider à élever les jeunes de ces couples. Des mâles âgés en plumage nuptial sont plus susceptibles de se comporter ainsi que ceux restés en plumage d'éclipse. Dans le cadre de la parade nuptiale, le troglodyte mâle cueille des fleurs aux pétales rouges et les montre à des femelles.
Taxonomie
Le premier mérion à dos rouge a été trouvé dans les environs de Port Stephens en Nouvelle-Galles du Sud et décrit par l'ornithologue John Latham en 1801 comme Muscicapa melanocephala, son épithète spécifique dérivant du grec ancien Melano, « noir », et Céphale « tête »[1]. Toutefois, l'échantillon utilisé par Latham était un mâle en mue avec un plumage noir et brun mélangés et un dos orange et il l'a nommé pour sa tête noire. Un mâle au plumage adulte a été décrit comme Sylvia dorsalis et les explorateurs Nicholas Aylward Vigors et Thomas Horsfield ont donné à un troisième échantillon du Queensland Central le nom de Malurus brownii, honorant ainsi le botaniste Robert Brown. John Gould décrit Malurus cruentatus en 1840 à partir d'un spécimen rouge à queue courte recueilli dans le Nord-Ouest de l'Australie par Benjamin Bynoe à bord du HMS Beagle lors de son troisième voyage. Les trois premiers noms ont été déclassés en synonymes de Malurus melanocephalus par Gould qui a maintenu sa forme comme une espèce distincte. Une forme intermédiaire du Nord du Queensland a été décrite comme M. pyrrhonotus.
Comme les autres mérions, le mérion à dos rouge est sans rapport avec le vrai roitelet (famille des Troglodytidae). Il a été précédemment classé dans la famille des Muscicapidae[2],[3] puis plus tard, dans celle des Sylviidae[4] avant d'être placé dans la famille des Maluridae reconnue en 1975[5]. Récemment, les analyses d'ADN ont montré que la famille des Maluridae était liée à la famille des Meliphagidae et des Pardalotidae regroupées dans la superfamille des Meliphagoidea[6],[7]
Dans les Maluridae, c'est l'une des treize espèces du genre Malurus. Elle est très étroitement liée au mérion leucoptère, avec laquelle ils forment un clade phylogénétique et avec le mérion à épaulettes de Nouvelle-Guinée qui est leur parent le plus proche. Surnommées le « troglodytes bicolores » par l'ornithologue Richard Schodde, ces trois espèces sont remarquables par leur absence de dessins sur la tête et de touffes d'oreille et la couleur bleue ou noire dominante de leur plumage contrastant avec celle de l'épaule ou de l'aile ; elles se remplacent l'une l'autre géographiquement dans le nord de l'Australie et la Nouvelle-Guinée.
Sous-espèces
George Mack, ornithologue au musée de Melbourne, a été le premier à classer les trois formes melanocephalus, cruentatus et pyrrhonotus comme une seule espèce, mais Richard Schodde classa pyrrhonotus comme un hybride des deux premiers vivant dans une zone du nord du Queensland délimitée par les fleuves Burdekin, Endeavour et Norman. Les mâles reproducteurs qui ont un plumage intermédiaire, avec une plus grande taille et un dos écarlate ou une taille plus petite et un dos d'un orange soutenu, ainsi que des formes qui ressemblent à l'un des deux sous-espèces parentes, sont toutes rencontrées en son sein. Une étude moléculaire publiée en 2008 et mettant l'accent sur la population du cap York a constaté qu'elle était génétiquement plus proche de la sous-espèce des forêts de l'Est que de la forme du grand nord. Ces oiseaux sont devenus distincts il y a environ 0,27 million d'années, avec par la suite quelques flux de gènes venant des oiseaux de l'Est.
Deux sous-espèces sont reconnues :
- M. m. melanocephalus, la sous-espèce nominale, a le dos orange et la queue plus longue et se trouve depuis la côte nord de la Nouvelle-Galles du Sud jusqu'au Nord du Queensland.
- M. m. cruentatus se trouve partout dans le Nord de l'Australie depuis le Kimberley jusque dans le Nord du Queensland. Il est plus petit que la sous-espèce nominale, les mâles pesant en moyenne 7,1 g et les femelles 6,6 g. Les mâles en plumage nuptial de l'île Melville ont une couleur pourpre de leur dos. Le nom d'espèce cruentatus veut dire « taché de sang » en latin.
Histoire évolutive
L'ornithologue Richard Schodde a proposé que les ancêtres des deux sous-espèces aient été séparés au cours de la dernière période glaciaire au Pléistocène il y a environ 12 000 ans. La sècheresse repoussa les prairies préférées des Mérions vers le nord et lorsque les conditions devinrent plus humides et chaudes ces formes redescendirent vers le sud et rencontrèrent la forme orientale, au nord du Queensland et des formes intermédiaires apparurent.
La distribution des trois espèces de mérions bicolores montre que leurs ancêtres ont vécu en Nouvelle-Guinée et dans le Nord de l'Australie à une période où le niveau de la mer était plus bas et les deux régions reliées par un pont terrestre. Les populations ont été séparées lorsque le niveau de la mer a monté, les oiseaux de Nouvelle-Guinée ont évolué vers le mérion à épaulettes et les formes australiennes vers le mérion à dos rouge et le mérion leucoptère bien adapté aux zones arides.
Description
Plus petit membre du genre Malurus, le mérion à dos rouge mesure 11,5 cm et pèse entre 5 et 10 g avec un poids moyenne d'environ 8 g. La longue queue de 6 cm est noire chez le mâle reproducteur et brune chez les mâles non reproducteurs, les femelles et les juvéniles. Le bec est relativement long (8,6 mm en moyenne), étroit et pointu et large à la base, plus large que long, ayant une forme similaire à celui d'autres oiseaux qui se nourrissent en cherchant et en ramassant les insectes dans leur environnement.
Comme les autres mérions, le mérion à dos rouge est remarquable pour son dimorphisme sexuel marqué : le mâle adopte pleinement son plumage nuptial dans sa quatrième année, soit plus tard que tous les autres mérions en dehors de son parent le mérion leucoptère. Le mâle en plumage de reproduction a la tête et le corps noir contrastant avec le dos rouge et les ailes brunes. Quelquefois, il a la partie supérieure du corps brun et le ventre blanc. Certains mâles, surtout les plus jeunes, restent en plumage d'éclipse même en période de reproduction. La femelle ressemble est remarquablement similaire avec le mâle non reproducteur avec un corps chamois et une tache jaune sous les yeux. La femelle de cette espèce diffère de celles des autres espèces de mérions en ce qu'elle manque d'une teinte bleue dans la queue. Sur le plan géographique, elle suit la règle de Gloger ; les femelles ont un ventre plus pâle et le dessus plus clair dans les régions les plus ensoleillées. Les jeunes des deux sexes ressemblent beaucoup aux femelles.
Vocalisations
Le chant typique utilisé par le mérion à dos rouge pour se faire entendre sur son territoire est semblable à celui des autres Mérions, à savoir une ritournelle constituée d'une période d'introduction suivie de courts segments répétitifs, en commençant faiblement et doucement et en terminant fort et en poussant des cris de plusieurs unités simples. L'appel est utilisé essentiellement par le mâle pendant la saison d'accouplement. Les oiseaux communicant entre eux lorsqu'ils sont en quête de nourriture avec une ssst mou, à peine audible au-delà de 10-15 m de distance. Le cri d'alarme est un zit aigu.
Distribution et habitat
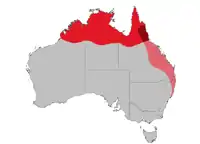
Le Mérion à dos rouge est endémique en Australie où on peut le trouver le long des rivières et des côtes depuis le cap Keraudren au nord-ouest de l'Australie-Occidentale, dans le Kimberley, la Terre d'Arnhem, le pays du Golfe, le cap York, avec la chaîne de Selwyn et le cours supérieur du fleuve Flinders en tant que limite sud. On le trouve aussi sur les îles voisines au large : Groote Eylandt, Sir Edmund Pellew, Fraser, Melville et Bathurst. On le trouve aussi tout le long de la côte est, à l'est de la Cordillère australienne jusqu'au niveau du fleuve Hunter en Nouvelle-Galles du Sud [27], où il préfère les zones humides, herbeuses tropicales et subtropicales, avec de hautes herbes, comme Imperata cylindrica, une espèce de sorgho, et Eulalia. Ce n'est pas un migrateur vrai même s'il peut se déplacer localement en raison des changements dans la végétation et quitter son territoire après la saison de reproduction. [24] L'espèce se retirera dans les zones résistant aux incendies au moment des feux [28].
Il évite les habitats arides et est remplacé, au sud de son aire de répartition, par le mérion leucoptère[29].
Mode de vie
Le mérion à dos rouge est un oiseau diurne qui devient actif à l'aube et à nouveau, par périodes, pendant la journée. Quand ils ne sont pas à la recherche de nourriture, les oiseaux se regroupent. Ils se reposent côte à côte dans un couvert dense et entreprennent un lissage mutuel de plumes. [30] Leur forme habituelle de locomotion est le sautillement, les deux pieds quittant puis touchant le sol simultanément. Leur équilibre est assisté par la queue relativement longue, qui se tient généralement debout et est rarement au repos. Leurs ailes courtes et arrondies leur permettent de s'envoler facilement et sont utiles pour les vols de courte durée mais pas pour des escapades prolongées. [32] Ils volent généralement en ondulant sur un maximum de 20 à 30 m [28].
Dans les hautes prairies sèches des zones de mousson, les changements dans la végétation peuvent est si grands en raison soit des incendies soit de la croissance des plantes en saison humide que les oiseaux peuvent être nomades et les mérions changer de territoires plus souvent que d'autres [28]. Ailleurs, comme dans les zones côtières, ils ont des territoires plus stables. [28] L'élevage coopératif est moins fréquent avec cette espèce qu'avec les autres mérions. Des aides ont été rapportées de façon sporadique, mais le comportement du mérion à dos rouge a été peu étudié sur ce sujet [33].
Tant les Mérions à dos rouge adultes, mâles ou femelles, savent utiliser la rodent run, la « course du rongeur » pour éloigner les prédateurs des nids avec des jeunes oiseaux. La tête, le cou et la queue sont baissés, les ailes sont tendues et les plumes ébouriffées pendant que l'oiseau court rapidement sur le sol en poussant des cris d'alarme continus [34].
Alimentation
Comme les autres mérions, le mérion à dos rouge est essentiellement insectivore, il mange une grande variété d'insectes, dont des coléoptères, des sauterelles, des papillons, des guêpes et des cigales. Ils mangent aussi des larves et des œufs d'insectes ainsi que des araignées. Les graines et autres végétaux ne représentent qu'une très faible proportion de leur alimentation. [35] On peut les surprendre à chasser les insectes dans les litières de feuilles, sur les arbustes et sur les bords des plans d'eau, surtout le matin ou tard l'après-midi.
Cour et reproduction
Au moment de la saison d'accouplement, le mâle mue, perd son plumage brun et affiche un plumage d'un rouge flamboyant. Il peut hérisser les plumes de son dos rouge et de ses épaules de telle sorte qu'elles couvrent une partie des ailes, lui donnant un aspect de boule de plumes. Il va voler et affronter un autre mâle pour le repousser ou pour faire valoir une position dominante sur une femelle. [33] [36] Il prend aussi des pétales rouges et parfois des graines rouges pour les présente à d'autres oiseaux. 90 % du temps, le mâle les présente à une femelle dans ce qui semble être un rituel de séduction. Les autres 10 % du temps, il les présente à un autre mâle dans un geste d'agression manifeste. [37]
Plus de la moitié des mérions à dos rouge d'un secteur peuvent se retrouver en couple durant la saison d'accouplement. C'est apparemment une défense contre la nature limitée des ressources de l'environnement. Il est plus difficile de maintenir un groupe interdépendant plus important pendant les périodes de sécheresse, de sorte que les oiseaux cherchent à rester en couples ou en petits groupes comprenant des adultes qui aident les parents à s'occuper de jeunes. [38] Les tests de paternité ont montré qu'un mâle plus âgé au plumage brillant a beaucoup plus de succès dans la saison d'accouplement avec plusieurs femelles. Par conséquent, il a une plus grande quantité de sperme et plus de possibilité de s'accoupler avec les femelles. Un mâle au plumage plus brun et moins brillant ou un mâle plus jeune au plumage brillant a un taux beaucoup plus faible de succès qu'un mâle brillant, plus âgé pour l'accouplement. [39] En outre, un mâle célibataire sert comme auxiliaire à un couple dans l'alimentation et les soins des jeunes. Quand un mâle s'accouple, son bec s'assombrit pendant trois semaines. Cela est beaucoup plus facile à contrôler que le plumage, qui prend plus de temps pour changer et est sous le contrôle des saisons. Le bec est vascularisé et peut changer beaucoup plus facilement de couleur à la suite d'accouplements[40].
La saison de reproduction dure d'août à février et coïncide avec l'arrivée de la saison des pluies dans le Nord de l'Australie. La femelle construit l'essentiel du nid, mais le mâle peut l'aider ce qui est inhabituel pour le genre Malurus [36]. Caché sous des touffes d'herbe ou de petits arbustes, le nid sphérique est fait d'herbes sèches et généralement doublé de petites herbes plus fines et de poils. [41] On a observé que, dans le sud du Queensland, les nids ont tendance à être plus importants et plus en désordre que dans le Nord de l'Australie, les premiers mesurant 12 à 15 cm de hauteur sur 9 à 12 cm de large avec une entrée en partie couverte de 3 à 6 cm de diamètre, [42], tandis que les derniers mesurent en moyenne autour de 10 à 13 cm de haut sur 6 à 8 cm de large avec une entrée 2 à 4 cm. [36] La construction prend environ une semaine, et il peut y avoir un intervalle pouvant aller jusqu'à sept jours avant que les œufs soient pondus. [36] Les œufs pondus sont blancs avec des taches brun-rougeâtre en groupes de trois à quatre, [41] et mesurent 14,5-17 x 10-13 mm, ceux de la sous-espèce melanocephalus étant un peu plus gros que ceux de cruentatus [36]. Les œufs sont couvés pendant deux semaines par la femelle seule. Les oisillons sont cachés sous le couvert pendant une semaine après l'éclosion. Les jeunes dépendent des parents et des aides pour environ un mois. Ils apprennent à voler entre 11 et 12 jours après l'éclosion. Les oisillons éclos plus tôt dans la saison vont contribuer à élever les couvées écloses plus tard. Ils resteront un groupe uni pendant la saison après l'éclosion. [24]
Les prédateurs et les menaces
Adultes et petits peuvent être la proie de mammifères comme le chat sauvage (Felis catus) et le renard roux (Vulpes vulpes), ainsi que d'autres espèces, [24] et d'oiseaux prédateurs indigènes, comme le cassican flûteur (Gymnorhina tibicen), les espèces de Cracticus, le martin-chasseur à ailes bleues (Dacelo leachii), les corneilles et corbeaux (Corvus spp.) et les Pitohuis (Colluricincla spp.) et de reptiles comme les goannas (Varanus spp.). [43 ]
Voir aussi
Références taxinomiques
- (en) Référence Congrès ornithologique international :
- (en) Référence Zoonomen Nomenclature Resource (Alan P. Peterson) : Malurus melanocephalus dans Maluridae
- (fr+en) Référence Avibase : Malurus melanocephalus (+ répartition)
- (en) Référence NCBI : Malurus melanocephalus (taxons inclus)
Liens externes
- (fr) Référence Oiseaux.net : Malurus melanocephalus (+ répartition)
- (en) Référence UICN : espèce Malurus melanocephalus Latham, 1802 (consulté le )
Notes et références
- (en) Liddell, Henry George et Robert Scott, A Greek-English Lexicon (Abridged Edition), United Kingdom, Oxford University Press, , 804 p. (ISBN 978-0-19-910207-5, LCCN 33031054)
- (en) Richard Bowdler Sharpe, Catalogue of the Passeriformes, or perching birds, in the collection of the British museum. Cichlomorphae, part1, Londres, Trustees of the British Museum,
- (en) Richard Bowdler Sharpe, Catalogue of the Passeriformes, or perching birds, in the collection of the British museum. Cichlomorphae, part4, Londres, Trustees of the British Museum,
- (en) Richard Bowdler Sharpe, A handlist of the genera and species of birds. Volume 4, Londres, British Museum,
- Richard Schodde, Interim List of Australian Songbirds : passerines, Melbourne, RAOU, (OCLC 3546788)
- (en) FK Barker, GF. Barrowclough, JG. Groth, « A phylogenetic hypothesis for passerine birds; Taxonomic and biogeographic implications of an analysis of nuclear DNA sequence data », Proc. R. Soc. Lond. B, vol. 269, , p. 295–308 (DOI 10.1098/rspb.2001.1883)
- (en) FK. Barker, A. Cibois, P. Schikler et all, « Phylogeny and diversification of the largest avian radiation », Proc. Natl. Acad. Sci. USA, vol. 101, no 30, , p. 11040–45 (PMID 15263073, DOI 10.1073/pnas.0401892101, lire en ligne [PDF], consulté le )
- Portail de l'ornithologie
- Portail de l’Australie