Menthofurane
Le menthofurane ou 4,5,6,7-tétrahydro-3,6-diméthylbenzofurane est un composé organique, un monoterpène bicyclique de formule C10H14O.
| Menthofurane | |
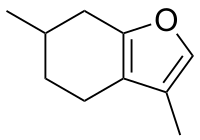
| |
| Identification | |
|---|---|
| Nom systématique | 3,6-dimethyl-4,5,6,7-tétrahydro-1-benzofurane |
| No CAS | (R) (S) |
| No ECHA | 100.007.087 |
| No CE | 207-795-5 |
| PubChem | 329983 329983 |
| ChEBI | 50542 |
| SMILES | |
| InChI | |
| Apparence | liquide bleuâtre à l'odeur similaire au menthol[1] |
| Propriétés chimiques | |
| Formule | C10H14O [Isomères] |
| Masse molaire[2] | 150,217 6 ± 0,009 3 g/mol C 79,96 %, H 9,39 %, O 10,65 %, |
| Propriétés physiques | |
| T° ébullition | 86 °C[3] 80 à 82 °C (17 hPa)[4] |
| Solubilité | insoluble dans l'eau, soluble dans les huiles. Misible à l'éthanol[1] |
| Masse volumique | 0,97 g·cm-3 (25 °C)[4] |
| Point d’éclair | 76 °C (coupelle fermée)[4] |
| Propriétés optiques | |
| Indice de réfraction | 1,485[4] |
| Pouvoir rotatoire | [4] |
| Écotoxicologie | |
| LogP | 4,290[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Occurrence naturelle
Le menthofurane est un composé phytochimique que l'on retrouve dans de nombreuses huiles essentielles, et en particulier celle des diverses espèces de menthe, notamment celle de la menthe pouliot (Mentha pulegium), de la menthe poivrée[5], mais aussi dans l'huile des feuilles d'Euodia hortensis forma hortensis[6].
Propriétés
Le menthofurane se présente sous la forme d'un liquide bleuâtre. insoluble dans l'eau mais soluble dans les huiles, dont l'odeur est similaire à celle du menthol[1]. Il est en 2000 considéré comme sans danger en tant qu'arôme alimentaire par la FAO et l' OMS[7], mais certaines sources le considèrent hautement toxique, la principale toxine présente dans la menthe pouliot, responsable de sa potentielle toxicité mortelle[8]. Plus précisément, il s'agirait de certains métabolites du menthofurane qui seraient hépatotoxiques[9].
Biosynthèse
Le menthofurane est produit biosynthétiquement à partir de la pulégone par l'enzyme menthofurane synthase (en).
-menthofuran_synthase_reaction.PNG.webp)
Synthèse
Le menthofurane peut être synthétisé à partir de la 5-méthylcyclohexane-1,3-dione et le bormure d'allenyldiméthylsulfonium via une furannélation en deux étapes, une addition d'énolate suivie d'un réarrangement[10].
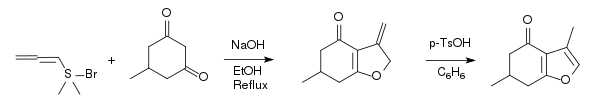
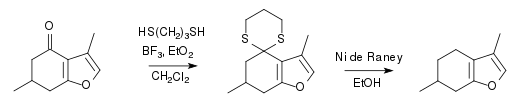
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Menthofuran » (voir la liste des auteurs).
- fiche FAO
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche (en) « Menthofurane », sur ChemIDplus, consulté le 25 septembre 2020.
- Fiche Sigma-Aldrich du composé aldrich / w323500 ?context=bbe 4,5,6,7-Tetrahydro-3,6-dimethylbenzofuran, consultée le 25 septembre 2020..
- (en) Matthias Güntert, Gerhard Krammer, Stefan Lambrecht, Horst Sommer, Horst Surburg, and Peter Werkhoff, Aroma Active Compounds in Foods, ACS Symposium Series, (ISBN 9780841236943, DOI 10.1021/bk-2001-0794.ch010), « Flavor Chemistry of Peppermint Oil (Mentha piperita L.) », p. 119-137
- Joseph J. Brophy, Mawardi Rahmani, Robert F. Toia, Kevin D. Croft, Erich V. Lassak, « The volatile oils of Euodia hortensis forma hortensis », Flavour and Fragrance Journal, vol. 1, no 1, , p. 17–20 (DOI 10.1002/ffj.2730010105)
- (en) « Evaluations of the Joint FAO/WHO Expert Committee on Food Additives (JECFA) for Menthofuran », sur World Health Oerganization, (consulté le ).
- Anderson IB, Mullen WH, Meeker JE, Khojasteh-BakhtSC, Oishi S, Nelson SD, Blanc PD, « Pennyroyal toxicity: measurement of toxic metabolite levels in two cases and review of the literature », Annals of Internal Medicine, vol. 124, no 8, , p. 726–34 (PMID 8633832, DOI 10.7326/0003-4819-124-8-199604150-00004)
- Thomassen D, Knebel N, Slattery JT, McClanahan RH, Nelson SD, « Reactive intermediates in the oxidation of menthofuran by cytochromes P-450 », Chemical Research in Toxicology, vol. 5, no 1, , p. 123–30 (PMID 1581528, DOI 10.1021/tx00025a021)
- Mariko Aso, Mizue Sakamoto, Narumi Urakawa et Ken Kanematsu, « Furannulation strategy. An efficient synthesis of fused 3-methylfurans », Heterocycles, vol. 31, no 6, , p. 1003–6 (DOI 10.3987/com-90-5392)
- Portail de la chimie