Éléphant de mer du sud
Mirounga leonina

Répartition géographique
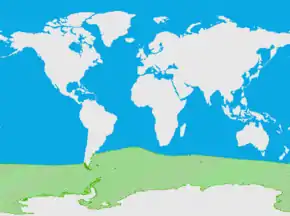
de l'éléphant de mer du sud

LC : Préoccupation mineure
Statut CITES
L'éléphant de mer du sud (Mirounga leonina) qui peut peser jusqu'à 3,7 tonnes, est le plus grand des pinnipèdes. Il fréquente les mers australes, depuis l'Antarctique jusqu'au sud des autres continents, et se reproduit à terre sur les plages des îles sub-antarctiques. Les études de suivi par satellite ont révélé ses compétences extraordinaires de voyageur océanique et de plongeur.
Il fut chassé intensément au cours du XIXe siècle et dans une moindre mesure jusqu'au milieu du XXe siècle. Menacé alors d'extinction, les effectifs se sont aujourd'hui en partie reconstitués mais connaissent des fluctuations encore inexpliquées.
Description physique


Très proche parent de l'espèce nord-américaine (Mirounga angustirostris), l'éléphant de mer du sud s'en distingue par un corps en moyenne plus massif et par un museau plus large.
Le dimorphisme sexuel est très marqué : les mâles adultes sont 3 à 4 fois plus gros que les femelles. Les plus grands individus mâles peuvent peser jusqu’à 3,7 tonnes et mesurer plus de 6 mètres, mais en général les mâles ont une masse moyenne d'environ 2 tonnes et une longueur de 4 mètres, contre 500 kg et 2,70 m en moyenne pour les femelles.
Les narines se développant chez les mâles dominants en forme de trompe, cette particularité est à l'origine du nom d'éléphant de mer[1]. Cette trompe (ou proboscis) est mise en évidence et se gonfle pour faire caisse de résonance lorsque l'animal éructe ou rugit afin d'affirmer son autorité.
Les yeux sont grands, ronds et noirs. Cette grosseur des yeux et le fait qu'ils possèdent une forte concentration en pigments adaptés à la vision en faible luminosité, sembleraient indiquer que la vue joue un rôle important dans la capture des proies en profondeur.
Comme tous les phoques, les éléphants de mer ont des membres postérieurs atrophiés dont seules les extrémités se sont développées pour former avec la queue une nageoire caudale. Chacun des “pieds” demeure cependant bien distinct et peut se déployer en éventail montrant ainsi les cinq longs doigts qui soutiennent la palmure. Cette double palme, très agile, sert à la propulsion aquatique. L'animal l'utilise généralement en position verticale à la manière des poissons. Les nageoires pectorales sont en revanche très peu employées lors de la nage.
Alors que les membres postérieurs sont devenus impropres à toute locomotion à terre, les éléphants de mer utilisent pour se déplacer sur les plages leurs membres antérieurs qui bien que transformés en palettes natatoires, leur permettent de prendre appui au sol pour propulser leur corps, faisant suivre à la traîne le ventre et l'arrière-train. Ils sont capables d'effectuer de cette manière sur de courtes distances des déplacements rapides, afin de gagner la mer, de rattraper une femelle ou de chasser un intrus. Si l'intrus est un être humain, il est alors obligé de courir ce qui permet d'estimer que la vitesse de déplacement à terre peut atteindre 8 km/h [2].

Les petits naissent avec une fourrure, le lanugo, entièrement noire[3], inadaptée à l'eau mais qui par sa densité protège les nourrissons de la fraîcheur de l'air ambiant. La première mue accompagne le sevrage. La couleur des pelages qui se suivent ensuite au cours de la vie et qui sont désormais très ras varie entre le gris et le brun, selon l'épaisseur et l'humidité des poils. Chez les vieux mâles, la peau prend l'aspect d'un cuir épais décoloré qui porte les nombreuses balafres laissées par les combats entre rivaux.
Les éléphants de mer possèdent sous la peau une épaisse couche de gras qui les isole du froid dans l'eau et qui constitue aussi une réserve énergétique pour les longues traversées océaniques ou pour les périodes de jeûne à terre. L'importance des réserves de graisse varie grandement selon la saison et l'état physiologique de l'animal. Elle peut servir à caractériser la suffisance des ressources alimentaires et influe sur la flottabilité d'un individu (gras il a tendance à remonter vers la surface, maigre il a tendance à couler). C'est cette couche de gras, dont l'épaisseur peut dépasser dix centimètres, qui faisait la convoitise des chasseurs phoquiers. Ils la faisaient fondre et la transformaient en huile.
Comme les autres phoques, les éléphants de mer ont une circulation sanguine adaptée au froid. Elle a la particularité (dite rete mirabile) d’être constituée (sous le derme) par un mélange de petites veines entourant les artères. Ces veines bénéficient ainsi de la chaleur dégagée par les artères, ce qui réduit les pertes de chaleur. Cette structure est particulièrement présente dans les zones les plus isolées, comme les pattes arrière.
Comme de nombreux autres membres de l'ordre des carnivores, les éléphants de mer ont des « moustaches » sensitives, les vibrisses. Celles-ci semblent leur permettre de percevoir les vibrations de l'eau, et par là même de se diriger dans des eaux sombres et à faible visibilité.
Populations

La population mondiale serait comprise entre 600 000[4] et 740 000[5] individus. Les études de suivi des populations et de marquage ont démontré l'existence de sous-populations géographiques propres à chacun des trois océans[6].
Le pistage au moyen de balises Argos a permis de suivre les itinéraires parcourus par les éléphants de mer et ainsi de montrer que les principales zones d'alimentation se situaient en bordure du continent antarctique pour les populations des océans Indien et Pacifique, mais restaient cantonnées au nord du front polaire pour la population de Géorgie du Sud[7]. S'il arrive que les éléphants de mer accostent occasionnellement en Antarctique pour se reposer ou même parfois pour y muer, ils se rassemblent surtout pour se reproduire en zone sub-antarctique, exception faite de quelques petites colonies avancées dont la plus proche du pôle est celle de l'île du Roi George dans les îles Shetland du Sud[8].
La sous-population la plus importante est celle de l'Atlantique Sud avec plus de 400 000 individus dont environ 350 000 se reproduisent en Géorgie du Sud, les autres colonies de reproduction se situant aux îles Malouines, sur la presqu'île de Valdés en Patagonie argentine, aux îles Sandwich du Sud, Orcades du Sud et Shetland du Sud, à l'île Bouvet et à l'île Gough (du groupe de Tristan da Cunha).
La deuxième sous-population, du sud de l'Océan Indien, compterait au maximum 200 000 individus dont les trois-quarts aux îles Kerguelen et le reste aux îles Crozet, Marion et Prince-Édouard, et Heard. Quelques individus se reproduisent aussi sur l'île Amsterdam.
La troisième sous-population, d'environ 75 000 individus, fréquente les îles sub-antarctiques de l'Océan Pacifique au sud de la Tasmanie et de la Nouvelle-Zélande, principalement l'île Macquarie.
Des colonies auraient par ailleurs existé autrefois en Tasmanie, à Sainte-Hélène et aux îles Juan Fernandez[9] au large du Chili.
Il arrive parfois que des individus au moment de la mue remontent jusqu'au Brésil, en Afrique du Sud ou en Australie. On signale également de temps à autre des animaux égarés sur les côtes de l'île Maurice[10] ou de La Réunion[11],[12].
Après la fin des grandes chasses phoquières du XIXe siècle, les éléphants de mer du sud ont recouvré des effectifs importants dès les années 1950, puis on a assisté à un déclin régulier et inexpliqué des sous-populations de l'Océan Indien et de l'Océan Pacifique. Les effectifs semblent aujourd'hui stabilisés sans qu'on ait encore compris les raisons de cette fluctuation. On a pu évoquer un phénomène de dépression à la suite d'une remontée démographique trop rapide par rapport aux ressources vitales, une modification du climat, une compétition avec les autres espèces dont les effectifs remontaient également, voire une influence néfaste des techniques de suivi scientifique[13].
Comportement
En mer : plongées et alimentation
Les éléphants de mer passent la plus grande partie de leur existence sous l'eau. Entre les périodes qu'ils passent à terre lors de la reproduction et de la mue, ils effectuent de longs voyages de recherche de nourriture pendant lesquels ils parcourent des milliers (jusqu'à plus de 5000) de kilomètres en mer[14].
Grâce aux suivis satellitaires, on s'est aperçu que les animaux restent très peu de temps en surface, en général quelques minutes pour refaire le plein d'oxygène[15]. Ils plongent sans cesse, à chaque fois pendant plus de vingt minutes, pour chasser leurs proies, calmars et poissons, entre 400 et 1 000 m de profondeur[16]. Les records de plongée ont été relevés à près de deux heures pour la durée[17] et à 1 998 m pour la profondeur[18]. Ils se reposent également en apnée en se laissant flotter entre deux eaux[15].
Par la durée, la profondeur et l'enchaînement des plongées, les éléphants de mer du sud (comme ceux du nord) sont les plus performants des phoques. À de nombreux points de vue, ils dépassent même la plupart des cétacés. Ces capacités hors normes résultent d'adaptations physiologiques, communes aux mammifères marins, mais particulièrement développées chez les éléphants de mer. La stratégie d'adaptation repose sur deux axes : augmenter le stockage d'oxygène, réduire sa consommation.
Ce ne sont guère les poumons qui assurent les réserves d'oxygène. De taille relativement modeste, ils sont d'ailleurs pendant les plongées vidés et comprimés, réduisant ainsi les effets nocifs des échanges gazeux sous pression notamment avec l'azote. L'oxygène est alors essentiellement stocké dans le sang où il est associé à l'hémoglobine des globules rouges, ainsi que de manière importante dans les muscles où il est retenu par la myoglobine. Les éléphants de mer ont un volume sanguin rapporté à la masse corporelle 2,5 fois supérieur à celui de l'homme, une plus grande concentration en hématies, une plus grande concentration en hémoglobine dans les hématies. Enfin leur rate joue aussi un rôle essentiel dans le stockage et la redistribution du sang. Il semble enfin qu'ils soient plus tolérants à l'accumulation d'acide lactique et soient capables de recourir à la production d'ATP par fermentation pour subvenir aux besoins énergétiques des cellules.
L'autre voie adaptative porte sur l'économie de dépense énergétique. La forme hydrodynamique du corps facilite la pénétration dans l'eau et pour plonger il suffit souvent de se laisser couler. Quant au flux sanguin, il se concentre sur les organes vitaux : cœur, système nerveux central tandis que la température corporelle chute de plus de 15 °C dans les parties périphériques du corps. Le ralentissement du rythme cardiaque, la bradycardie, est aussi particulièrement sensible.
En mer, les éléphants de mer semblent avoir un comportement. Les mâles semblent préférer aller se nourrir en bordure du continent antarctique alors que les femelles s'alimentent dans des régions plus au Nord de l'Océan austral, entre le front subantarctique et le front polaire[19]. Ils semblent aussi développer une spécialisation alimentaire individuelle, alors que les femelles restent des prédatrices plus généralistes[20]. Cette spécialisation chez les mâles est probablement causée par la pression de compétition spécifique aux aires de quête alimentaire des mâles[20]. Les individus semblent retourner chaque année sur les mêmes zones de chasse[21].
Les connaissances sur l'alimentation des éléphants de mer sont encore très partielles. On sait que leur régime est essentiellement composé de poissons (notamment des myctophidae)[22] et de calmars[23], capturés lors des plongées profondes. Bien que l'observation direct de l'alimentation des éléphants de mer ne soit pas possible en milieu pélagique, des études menées à partir de données d'accélérométrie et de bioluminescence sous-marine ont permis de montrer que les éléphants de mer semblent le plus souvent surprendre leurs proies car leurs tentatives de captures ne durent très longtemps[24]. Mais pour le moment, leur succès de capture n'a pas pu être évalué.
Des lavages d'estomacs réalisés en 1992 et 1993 sur la péninsule antarctique sur un échantillon d'individus [25] ont révélé grâce à l'identification des becs de céphalopodes retrouvés dans les contenus stomacaux la diversité des espèces avec une nette prédominance du calmar des glaces Psychroteuthis glacialis. Mais ces données localisées pourraient ne caractériser finalement que la composition de la ressource alimentaire du secteur. D'autres études sur le régime alimentaire ont été menées de 1999 à 2001 de manière indirecte en analysant la composition en acides gras de la graisse des éléphants de mer[26] et ont montré une prédation majoritaire en poissons lorsque les animaux circulent aux abords du continent antarctique et en calmars lorsqu'ils chassent en plein océan.
Bien que chassant dans l'obscurité des profondeurs, c'est en partie grâce à la vue que les éléphants de mer semblent repérer leurs proies. Les éléphants de mer n'ont pas développé de système d'écholocation à la manière des cétacés, mais on suppose que leurs vibrisses qui sont sensibles aux vibrations jouent cependant un rôle dans la recherche de nourriture.
Lorsqu'ils fréquentent les côtes sub-antarctiques ou antarctiques, les éléphants de mer peuvent aussi consommer des crustacés isopodes, des ascidies, du krill, des mollusques bivalves ou même quelques algues.
Les éléphants de mer ont peu de prédateurs. Ils peuvent être attaqués par les léopards de mer, les requins blancs ou par les orques. Ces dernières guettent en particulier les jeunes de l'année lors de leurs premiers bains de mer.
À terre : reproduction et mue


Véritables sous-marins des mers australes, les éléphants de mer comptent aussi parmi les phoques les plus « terrestres » puisqu'ils séjournent chaque année plusieurs semaines consécutives au sec. Ils reviennent le plus souvent à terre au même endroit, année après année.
Les femelles gagnent les plages sub-antarctiques dès le début du printemps austral, à partir du mois de septembre, pour mettre bas un seul petit. Généralement, la naissance est très rapide. Dès que la tête du bébé pointe hors de la matrice, la femelle lève les pattes et le petit est projeté hors du ventre de la mère. Aussitôt, celle-ci se tourne vers le nouveau-né en le mordillant, tandis que le rejeton cherche à téter. L'allaitement dure en moyenne 23 jours. Pendant toute cette période, la femelle jeûne. Les nouveau-nés qui pèsent environ 40 kg à la naissance atteignent 120 à 130 kg lorsqu'ils sont sevrés. La mère a, pendant cette période, considérablement maigri.
Avant même que toutes les naissances et les sevrages soient terminés, les mâles ont également rejoint les colonies. Les plus forts, appelés pachas, ont constitué leurs harems de plusieurs dizaines de femelles[1]. Ceux qui veulent les leur disputer les affrontent en combats singuliers. Les deux adversaires se cambrent et se laissent retomber de tout leur poids, canines en avant, l'un sur l'autre. L'issue est rarement fatale et le vaincu n'a plus qu'à s'enfuir. Cependant, sous les chocs, le cuir et la trompe de l'adversaire peuvent se déchirer. Les harems sont ainsi entourés de groupes de jeunes mâles ou de mâles dépités, qui à l'occasion tentent leur chance auprès des femelles les plus excentrées. Les pachas veillent en permanence à leur privilège sexuel et rappellent à l'ordre les resquilleurs éventuels par des éructations menaçantes ou si besoin par une poursuite. Bien qu'ils soient théoriquement matures dès l'âge de 4 ou 5 ans, les mâles peuvent en fait rarement s'accoupler avant 9 ou 10 ans.
En raison de leur considérable différence de poids, les éléphants de mer ne s'accouplent que côte à côte. Les femelles (plusieurs dizaines par mâle) n'excèdent pas 400 kilos et se tiennent contre le mâle. Elles sont fécondables quelques jours après avoir mis au monde.
Autour des colonies, des oiseaux de mer tels les skuas, les pétrels géants subantarctiques, les becs-en-fourreau circulent aussi en permanence à l'affût d'un bon repas fait d'un placenta, du cadavre d'un mâle blessé à mort, d'un petit malencontreusement écrasé par la charge d'un pacha.
Les femelles sont saillies dès la fin de l'allaitement. Les jeunes femelles ayant atteint l'âge de 3 ans sont également fécondées. Le développement de l'embryon ne commence pas immédiatement (l'ovocyte reste en dormance quelque temps). La gestation dure en effet 9 mois, mais il faut néanmoins que les naissances n'interviennent qu'environ un an plus tard, à la bonne saison[27].
Les jeunes qui sont sevrés se regroupent en pouponnières en attendant de perdre leur pelage de naissance, puis se mettent timidement à l'eau en commençant généralement leur apprentissage en eau douce dans les estuaires ou les mares d'arrière plage.
En été, les éléphants de mer viennent aussi à terre pour changer de pelage : c'est le temps de la mue. Celle-ci s'engage parfois directement après la reproduction. Certains mâles peuvent ainsi rester à terre plus de 3 mois sans se nourrir. Les éléphants de mer affectionnent particulièrement les bains de boue, souvent collectifs. Leurs passages répétés dans les souilles peuvent y creuser de véritables baignoires dans lesquelles plus d'un est resté piégé à mort. La mue semble occasionner une réelle fatigue et s'accompagne fréquemment d'écoulements nasaux purulents.
.JPG.webp) Crèche de jeunes juste sevrés.
Crèche de jeunes juste sevrés..JPG.webp) Apprentissage en eau douce des premiers bains.
Apprentissage en eau douce des premiers bains..JPG.webp) Bain de boue collectif de jeunes mâles lors de la mue.
Bain de boue collectif de jeunes mâles lors de la mue.
Chasses phoquières

La chasse traditionnelle par les populations indigènes est probablement à l'origine de la disparition de colonies d'éléphants de mer du sud en Tasmanie[28], en Nouvelle-Zélande[29] ou en Patagonie.
La chasse s'intensifie au XIXe siècle et s'effectue souvent dans le cadre d'expéditions à la fois phoquières et baleinières.
La graisse hypodermique (le fameux blubber des anglophones) sert en effet à la production d'une huile de phoque de très bonne qualité[30]. Quoique les cachalots soient alors les plus prisés pour la qualité de leur graisse, l'huile d'éléphant de mer (du sud comme du nord) montre son intérêt technique presque comparable ; ces gros et gras animaux sont incroyablement faciles à massacrer lorsqu'ils se rassemblent à terre pour la reproduction. Or l'industrie moderne qui prend son essor en Grande-Bretagne et aux États-Unis, qui ne dispose pas encore des produits issus du pétrole, a fort besoin d'huile : celle d'éléphant de mer est un excellent lubrifiant, brûle proprement, convient parfaitement pour assouplir les cuirs, peut servir à la fabrication de savon, de peinture ainsi qu'à d'autres usages.

Pour armer des expéditions, les américains sont de loin les plus nombreux. Aux îles Kerguelen, ce sont les quakers de Nantucket qui entreprennent les premières campagnes dès les dernières années du XVIIIe siècle[31].
La chasse à l'éléphant de mer se pratique à terre. Des équipes de marins arpentent les côtes à bord de chaloupes, abordent les plages occupées par les colonies, rabattent les animaux et les tuent avec des lances. Une équipe peut massacrer plus de cent animaux par jour. Les cadavres sont immédiatement découpés et les quartiers de gras sont rapidement mis à fondre dans des chaudrons soit sur le pont des navires, soit à terre. Dans ce dernier cas, il arrive que les équipes soient laissées sur les îles pendant plusieurs mois ou plusieurs années, dans des conditions de misère et de saleté épouvantables, les navires assurant de temps à autre la collecte des barils d'huile. Comme combustible pour la fonte de la graisse, il est pratique et économique d'utiliser des manchots, abattus sans vergogne et broyés[32].
Les grandes campagnes de chasse à l'éléphant de mer s'éteignent à la fin du XIXe siècle, par perte de rentabilité économique : raréfaction des animaux, concurrence des huiles minérales, modernisation des baleiniers. Des exploitations contrôlées persistent cependant encore au XXe siècle, jusqu'en 1961 aux îles Kerguelen et jusqu'en 1964 en Géorgie du Sud[33].
Statuts de protection

Les éléphants de mer du sud figurent à l'annexe II de la CITES depuis 1975. Cette citation est dans les faits devenue sans objet car l'espèce ne fait plus aujourd'hui l'objet de chasses ou de commerce. Alors que l'espèce septentrionale (Mirounga angustirostris) a été retirée en 1992 de la liste de l'annexe II, la révision du statut de Mirounga leonina, dont est chargée l'Australie, n'est pas encore effectuée.
L'éléphant de mer du sud est classé depuis 1996 sur la Liste rouge de l'UICN dans la catégorie de préoccupation mineure (LC)[34].
La plupart des législations nationales assurent néanmoins sa protection intégrale, notamment pour la France, l'arrêté interministériel du sur la protection des mammifères marins[35].
Étude des paléoclimats
Il a été trouvé sur le continent antarctique en bordure de la mer de Ross sur une côte aujourd'hui en permanence prise par les glaces, les preuves de la présence d'anciennes colonies d'éléphants de mer. Ces preuves sont essentiellement constituées par des fragments de peau et de pelage qui ont pu se détacher lors des phases de mue. Pour que des colonies aient pu exister dans ces régions, le climat y était alors nécessairement plus doux et la mer libre au moins pendant une bonne partie de l'année.
L'âge de ces vestiges est estimé entre 500 et 7 000 ans. Les études précises de datation sont donc susceptibles de donner des indications précieuses sur la variation des climats au cours des derniers millénaires[36].
Voir aussi
Références
- Institut polaire français - Paul Émile Victor : l'éléphant de mer austral
- Charles-André Bost, Christophe Guinet, Dominique Guinet, Benoît Lequette et Henri Weimerskirch, Sous les quarantièmes rugissants : Un sanctuaire sauvage, Éditions du Gerfaut, , 208 p. (ISBN 2-914622-37-6), p. 85
- (en) Thomas A. Jefferson, Stephen Leatherwood et Marc A. Webber, Marine mammals of the world : FAO species identification guide, Food and Agriculture Organization of the United Nations, coll. « United Nations Environment Programme », , 320 p. (ISBN 92-5-103292-0 et 9789251032923, lire en ligne), p. 287
- Seal Conservation Society (SCS) : Southern Elephant Seal (Mirounga leonina) (en)
- Southern elephants seals as oceanographic samplers (SEaOS) : Natural History: The life of the Southern Elephant Seal (en)
- Christophe Guinet, chargé de recherche au CEBC-CNRS sur le site Mercator Océan : Les éléphants de mer sondent l'océan Austral
- Christophe Guinet, chargé de recherches au CNRS : Les éléphants de mer « océanographes » de l'océan Austral
- Alejandro R. Carlini, Sebastian Poljak, Gustavo A. Daneri, Maria E. I. Marquez, Javier Negrete, The dynamics of male harem dominance in southern elephant seals (Mirounga leonina) at the South Shetland Islands (en)
- François Péron, Charles Alexandre Lesueur et Louis Freycinet, Voyage de découverte aux Terres australes : exécuté sur les corvettes le Géographe, la Naturaliste et la goëlette le Casuarina pendant les années 1800, 1801, 1802, 1803 et 1804, t. 2, Paris, Imprimerie royale, (lire en ligne), p. 38
- Journal de l'île de La Réunion du 27 août 2006
- Antenne Réunion : Un éléphant de mer prend ses quartiers à la Réunion (reportage du 6 août 2008)
- Association Globice : Alan le solitaire
- Seal Conservation Society : Southern Elephant Seal (Mirounga leonina) (en)
- (en) Mark A. Hindell, Clive R. McMahon, Marthán N. Bester et Lars Boehme, « Circumpolar habitat use in the southern elephant seal: implications for foraging success and population trajectories », Ecosphere, vol. 7, no 5, , e01213 (ISSN 2150-8925, DOI 10.1002/ecs2.1213, lire en ligne, consulté le )
- Charles-André Bost, Christophe Guinet, Dominique Guinet, Benoît Lequette et Henri Weimerskirch, Sous les quarantièmes rugissants : Un sanctuaire sauvage, Éditions du Gerfaut, , 208 p. (ISBN 2-914622-37-6), p. 129
- Charles-André Bost, Christophe Guinet, Dominique Guinet, Benoît Lequette et Henri Weimerskirch, Sous les quarantièmes rugissants : Un sanctuaire sauvage, Éditions du Gerfaut, , 208 p. (ISBN 2-914622-37-6), p. 161
- record enregistré à l'île Macquarie en 1988, vu sur Polaris : Southern elephant seal (Mirounga leonina) (en) selon référence : (en) MA Hindell, DJ Slip et HR Burton, « The diving behaviour of adult male and female southern elephant seals, Mirounga leonina (Pinnipedia : Phocidae) », Australian journal of zoology, no 39, , p. 595-619
- Futura-Sciences : Les éléphants de mer travaillent pour les océanographes, août 2008
- (en) Christophe Guinet, Jade Vacquié-Garcia, Baptiste Picard et Guillaume Bessigneul, « Southern elephant seal foraging success in relation to temperature and light conditions: insight into prey distribution », Marine Ecology Progress Series, vol. 499, , p. 285–301 (ISSN 0171-8630 et 1616-1599, DOI 10.3354/meps10660, lire en ligne, consulté le )
- Rebecca Lewis, Tamsin C O'Connell, Mirtha Lewis et Claudio Campagna, « Sex-specific foraging strategies and resource partitioning in the southern elephant seal (Mirounga leonina) », Proceedings of the Royal Society B: Biological Sciences, vol. 273, no 1603, , p. 2901–2907 (PMID 17015314, PMCID PMC1664629, DOI 10.1098/rspb.2006.3642, lire en ligne, consulté le )
- (en) Corey J. A. Bradshaw, Mark A. Hindell, Michael D. Sumner et Kelvin J. Michael, « Loyalty pays: potential life history consequences of fidelity to marine foraging regions by southern elephant seals », Animal Behaviour, vol. 68, no 6, , p. 1349–1360 (ISSN 0003-3472, DOI 10.1016/j.anbehav.2003.12.013, lire en ligne, consulté le )
- (en) Y. Cherel, S. Ducatez, C. Fontaine et P. Richard, « Stable isotopes reveal the trophic position and mesopelagic fish diet of female southern elephant seals breeding on the Kerguelen Islands », Marine Ecology Progress Series, vol. 370, , p. 239–247 (ISSN 0171-8630 et 1616-1599, DOI 10.3354/meps07673, lire en ligne, consulté le )
- (en) G. A. Daneri, A. R. Carlini et P. G. K. Rodhouse, « Cephalopod diet of the southern elephant seal, Mirounga leonina, at King George Island, South Shetland Islands », Antarctic Science, vol. 12, no 1, , p. 16–19 (ISSN 1365-2079 et 0954-1020, DOI 10.1017/S0954102000000031, lire en ligne, consulté le )
- Pauline Goulet, Christophe Guinet, Claudio Campagna et Julieta Campagna, « Flash and grab: deep-diving southern elephant seals trigger anti-predator flashes in bioluminescent prey », Journal of Experimental Biology, vol. 223, no 10, , jeb222810 (ISSN 0022-0949, PMID 32430464, PMCID PMC7322542, DOI 10.1242/jeb.222810, lire en ligne, consulté le )
- (en) Uwe Piatkowski and Daniel F. Vergani, Prédation de céphalopodes par les éléphants de mer du sud (Mirounga leonina) à Stranger Point, King George Island, Antarctique
- (en) Bradshaw CJ, Hindell MA, Best NJ, Phillips KL, Wilson G, Nichols PD Vous êtes ce que vous mangez : description de l'écologie alimentaire des éléphants de mer du sud (Mirounga leonina) grâce aux acides gras de la couche adipeuse Université de Tasmanie
- Charles-André Bost, Christophe Guinet, Dominique Guinet, Benoît Lequette et Henri Weimerskirch, Sous les quarantièmes rugissants : Un sanctuaire sauvage, Éditions du Gerfaut, , 208 p. (ISBN 2-914622-37-6), p. 86
- (en) M.M. Bryden, S. O'Connor et Rhys Jones, « Archaeological evidence for the extinction of a breeding population of elephant seals in Tasmania in prehistoric times », International journal of osteoarchaeology, vol. 9, no 6, , p. 430-437 (résumé)
- New Zealand historic places Trust (Pouhere Taonga) : Archaeological remains of middens and rubbish dumps (en)
- Arthur Mangin (ill. W. Freeman et Jules Noël), Les mystères de l'océan, Tours, Alfred Mame et fils, , 2e éd. (lire en ligne), p. 436
- Gracie Delépine, Les îles australes françaises : Kerguelen, Crozet, Saint-Paul, Amsterdam., Rennes, Éditions Ouest-France, , 212 p. (ISBN 978-2-7373-1889-4 et 2-7373-1889-0), p. 64-66
- Gracie Delépine, Les îles australes françaises : Kerguelen, Crozet, Saint-Paul, Amsterdam., Rennes, Éditions Ouest-France, , 212 p. (ISBN 978-2-7373-1889-4 et 2-7373-1889-0), p. 69-70
- Commission pour la Convention sur la conservation de la faune et la flore marines de l'Antarctique (CCAMLR) : Historique de l'exploitation de l'océan Austral, éléphant de mer austral
- The IUCN red list of threatened sepcies : Mirounga leonina (en)
- Legifrance : arrêté interministériel du 27 juillet 1995 sur la protection des mammifères marins
- (en) Étude des colonies abandonnées d'éléphant de mer du sud en tant qu'indicateurs des paléoclimats en Antarctique
Sources bibliographiques
Liens externes
- (en) Référence Mammal Species of the World (3e éd., 2005) : Mirounga leonina Linnaeus, 1758
- (en) Référence Tree of Life Web Project : Mirounga leonina
- (en) Référence Catalogue of Life : Mirounga leonina (Linnaeus, 1758) (consulté le )
- (en) Référence Paleobiology Database : Mirounga leonina (Linnaeus 1758)
- (fr+en) Référence ITIS : Mirounga leonina (Linnaeus, 1758)
- (en) Référence World Register of Marine Species : espèce Mirounga leonina (Linnaeus, 1758)
- (en) Référence Animal Diversity Web : Mirounga leonina
- (en) Référence NCBI : Mirounga leonina (taxons inclus)
- (en) Référence UICN : espèce Mirounga leonina (Linnaeus, 1758) (consulté le )
- (en) Référence CITES : espèce Mirounga leonina (Linnaeus, 1758) (+ répartition sur Species+) (consulté le )
- (fr) Référence CITES : taxon Mirounga leonina (sur le site du ministère français de l'Écologie) (consulté le )
- CCAMLR (Convention on the Conservation of Antarctic Marine Resources) (en)(es)(fr)
- AMAPOF (Amicale des Missions Australes et Polaires Françaises) (fr)
- MYSTERRA Magazine : reportage sur les éléphants de mer aux îles Malouines (fr)
- SCS (Seal Conservation Society) (en)
- OBIS (Ocean Biogeographic Information System) (en)
- Australian Governement : list of threatened species (en)
- AWRU (Antarctic Wildlife Research Unit) (en)
- Re-assessment of the status of southern elephant seals in New Zealand in NZ marine research journal 1989 (en)
- CEBIMAR-USP (Centro de Biologia Marinha - Universidade de São Paulo) (pt)
- ESRG (Elephant Seal Research Group) (en)
- Combat d'éléphants de mer au cap Ratmanoff (Kerguelen) sur kerguelen-voyages.com (fr)
- Christophe Guinet CEBC-CNRS / SEaOS - Le Cercle Polaire Les éléphants de mer « océanographes » de l'océan Austral, 2007 (fr)
- Portail des mammifères
- Portail de l’Antarctique
- Portail des abysses
- Portail de la biologie marine