Modes de sélection naturelle
La sélection naturelle peut agir sur des traits de vie d’une population faisant varier les phénotypes de cette population afin de retrouver la meilleure valeur adaptative [1], où le phénotype le mieux adapté produira en moyenne la progéniture la plus nombreuse[2].
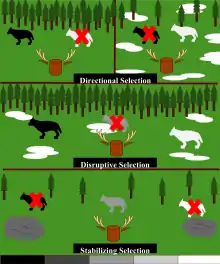
La relation entre le phénotype et la valeur adaptative est complexe et peut être modulée selon différents types de sélections. Dans cet article, il sera question des quatre types de sélections naturelles faisant pression sur les populations soit, les sélections directionnelle, divergente, stabilisante et équilibrante.
Représentation graphique
Pour bien représenter cette relation, une représentation graphique sera insérée à chaque sous-section de sélection (Figure1, Figure 4 et Figure 7) permettant de visualiser la fréquence d'un trait dans une population avant (graphiques à gauche) et après le type de sélection appliqué (graphiques à droite). Les graphiques du milieu représentent la relation entre le phénotype et la valeur adaptative selon la probabilité de survie des individus de la population [1]. Il est important lors de l'analyse des graphiques de bien évaluer la différence de la fréquence du trait avant et après la sélection. Ainsi, selon le type de pressions agissant sur une population, la distribution des phénotypes variera.
Sélection directionnelle
Comme représenté dans le graphique (Figure 1), ce type de sélection favorise les phénotypes extrêmes et ce, dans une direction ou une autre pour évoluer vers un optimum [3]. Ce type de sélection est souvent rencontré lorsqu’une population subit des changements extrinsèques, par exemple des changements environnementaux, ou si une partie de cette population émigre dans un nouvel habitat non identique à l’original[4].
Fabrication de la mâchoire chez les poissons Cichlidés


Un exemple de cette sélection est la fabrication de la mâchoire des poissons Cichlidés du Lac Malawi. Une recherche faite par Albertson et al. (2003) démontre qu’il y a sélection directionnelle sur des traits morphologiques, qui eux sont associés à une écologie divergente. En effet, il y a une variation du mode d’alimentation pour deux populations de ces poissons. Soit, les Labeotropheus fuelleborni (Figure 2) qui ont une bouche subterminale robuste et une longueur de mâchoire courte utilisée pour arracher les algues attachées dans les fonds marins. Alors que la population des Metriaclima zebra (Figure 3) a une bouche terminale avec une courte mâchoire utile pour se nourrir par succion de plancton dans les colonnes d’eaux.
L’étude démontre que la formation de ces deux types de mâchoires est régulée via une sélection directionnelle à la suite de la divergence alimentaire de ces deux populations. Il y a dans le génome différents éléments squelettiques appelés locus de caractères quantitatifs, ou QTL, venant affecter des variables géométriques et des mesures linéaires squelettiques. Ainsi, la variabilité et l’évolution de ces deux espèces pourraient être expliquées via une forte sélection divergente sur ces intervalles chromosomiques QTL chez l’ancêtre commun.
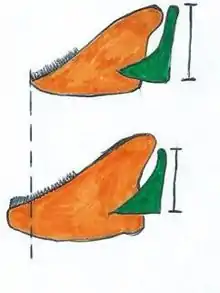
À la suite de cette divergence, le développement de la mâchoire selon le type d’alimentation suit une ligne directrice rapide afin d’atteindre un optimum dans chacun des deux types d’alimentation. Les chercheurs observent que les gènes QTL ont un effet sur la variabilité de la longueur et de la hauteur de la mâchoire inférieure. Ce phénomène démontre une pléiotropie où seulement un gène peut produire plusieurs phénotypes de mâchoires. Il est observé que le ratio entre la hauteur du bras ascendant de l’articulation et la longueur de la mâchoire régulera la vitesse et la force de fermeture de la mâchoire. Ainsi, pour le mode de nutrition par morsure, soit l’espèce Labeotropheus fuelleborni, un long processus articulaire et une courte mâchoire inférieure seront favorisés, permettant ainsi une forte fermeture. Tandis que pour l’espèce Metriaclima zebra, un court processus et une longue mâchoire inférieure affecteront la vitesse de rotation de la mâchoire et sera plus typique pour une alimentation par succion (Figure 4, où la mâchoire est orange et le processus articulaire vert).
Cette recherche démontre que la sélection directionnelle a fait en sorte de former la mâchoire des Cichlidés via les locus de caractères quantitatifs incrustés dans le génome afin d’obtenir un phénotype optimal. La diversité des types de mâchoires chez ces poissons est plutôt régulée par la diversité de leur mode d’alimentation à la suite d'une évolution adaptative divergente [5].
Sélection divergente ou disruptive
Ce type de sélection se produit lorsque les phénotypes extrêmes ont un avantage sur les intermédiaires qui seront diminués (Figure 5). Cette sélection peut potentiellement mener à une spéciation sympatrique, qui se produit sans isolement géographique [3]. Deux types différents de sélection divergente peuvent être observés.
Les types de sélections divergentes

Le premier n’amène pas la diversité. Par exemple, un consommateur se nourrit de petites et de grandes graines qui sont maintenues à un niveau constant défavorisant ainsi les phénotypes intermédiaires des consommateurs qui performeront moins bien sur les deux sources de graines. La sélection directionnelle agit ensuite sur la spécialisation des deux phénotypes extrêmes pour atteindre un optimal (Figure 6 du haut). Ce type décrit bien l’exemple précédent sur l’évolution de la mâchoire des Cichlidés.
La deuxième situation implique une variation de phénotype dans une population. Il y aura exploitation pour une ressource variée. Par exemple, l’abondance des semences allant de petites à larges sera influencée par le niveau de consommation de l’abondance à certains moments. Ainsi, l’individu de la population qui exploite le mieux la semence aura un avantage de remise et se dirigera vers un optimum. À un certain moment, la ressource sera épuisée et le phénotype ne sera plus favorisé. À ce moment, le phénotype qui diverge le plus avec l’optimum sera maintenant plus avantagé pour la nouvelle abondance, résultant à la divergence de la population. Ce type d’adaptation est maintenue jusqu’à ce la variation phénotypique augmente et où les ressources disponibles sont utilisées plus également. Ainsi, le type rare bénéficie d’un avantage à la suite de la diminution de la compétition avec la majorité (Figure 6 du bas) [6].
Variation extrême de la taille des poissons Épinoches
Comme l’explique Rueffler et al. (2006) le premier exemple de sélection divergente est la variation des tailles chez les poissons Épinoches. Où la plus petite espèce est spécialisée dans une alimentation de plancton, tandis que les plus larges se nourrissent de proies benthiques. Cette divergence serait expliquée par deux années consécutives d’invasion à la suite de changements du niveau de la mer. Où la première invasion par l’ancêtre planctivore, c’est-à-dire une alimentation basée sur le plancton, a évolué avec une alimentation intermédiaire entre le plancton et d'autres organismes. À la suite de la deuxième invasion des épinoches planctivores, l’ancien envahisseur a évolué dans la forme benthivore, c’est-à-dire une alimentation basée sur les organismes vivant dans les fonds marins. Cela est dû au déplacement du caractère d’alimentation qui résulte de la compétition dans un même milieu chez les individus [6].
Asymétrie mandibulaire chez les oiseaux à bec-croisé
.jpg.webp)
Un autre événement de divergence expliqué par Rueffler et al. (2006) est observé chez les oiseaux bec-croisé (Figure 7). Ces oiseaux ont une asymétrie mandibulaire à la suite de l’adaptation des graines dans les cônes de conifère. Cette asymétrie de la mâchoire inférieure peut être vers la droite ou vers la gauche selon l’orientation du cône. Ce polymorphisme dans le croisement du bec aurait été induit via une sélection négative sur les fréquences d’abondance des cônes. Ainsi, lorsqu’un type de cône fut moins disponible, cela a fait en sorte que le phénotype le moins adapté a été avantagé par l’autre type de cône. Il y a eu équilibre des formes de mâchoire à la suite d'une utilisation plus égale des cônes par les individus. Cet exemple représente bien le deuxième type de sélection divergente expliqué précédemment[6].
Sélection stabilisatrice
Contrairement aux deux autres types de sélection qui favorisaient les extrémités, la sélection stabilisatrice ou stabilisante élimine les phénotypes extrêmes pour favoriser les intermédiaires (Figure 8). Ceci a pour effet de diminuer la variance du caractère entre individus et de maintenir le statu quo relatif à un phénotype particulier [4].
Masse corporelle équilibrante chez les oiseaux sociables
Un exemple très simple qui démontre cette sélection est expliqué par Covas et al. (2002) concernant la masse corporelle chez les oiseaux sociables, Philetairus socius. La sélection d’une masse intermédiaire serait un compromis entre les risques de famines liées à une faible masse et les risques de prédation pour une masse corporelle élevée. Les risques de famine sont surtout retrouvés pour des environnements en hautes altitudes pouvant générer des nuits froides ou des tempêtes de neige, rendant ainsi la nourriture inaccessible. Ainsi, les oiseaux de petite masse corporelle ont moins de réserves énergétiques accumulées et donc moins de chance de survie lors de ces situations. Ensuite, les oiseaux avec une masse corporelle élevée amène le désavantage de porter tout ce poids et ce, surtout lors de la présence de prédateurs.
En effet, en étant plus lourd, cela rend l’oiseau moins agile pour éviter le prédateur. De plus, une augmentation de la masse est proportionnelle à la dépense énergétique pour maintenir le métabolisme élevé. Donc amène une plus grande dépense énergétique pour maintenir le métabolisme, au lieu d’utiliser cette énergie pour se reproduire et pour maintenir sa valeur adaptative. Il est important de mentionner que ces résultats sont obtenus sur une population sédentaire où une petite variation sur la population peut avoir un effet significatif sur les survivants[7].
Galle chez le blé Solidago altissima produite par la mouche Eurosta solidaginis

Un autre exemple de sélection stabilisante a été décrit par Arthur Weis et Warren Abrahamson (1986), et concerne la formation d’une galle sur la plante, Solidago altissima, par les larves de la mouche Eurosta solidaginis comme moyen de protection (Figure 9). La femelle de ces mouches injecte des œufs à l’intérieur d’un bourgeon de la plante. À la suite de l’éclosion, les mouches larvaires restent dans la tige et pour se protéger, induisent au blé la formation d'une galle protectrice. Cependant, les larves sont sujettes à deux types de prédateurs. Comme première espèce, des guêpes femelles parasitaires vont venir injecter leurs œufs dans les galles à l’endroit où se retrouvent les mouches larvaires. Ainsi, les larves de guêpes pourront manger celles des mouches. La deuxième espèce est un oiseau qui va repérer la galle et la fracturer pour y manger les larves de mouche.
Les scientifiques remarquent que les grandeurs des galles en diamètre dépendent des variations génétiques de la taille chez les mouches larvaires. Il y a stabilisation de la taille des galles qui résulterait de deux sélections directionnelles induites par les guêpes et les oiseaux. En effet, les guêpes favorisent des galles larges pour injecter leurs œufs tandis que les oiseaux favorisent les petites galles. Cette stabilisation de la taille des galles est donc avantageuse pour les mouches larvaires ayant une taille moyenne, résultant à un meilleur taux de survie et donc une meilleure valeur sélective [8].
Sélection équilibrante
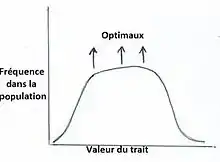
Ce type de sélection rare amène une maintenance de polymorphisme dans une population. Il y a donc plusieurs phénotypes optimaux pour différents traits (Figure 10).
Polymorphisme chez le crabe Cancer productus

Un cas est expliqué par Krause-Nehring et al. (2010) concernant la diversité de couleurs et de formes des carapaces juvéniles des crabes Cancer productus (Figure 11). Ce polymorphisme serait, selon les chercheurs, quelque chose d’adaptatif face aux prédateurs, soit les chiens de mer, les poissons flétan et chabot, anguilles, les poulpes ainsi que les oiseaux où la prédation est restreinte au stade juvénile du crabe. De plus, le polymorphisme est dépendant de la grandeur du crabe puisqu’il disparait lors du stade adulte.
Ainsi, des petits crabes sont beaucoup plus vulnérables pour les prédateurs visuels tels que les oiseaux et les poissons, d’où l’importance pour les crabes juvéniles de s’adapter à leur environnement afin de se camoufler. Les scientifiques adoptent l’hypothèse qu’une sélection équilibrante sur la coloration pourrait expliquer ce polymorphisme puisque cela est clairement bénéfique pour un environnement hétérogène comme le Pacifique du Nord. Un des mécanismes pouvant provoquer cette sélection est la sélection négative sur les fréquences dépendantes où à cause de mutations, les individus différents des autres peuvent être ignorés des prédateurs. En effet, les prédateurs visuels auront développé une image référence basée sur la proie prise auparavant. Ainsi, lorsqu’ils se déplacent dans d’autres milieux, ils auront plus de chances de manquer les autres formes de morphologies dans une population polymorphique menant à un meilleur taux de survie chez l’espèce proie[9]. (Figure 7)
Conclusion
Ces types de sélections naturelles ne sont pas immobiles dans le temps. En effet, les populations sont constamment en train de s’adapter à leur environnement afin d’être dotées de caractères favorables à leur survie et donc à leur reproduction. Le dynamisme est d’ailleurs démontré dans l’exemple sur la formation de la mâchoire chez les Cichlidés où on retrouve un type de sélection divergente à la suite de la variation du type d’alimentation suivi d’une sélection directionnelle afin que l’espèce soit le mieux adaptée à son type d’environnement. Il est aussi démontré dans l’exemple de sélection stabilisante, où la tige de blé subit des pressions de sélections directionnelles par deux animaux. Ainsi, elle évoluera sous une sélection stabilisante pour satisfaire aux deux espèces venant aussi stabiliser la taille des mouches larvaires parasitaires qui auront une meilleure sélection pour des tailles moyennes. La bonne adéquation entre un organisme et son milieu peut devenir une cible mouvante rendant l’évolution adaptative, un processus dynamique continu[10].
Bibliographie
- R.C. Albertson, J.T.Streelman, T.D. Kocher, Directional selection has shaped the oral jaws of Lake Malawi cichlid fishes, Proceedings of the National Academy of Sciences of the Unided States of America, 10(9), 2003, p. 5252-5257
- R. Cova, C.R. Brown, M.D. Anderson, M. Bomberger Brown, Stabilizing selection on body mass in the sociable weaver Philetairus socius, The royal society, 269, 2002, p. 1905-1909
- S. Freeman, J. C. Herron, Evolutionary analysis (2e édition), Upper Saddle River : Prentice Hall, 2001, 704 p.
- J. Krause-Nehring, J.M. Starck, A.R. Palmer, Juvenile colour polymorphisme in the red rock crab, Cancer productus : patterns, causes, and possible adaptative significance, Zoologie, 113(3), 2010, p. 131-139
- J. Prunier, Étude de l’adaptation au niveau moléculaire chez l’épinette noire (Picea mariana [MILL.] B.S.P.), thèse, (science du bois et de la forêt), Université Laval, 2012, p. 3-6
- P.H. Raven, G.B. Jonhson, K.A. Mason, J.B. Losos, Biologie (2e édition), Bruxelles : De Boeck supérieur, 2011, 1406 p
- J. Reece, L. Urry, M. Cain, S. Wasserman, P. Minorsky, R. Jackson, Campbell Biologie (4e édition), San Francisco : Pearson Education, 2012, 1458 p.
- C. Rueffler, T.J.M. Van Dooren, O. Leimar, P.A. Abrams, Disruptive selection and then what. Trends in Ecology and Evolution, 21(5), 2006, p. 238-245
Notes et références
- (en) Scott Freeman et Jon.C Herron, Evolutionary analysis (2nd ed), Upper Saddle River, , 704 p., p. 241.
- P.H. Raven, G.B. Jonhson, K.A. Mason et J.B. Losos, Biologie (2e édition), De Boeck supérieur, , 1406 p., p. 405.
- Julien Prunier, Étude de l’adaptation au niveau moléculaire chez l’épinette noire (Picea mariana [MILL.] B.S.P.), Université Laval, , 190 p., p. 4,5,6.
- J. Reece, L. Urry, M. Cain, S. Wasserman, Minorsky P. et Jackson R., Campbell Biologie (4e édition), Pearson Education, , 1458 p., p. 556.
- (en) R.Craig Albertson, J.Todd Streelman et Thomas.D. Kocher, « Directional slection has shaped the oral jaws of Lake Malawi cichlid fishes », Proceedings of the National Academy of Sciences of the Unided States of America, vol. 100(9), , p. 5252-5257
- (en) Claus Rueffler, Tom J.M Van Doreen, Olof Leimar et Peter A. Abrams, « Disruptive selection and then what », TRENDS in Ecology and Evolution, vol. 21(5), , p. 238-245
- (en) Rita Cova, Charles R. Brown, Mark D. Anderson et Mary Bomberger Brown, « Stabilizing selection on body mass in the sociable weaver Philetairus socius », The royal society, vol. 269, , p. 1905-1909
- (en) Scott Freeman, Evolutionary analysis (2nd ed), Upper Saddle River, , 704 p., p. 242,243
- (en) Jaqueline Krause-Nehring, J.Matthias Starck et A.Richard Palmer, « Juvenile colour polymorphisme in the red rock crab, Cancer productus : patterns, causes, and possible adaptative significance », Zoologie, vol. 113(3), , p. 131-139
- J. Reece, L. Urry, M. Cain, S. Wasserman, Minorsky P. et Jackson R., Campbell Biologie (4e édition), Pearson Education, , 1458 p., p. 557.
Voir aussi
Article connexe
Lien externe
- Portail de la biologie
- Portail de la zoologie