N-Méthylformamide
Le N-méthylformamide (NMF) est un composé organique de formule chimique HCONHCH3. Il s'agit d'un liquide incolore et quasiment inodore totalement soluble dans l'eau. Il est utilisé essentiellement comme réactif dans diverses synthèses organiques avec quelques applications comme solvant polaire[4].
Pour les articles homonymes, voir NMF (homonymie).
| N-Méthylformamide | |
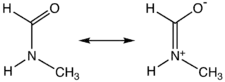 Mésomérie du N-méthylformamide |
|
| Identification | |
|---|---|
| Nom UICPA | N-méthylformamide |
| Synonymes |
monométhylformamide |
| No CAS | |
| No ECHA | 100.004.205 |
| No CE | 204-624-6 |
| PubChem | 31254 |
| ChEBI | 7438 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore faiblement volatil |
| Propriétés chimiques | |
| Formule | C2H5NO [Isomères] |
| Masse molaire[1] | 59,067 2 ± 0,002 5 g/mol C 40,67 %, H 8,53 %, N 23,71 %, O 27,09 %, |
| Propriétés physiques | |
| T° fusion | −3,2 °C[2] |
| T° ébullition | 199-201 °C[2] |
| Paramètre de solubilité δ | 31,1 J1/2·cm-3/2 (25 °C)[3] |
| Masse volumique | 1,003 g·cm-3[2] à 20 °C |
| T° d'auto-inflammation | 425 °C[2] |
| Point d’éclair | 111 °C[2] |
| Limites d’explosivité dans l’air | 3,8 % vol. à 17,8 % vol[2]. |
| Pression de vapeur saturante | 20 Pa[2] à 20 °C 141 Pa à 40 °C |
| Précautions | |
| SGH[2] | |
  Danger |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Le N-méthylformamide est étroitement apparenté aux autres formamides, notamment le formamide HCONH2 et le diméthylformamide (DMF) HCON(CH3)2, mais sa production et son utilisation sont nettement moins importantes ; le diméthylformamide est ainsi utilisé comme solvant préférentiellement au N-méthylformamide en raison de sa plus grande stabilité.
Le N-méthylformamide est généralement produit en faisant réagir de la méthylamine avec du formiate de méthyle :
Une alternative moins courante consiste en la transamidation du formamide sur la méthylamine :
La N-méthylformamide a été détectée dans le milieu interstellaire[5].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « N-Methylformamide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 novembre 2012 (JavaScript nécessaire)
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) Hansjörg Bipp, Heinz Kieczka, « Formamides », Ullmann's Encyclopedia of Industrial Chemistry, (lire en ligne) DOI:10.1002/14356007.a12_001
- (en) Niels F. W. Ligterink, Samer J. El-Abd, Crystal L. Brogan, Todd R. Hunter, Anthony J. Remijan, Robin T. Garrod et Brett M. McGuire, « The Family of Amide Molecules toward NGC 6334I », The Astrophysical Journal, vol. 901, no 1, , p. 37 (DOI 10.3847/1538-4357/abad38, Bibcode 2020ApJ...901...37L, arXiv 2008.09157, lire en ligne)
- Portail de la chimie