NaK
NaK est un alliage de sodium (Na) et de potassium (K) qui a la particularité d'être liquide à température ambiante. Comme le sodium et le potassium, il réagit facilement avec l'air et l'eau et doit être manipulé avec des précautions appropriées.
Pour les articles homonymes, voir Nak.
| Alliage sodium-potassium | |

| |
| L'alliage liquide NaK, dans un tube en verre. | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.112.643 |
| No CE | 601-078-4 |
| PubChem | 16211683 |
| SMILES | |
| InChI | |
| Apparence | Métal liquide argenté |
| Propriétés chimiques | |
| Formule | NaK2 (eutectique) |
| Masse molaire[1] | 101,186 4 ± 0,000 2 g/mol K 77,28 %, Na 22,72 %, |
| Moment dipolaire | 2,693 ± 0,014 D [2] |
| Propriétés physiques | |
| T° fusion | −12,6 °C |
| T° ébullition | 785 °C |
| Solubilité | non soluble dans les hydrocarbures et éthers |
| Masse volumique | 0,866 g·cm-3 à 21 °C 0,855 à 100 °C |
| Pression de vapeur saturante | 1 mmHg à 355 °C |
| Conductivité thermique | 23,2 W/m/K à 100 °C |
| Conductivité électrique | 40,7 mΩ/cm |
| Précautions | |
| SGH[3] | |
  Danger |
|
| NFPA 704 | |
| Transport[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés physiques
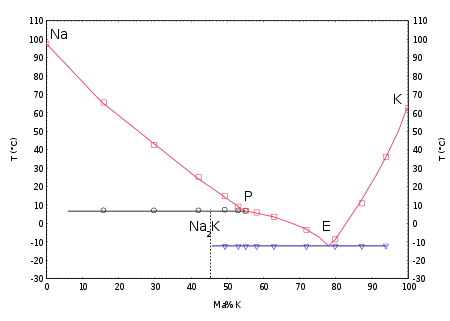
S'il contient entre 40 et 90 % de potassium, l'alliage est liquide à température ambiante. Le mélange ayant la plus faible température de fusion (le mélange eutectique) est constitué de 78 % de potassium et 22 % de sodium. Cet alliage fond à −12,6 °C et bout à 785 °C.
Au contact de l'eau, l'alliage forme de l'hydrogène, de l'hydroxyde de potassium et de l'hydroxyde de sodium. La réaction est assez violente pour déclencher l'explosion de l'hydrogène émis. Au contact de l'air, il forme en surface une couche jaune de superoxyde de potassium qui peut exploser au contact de matériaux organiques.
Le NaK n'est pas assez dense pour être immergé dans la plupart des hydrocarbures, mais peut l'être dans les huiles minérales légères. Cette méthode de stockage est dangereuse si le superoxyde s'est déjà formé. Ce fut la cause d'une importante explosion survenue au Laboratoire national d'Oak Ridge le : un épanchement de NaK fut protégé de l'oxydation par une aspersion d'huile minérale, mais suffisamment de superoxyde s'était déjà formé et cinq jours plus tard, un choc métallique provoqua l'explosion qui blessa 11 personnes[4].
Production
Le NaK est produit par distillation réactive. À l'origine discontinu, le procédé moderne est devenu continu[6] : du chlorure de potassium liquide descend dans une colonne garnie où montent des vapeurs de sodium. Dans la zone de réaction, le mélange à pression de vapeur saturante est dirigé vers une colonne de fractionnement qui sépare les vapeurs de potassium jusqu'au degré de mélange désiré. Le chlorure de sodium résultant de la réaction est soutiré en continu sous la zone de réaction.
Utilisation
Caloporteur
Son état liquide et ses bonnes caractéristiques thermiques rendent le NaK indiqué comme fluide caloporteur dans certains générateurs thermodynamiques.
En particulier, il est utilisé dans les circuits de refroidissement des réacteurs à neutrons rapides expérimentaux. Ces dispositifs sont souvent arrêtés et leur cœur modifié ou contrôlé, le NaK simplifie alors la manipulation contrairement aux autres métaux caloporteurs utilisés (plomb ou sodium pur) qui nécessitent un chauffage permanent pendant l'opération.
Du fait de sa très faible pression de vapeur (aux températures ambiantes), son utilisation est avantageuse dans le vide absolu de l'espace, où il reste liquide et s'évapore très lentement. Les satellites soviétiques RORSAT embarquaient de petits réacteurs nucléaires utilisant ce caloporteur. À deux reprises, les satellites firent une rentrée accidentelle dans l'atmosphère, l'un échouant au Canada (où il fut récupéré) et l'autre en mer. Les autres satellites sont en orbite haute attendant leur retombée naturelle. Comme de nombreux objets se trouvant en orbite, les gouttes de NaK qui viendraient à fuir — sachant qu'aujourd'hui le NaK est solidifié depuis longtemps — constituent encore aujourd'hui une population de débris spatiaux dangereux[7].
Chimie
Dans l'industrie, il est utilisé comme catalyseur des réactions d'alkylation, isomérisation, condensation et transestérification. En particulier, il sert à produire un précurseur de l'ibuprofène.
Les propriétés réductrices du composé sont également utilisées en conjonction avec un donneur de proton pour la réduction des alcynes, arènes, cétones ou aldéhydes.
Dessiccation
Le sodium et le potassium ont des capacités de dessiccation, mais à l'état solide, ils ne peuvent réagir que superficiellement et l'oxydation réduit leur réactivité. L'alliage NaK résout ces problèmes à température ambiante.
Article connexe
Références
- (en) [PDF] « Sodium-Potassium Alloy (NaK) Technical Data Sheet », BASF, (consulté le )
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- Fiche Sigma-Aldrich du composé Sodium-potassium alloy Potassium 78 wt. %, Sodium 22 wt. %, consultée le 8 avril 2018.
- Office of Oversight, « Multiple injury accident resulting from the sodium-potassium explosion in building 9201-5 at the y-12 plant », Accident Investigation Program, sur Office of Health, Safety and Security, Département de l'Énergie des États-Unis, (consulté le )
- G.L.C.M. van Rossen, H. van Bleiswijk: Über das Zustandsdiagramm der Kalium-Natriumlegierungen, in: Z. Anorg. Chem., 1912, 74, S. 152–156.
- (en) C.B. Jackson et R.C. Werner, Handling and uses of the alkali metals : Symposium held at the 129th meeting of the American Chemical Society, Dallas, 1956, American Chemical Society, coll. « Advances in Chemistry » (no 19), , 177 p. (ISBN 978-0-8412-0020-3, DOI 10.1021/ba-1957-0019.ch018, présentation en ligne), chap. 18 (« The Manufacture of Potassium and NaK »), p. 169–173
- (en) Leonard David, « Havoc in the Heavens: Soviet-Era Satellite's Leaky Reactor's Lethal Legacy », Space.com, (consulté le ).
- Portail de la chimie

