Norbornadiène
Le norbornadiène est un hydrocarbure bicyclique. Ce composé peut être vu comme une molécule de 1,4-cyclohexadiène auquel a été ajouté un pont méthylène sur les positions para. Ce composé est proche du norbornène qui a une structure identique, mais qui a une double liaison de moins. Le norbornadiène et les composés voisins ont un grand intérêt scientifique de par leur géométrie inhabituelle et leur grande réactivité.
| Norbornadiène | |
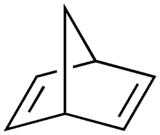   |
|
| Identification | |
|---|---|
| Nom UICPA | Bicyclo[2.2.1]hepta-2,5-diène |
| Synonymes |
Norborna-2,5-diène |
| No CAS | |
| No ECHA | 100.004.066 |
| No CE | 204-472-0 |
| PubChem | 8473 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore |
| Propriétés chimiques | |
| Formule | C7H8 [Isomères] |
| Masse molaire[1] | 92,138 4 ± 0,006 2 g/mol C 91,25 %, H 8,75 %, |
| Propriétés physiques | |
| T° fusion | −19,15 °C[2] |
| T° ébullition | 90,25 °C[2] |
| Solubilité | Quasiment insoluble dans l'eau[3] |
| Masse volumique | 0,91 g·cm-3[3] |
| T° d'auto-inflammation | 350 °C[3] |
| Point d’éclair | - 11 °C (coupelle fermée)[3] |
| Limites d’explosivité dans l’air | 1 Vol.-% (38 g·m-3)[3] |
| Pression de vapeur saturante | 69 mbar à 20 °C 256 mbar à 50 °C 505 mbar à 65 °C[3] |
| Précautions | |
| Directive 67/548/EEC | |
 Xn  F |
|
| Transport | |
| Écotoxicologie | |
| DL50 | 3 850 mg·kg-1 (souris, oral)[4] 56 mg·kg-1 (souris, i.v.)[5] |
| LogP | 2,67[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
La synthèse du norbornadiène est basée sur une réaction de Diels-Alder entre le cyclopentadiène et un alcyne :
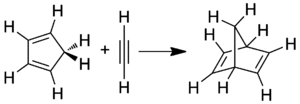 synthèse du norbornadiène
synthèse du norbornadiène
Réactions
On peut synthétiser à partir du norbornadiène un de ses isomères, le quadricyclane, par une réaction de type photochimique assistée par un sensibilisant photochimique, comme l'acétophénone.
Le couple norbornadiène-quadricyclane a été étudié comme possibilité de stockage de l'énergie solaire[6].
Le norbornadiène et ses dérivés forment aussi des complexes organométalliques, où ils peuvent agir en tant que donneur de paire d'électrons voir de quatre électrons. Les composés « sandwich » comme le tétracarbonyl(norbornadiène)chrome(0)[7], sont utilisés pour échanger les carbonyles du chrome par des ligands phosphine bidentates.
Le norbornadiène est aussi un réactif pour la synthèse du diamantane et du sumanène, et est utilisé comme donneur d'acétylène dans la réaction avec la 3,6-di-2-pyridyl-1,2,4,5-tétrazine[8] (voir 1,2,4,5-tétrazines).
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Buckingham, J.; Donaghy, S.M., Dictionary of Organic Compounds: Fifth Edition, Chapman and Hall, New York, 1982, 1.
- Entrée du numéro CAS « 121-46-0 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 10/08/09 (JavaScript nécessaire)
- Shell Chemical Company. Unpublished Report. Vol. -, Pg. 1, 1961.
- U.S. Army Armament Research & Development Command, Chemical Systems Laboratory, NIOSH Exchange Chemicals. Vol. NX#04158
- (en) Gregory W. Sluggett, Nicholas J. Turro, and Heinz D. Roth, « Rh(III)-Photosensitized Interconversion of Norbornadiene and Quadricyclane », J. Phys. Chem. A, vol. 101, no 47, 20 novembre 1997 (web), p. 8834–8838 (DOI 10.1021/jp972007h, lire en ligne)
- (en) Markus Strotmann, Rudolf Wartchow, and Holger Butenschön, « High yield synthesis and structures of some achiral and chiral (diphosphine)tetracarbonylchromium(0) chelate complexes with tetracarbonyl(norbornadiene)chromium(0) as complexation reagent », Arkivoc, , KK–1112F (lire en ligne)
- (en) Ronald N. Warrener and Peter A. Harrison, « π-Bond Screening in Benzonorbornadienes: The Role of 7-Substituents in Governing the Facial Selectivity for the Diels-Alder Reaction of Benzonorbornadienes with 3,6-Di(2-pyridyl)-s-Tetrazine », Molecules, vol. 6, , p. 353–369 (DOI 10.3390/60400353, lire en ligne)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Norbornadiene » (voir la liste des auteurs).
- Portail de la chimie

