Tétrazine
Une tétrazine est un composé organique instable constitué d'un noyau aromatique à six atomes contenant quatre atomes d'azote et deux de carbone.
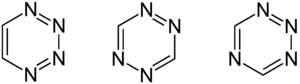
Cet hétérocycle possède trois isomères distincts par la position relative des atomes de carbone et d'azote, la 1,2,3,4-tétrazine, la 1,2,3,5-tétrazine et la 1,2,4,5-tétrazine qui ont chacun pour formule brute C2H2N4.
Le nom tétrazine est aussi utilisé pour nommer les dérivés de ces composés.
1,2,3,4-tétrazines
Les 1,2,3,4-tétrazines sont isolées quand elles sont en général fusionnées à un ou plusieurs cycles aromatiques et stabilisées comme dérivés dioxydés.
1,2,4,5-tétrazines
Les 1,2,4,5-tétrazines sont très connues, ainsi que leurs nombreux dérivés 3,6-disubstitutés.
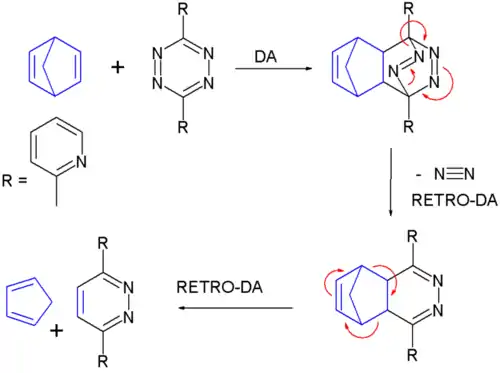
Le composé 3,6-di-2-pyridyl-1,2,4,5-tétrazine[1] possède deux substituant pyridines (azines) et est un réactif important dans les réactions de type Diels-Alder. Il réagit avec le norbornadiène par une réaction de Diels-Alder suivie de deux réactions de rétro-Diels-Alder pour donner une molécule de cyclopentadiène et un dérivé de la pyridazine, avec échange d'une unité d'acétylène :
Dans le cas d'un norbornadiène fusionné à un arène, la réaction s'arrête à un stade intermédiaire[2].
Usages
Biologie et médecine
Les tétrazines (et la synthèses de certains précurseurs de latétrazine et de diénophiles) intéressent beaucoup l'imagerie des cellules vivantes (car permettant, via la « cycloaddition » de tétrazine à l'extérieur (en surface, par exemple sur des bactéries)[3] ou à l'intérieur de cellules vivantes, éventuellement en combinant l'utilisation d'acides aminés non naturels, de créer des sondes d'imagerie in vivo, dites « sondes fluorogènes »)[4], éventuellement « auto-clignotantes »[5],[6].
Plus largement, les tétrazines intéressent la chimie bioorthogonale (qui recherche et utilise des réactions chimiques à l'intérieur de cellules ou d'organismes vivant, sans interférer avec le métabolisme normal)[4]. Ainsi Devaraj & Weissleder (2011) grâce à des réactions à la tétrazine ont permis d'améliorer l'étiquetage de biomarqueurs sur des cellules avec des nanoparticules magnéto-fluorescentes[7].
En 2013, par exemple pour l'imagerie pré-ciblée de biomarqueurs de cellules cancéreuses, on sait déjà utiliser, chez des souris de laboratoire vivantes, des ligations à la tétrazine pour créer des sondes d'imagerie in vivo pour la tomographie par émission de positons[4].
La tétrazine a permis de créer de premiers fluorophores photoactivables tétrazinique ; ces « photodéclencheurs » sont comme des interrupteurs permettant par exemple d'allumer ou d'éteindre des sondes fluorescentes et donc de provisoirement rendre visible des organites intracellulaires ou des protéines-cibles que l'on peut alors observer de manière dynamique dans des organismes vivants[8]. Le mécanisme de photoactivation diffère de celui des photodéclencheurs autrement les plus utilisés (groupes O-nitrobenzyle et nitrophénéthyle...) où l'« extincteur de fluorescence » est photodécomposé pour restaurer la fluorescence lors d'une irradiation lumineuse : la tétrazine permet d'éteindre la fluorescence de divers fluorophores via un transfert d'énergie par liaison. Une irradiation lumineuse provoque ensuite une réaction de photolyse dans les fragments tétrazine inhibés, qui génère deux nitriles et de l'azote moléculaire non cytotoxique, restaurant ainsi la fluorescence des fluorophores[8]. Il est même possible d'ainsi obtenir visuellement des informations sur l'activité et la localisation de l'ADN[9]
Pyrotechnie
Divers dérivés (sels) de tétrazines et leurs comportements thermiques[10], étudiés avec attention dans les années 2010 (car a priori moins polluants que la plupart de leurs équivalents)[11] sont hautement dense en énergie[12],[13],[14],[15],[16],[17],[18] et susceptible d'être utilisés comme explosifs (car susceptibles de pouvoir être stabilisés et de générer après ignition instantanément une grande quantité de gaz)[19] :
- 1,2,4,5-tétrazine[20] ;
- nitrate de 3,6-diguanidino-1,2,4,5-tétrazine[20] ;
- perchlorate de 3,6-diguanidino-1,2,4,5-tétrazine[20] ;
- nitrate de 3,6-diguanidino-1,2,4,5-tétrazine-1,4-di-N-oxyde[20] ;
- perchlorate de 3,6-diguanidino-1,2,4,5-tétrazine-1,4-di-N-oxyde[20] ;
- 3,6-bis(1H-1,2,3,4-tétrazole-5-ylamino)-1,2,4,5-tétrazine et son dérivé 1,4-di-N-oxyde[20] ;
- 3,3′-azobis (6-amino-1,2,4,5-tétrazine) et ses produits d'oxydation[20].
Certaines de ces formules pourraient être utilisées pour produire de nouveaux propergols, munitions ou explosifs plus "verts" que ceux actuellement disponibles sur le marché[21].
En Russie, Zyuzin & al. (2021) suggèrent l'utilisation 1,2,4,5-Tetrazine N-Oxydes comme propergol solide pour fusées[22].
Chen & al. (2022) suggère l'utilisation de sels de métaux alcalins de 3,6‐bis‐nitroguanyl‐1,2,4,5‐tetrazine en tant que substitut potentiel aux composants pyrotechniques contenant du perchlorate polluants[23]
Polymérisations
L'utilisation de certains dérivés de tétrazine (portant des groupes fonctionnels de type carboxylates ou esters ou encore amines primaires) ont permis des réactions de polymérisation et post-polymérisation rapides et caractérisées par un taux important de conversion des chaînes latérales (> 99%), générant des polymères fonctionnels dans des solvants organiques et aqueux, sans besoin d'additifs ni de catalyseur[24].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Tetrazine » (voir la liste des auteurs).
- Datasheet: Link
- π-Bond Screening in Benzonorbornadienes: The Role of 7-Substituents in Governing the Facial Selectivity for the Diels-Alder Reaction of Benzonorbornadienes with 3,6-Di(2-pyridyl)-s-Tetrazine. Ronald N. Warrener and Peter A. Harrison, Molecules 2001, 6, 353–369 Article en ligne
- (en) S. E. Pidgeon et M. M. Pires, « Metabolic remodeling of bacterial surfaces via tetrazine ligations », Chemical Communications, vol. 51, no 51, , p. 10330–10333 (ISSN 1359-7345 et 1364-548X, DOI 10.1039/C5CC01693B, lire en ligne, consulté le )
- (en) Jolita Šečkutė et Neal K Devaraj, « Expanding room for tetrazine ligations in the in vivo chemistry toolbox », Current Opinion in Chemical Biology, vol. 17, no 5, , p. 761–767 (PMID 24021760, PMCID PMC4002580, DOI 10.1016/j.cbpa.2013.08.004, lire en ligne, consulté le )
- (en) Philipp Werther, Klaus Yserentant, Felix Braun et Nicolai Kaltwasser, « Live‐Cell Localization Microscopy with a Fluorogenic and Self‐Blinking Tetrazine Probe », Angewandte Chemie International Edition, vol. 59, no 2, , p. 804–810 (ISSN 1433-7851 et 1521-3773, PMID 31638314, PMCID PMC6972563, DOI 10.1002/anie.201906806, lire en ligne, consulté le )
- (en) Philipp Werther, Klaus Yserentant, Felix Braun et Nicolai Kaltwasser, « Live‐Cell Localization Microscopy with a Fluorogenic and Self‐Blinking Tetrazine Probe », Angewandte Chemie, vol. 132, no 2, , p. 814–820 (ISSN 0044-8249 et 1521-3757, DOI 10.1002/ange.201906806, lire en ligne, consulté le )
- (en) Neal K. Devaraj et Ralph Weissleder, « Biomedical Applications of Tetrazine Cycloadditions », Accounts of Chemical Research, vol. 44, no 9, , p. 816–827 (ISSN 0001-4842 et 1520-4898, PMID 21627112, PMCID PMC3166440, DOI 10.1021/ar200037t, lire en ligne, consulté le )
- (en) Axel Loredo, Juan Tang, Lushun Wang et Kuan-Lin Wu, « Tetrazine as a general phototrigger to turn on fluorophores », Chemical Science, vol. 11, no 17, , p. 4410–4415 (ISSN 2041-6520 et 2041-6539, PMID 33384859, PMCID PMC7690217, DOI 10.1039/D0SC01009J, lire en ligne, consulté le )
- (en) Ulrike Rieder et Nathan W. Luedtke, « Alkene-Tetrazine Ligation for Imaging Cellular DNA », Angewandte Chemie International Edition, vol. 53, no 35, , p. 9168–9172 (DOI 10.1002/anie.201403580, lire en ligne, consulté le )
- (en) Valery P. Sinditskii, Viacheslav Yu. Egorshev, Gennady F. Rudakov et Sergey A. Filatov, « High-Nitrogen Energetic Materials of 1,2,4,5-Tetrazine Family: Thermal and Combustion Behaviors », dans Chemical Rocket Propulsion, Springer International Publishing, , 89–125 p. (ISBN 978-3-319-27746-2, DOI 10.1007/978-3-319-27748-6_3, lire en ligne)
- (en) Jie Ren, Tianhe Zhang, Zhimin Li et Lin Wang, « Alkaline earth metal salts of 3,6-dinitramino-1,2,4,5-tetrazine: Prospective candidates for environmentally friendly energetic applications », Thermochimica Acta, vol. 682, , p. 178391 (DOI 10.1016/j.tca.2019.178391, lire en ligne, consulté le )
- (en) Mohammad Hossein Keshavarz, Yasin Hayat Abadi, Karim Esmaeilpour et Sajjad Damiri, « Assessment of the effect of N-oxide group in a new high-performance energetic tetrazine derivative on its physicochemical and thermodynamic properties, sensitivity, and combustion and detonation performance », Chemistry of Heterocyclic Compounds, vol. 53, nos 6-7, , p. 797–801 (ISSN 0009-3122 et 1573-8353, DOI 10.1007/s10593-017-2126-5, lire en ligne, consulté le )
- (en) Rudraditya Sarkar, Daradi Baishya, Divya Mahendhiran et Raja K. Rit, « Novel Nitrogen‐Rich Tetrazine‐Based High Energy Density Molecules: Molecular Design and Computational Studies », Propellants, Explosives, Pyrotechnics, vol. 43, no 1, , p. 75–82 (ISSN 0721-3115 et 1521-4087, DOI 10.1002/prep.201700156, lire en ligne, consulté le )
- (en) Tomasz G. Witkowski, Elena Sebastiao, Bulat Gabidullin et Anguang Hu, « 2,3,5,6-Tetra(1H-tetrazol-5-yl)pyrazine: A Thermally Stable Nitrogen-Rich Energetic Material », ACS Applied Energy Materials, vol. 1, no 2, , p. 589–593 (ISSN 2574-0962 et 2574-0962, DOI 10.1021/acsaem.7b00138, lire en ligne, consulté le )
- (en) Jie Zhou, Shaojie Wu, Wenhui Zhang et Qing Liu, « Synthesis and Thermal Properties of Three Energetic Ion Salts of 3,6-Bis[(1H-1,2,3,4-tetrazol-5-yl)-amino]-1,2,4,5-Tetrazine », Chemical Research in Chinese Universities, vol. 35, no 3, , p. 403–409 (ISSN 1005-9040 et 2210-3171, DOI 10.1007/s40242-019-8326-z, lire en ligne, consulté le )
- (en) Tianhe Zhang, Jiang Du, Zhimin Li et Xinyu Lin, « Alkali metal salts of 3,6-dinitramino-1,2,4,5-tetrazine: promising nitrogen-rich energetic materials », CrystEngComm, vol. 21, no 4, , p. 765–772 (ISSN 1466-8033, DOI 10.1039/C8CE01827H, lire en ligne, consulté le )
- (en) Yi Li, Yanyue Li, Shaohua Jin et Shengfu Li, « Molecular design of energetic tetrazine-triazole derivatives », Journal of Molecular Modeling, vol. 27, no 3, , p. 98 (ISSN 1610-2940 et 0948-5023, DOI 10.1007/s00894-021-04714-3, lire en ligne, consulté le )
- (en) Qiong Yu, Richard J. Staples et Jean'ne M. Shreeve, « An Azo‐bridged Triazole Derived from Tetrazine », Zeitschrift für anorganische und allgemeine Chemie, vol. 646, no 22, , p. 1799–1804 (ISSN 0044-2313 et 1521-3749, DOI 10.1002/zaac.202000343, lire en ligne, consulté le )
- (en) Zhang Cong, Chen Xiang, Hu Yongpeng et Bai Yang, « A series of guanidine salts of 3,6-bis-nitroguanyl-1,2,4,5-tetrazine: green nitrogen-rich gas-generating agent », RSC Advances, vol. 10, no 60, , p. 36287–36294 (ISSN 2046-2069, DOI 10.1039/D0RA06766K, lire en ligne, consulté le )
- David E. Chavez, Michael A. Hiskey et Darren L. Naud, « Tetrazine Explosives », Propellants, Explosives, Pyrotechnics, vol. 29, no 4, , p. 209–215 (ISSN 0721-3115 et 1521-4087, DOI 10.1002/prep.200400050, lire en ligne, consulté le )
- (en) Zhen-Li Yang, Zhen Wang, Wen-li Cao et Tong Li, « New green energetic materials based on unsymmetrically substituted pyrazole-tetrazines and their hydroperchlorates », New Journal of Chemistry, vol. 43, no 47, , p. 18637–18646 (ISSN 1144-0546 et 1369-9261, DOI 10.1039/C9NJ04519H, lire en ligne, consulté le )
- (en) I. N. Zyuzin, I. Yu. Gudkova et D. B. Lempert, « Energy Abilities of Certain Derivatives of 1,2,4,5-Tetrazine N-Oxides as Components of Solid Composite Rocket Propellants », Russian Journal of Physical Chemistry B, vol. 15, no 4, , p. 611–621 (ISSN 1990-7931 et 1990-7923, DOI 10.1134/S1990793121040138, lire en ligne, consulté le )
- (en) Xiang Chen, Shenghui Wang, Yuankai Chen et Yongpeng Hu, « Alkaline earth metal salts of 3,6‐bis‐nitroguanyl‐1,2,4,5‐tetrazine: Promising perchlorate‐free environmentally friendly pyrotechnic components », Applied Organometallic Chemistry, vol. 36, no 2, (ISSN 0268-2605 et 1099-0739, DOI 10.1002/aoc.6497, lire en ligne, consulté le )
- (en) Sarthak Jain, Kevin Neumann, Yichuan Zhang et Jin Geng, « Tetrazine-Mediated Postpolymerization Modification », Macromolecules, vol. 49, no 15, , p. 5438–5443 (ISSN 0024-9297 et 1520-5835, DOI 10.1021/acs.macromol.6b00867, lire en ligne, consulté le )
Bibliographie
- (en) Zheng Fang, Wen-Li Hu, De-Yong Liu et Chu-Yi Yu, « Synthesis of tetrazines from gem-difluoroalkenes under aerobic conditions at room temperature », Green Chemistry, vol. 19, no 5, , p. 1299–1302 (ISSN 1463-9262 et 1463-9270, DOI 10.1039/C6GC03494B, lire en ligne, consulté le )
- (en) Jiayu Sun, Jie Li, Hongbao Sun et Chunling Li, « Concise Synthesis of Functionalized Cyclobutene Analogues for Bioorthogonal Tetrazine Ligation », Molecules, vol. 26, no 2, , p. 276 (ISSN 1420-3049, PMID 33429851, PMCID PMC7827859, DOI 10.3390/molecules26020276, lire en ligne, consulté le )
- Portail de la chimie