Réaction de Diels-Alder
La réaction de Diels-Alder est une réaction chimique utilisée en chimie organique, dans laquelle un alcène (diénophile) s'additionne à un diène conjugué pour former un dérivé du cyclohexène. Otto Diels et Kurt Alder reçurent le prix Nobel de chimie en 1950 pour les travaux relatifs à cette réaction[1],[2],[3],[4].
Dans le domaine des matériaux avancés et de la robotique souple on parle de « Polymères Diels-Alder » (« Diels-Alder polymers ») pour décrire des polymères constitués de réseaux covalents thermoréversibles. Un tel matériau a été récemment (2016-2017) expérimenté avec succès pour trois actionneurs pneumatiques de robotique souple (une pince souple, une main et des muscles artificiels) auto-cicatrisant après lésions par percement, déchirement ou coups portés sur le polymère en question[5].
Cyclo-additions
La réaction de Diels-Alder est un cas spécial d'une classe de réactions plus générale : les réactions de cycloaddition entre systèmes π. Dans la réaction de Diels-Alder, les 4 électrons π du diène réagissent avec la double liaison de l'alcène contenant 2 électrons π. Pour cette raison, cette réaction est appelée cycloaddition [4+2].
La réalisation de ces réactions nécessite, en général, un chauffage.
Règle d'Alder
La facilité de la réaction de Diels-Alder dépend fortement de la nature des substituants du diène et du diénophile. La réaction prototype ci-dessous, entre l'éthène et le but-1,3-diène, se fait difficilement et donne un rendement en cyclohexène assez faible.
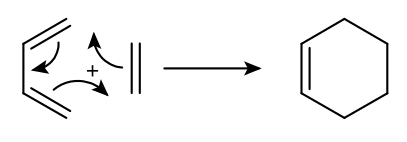
La règle d'Alder permet de préciser les conditions qui facilitent la réalisation de ces cycloadditions : la réaction s'effectue plus facilement entre un diène riche en électrons et un diénophile pauvre en électrons. En d'autres termes, un « bon » diène est substitué par des atomes ou des groupes d'atomes donneurs d'électrons, un « bon » diénophile par des atomes ou groupes d'atomes attracteurs (accepteurs) d'électrons.
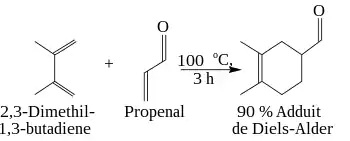
Ces caractères, attracteurs ou donneurs, peuvent être des effets inductif, mésomère, ou d'hyperconjugaison. Ci-dessous, la réaction entre le 2,3-diméthylbuta-1,3-diène (2 groupements méthyles donneurs d'électrons) et le propénal (groupement aldéhyde attracteur d'électrons) se fait avec un bon rendement.
Les alcynes substitués par des groupements attracteurs sont de bons diénophiles et font l'objet d'une réaction de Diels-Alder. En effet, la réaction d'un éthyne substitué avec 2 groupements attracteurs (par ex, CH3OOC)-C≡C-(COOCH3) avec le buta-1,3-diène donne une réaction possible. En revanche, un composé comportant deux liaisons π conjuguées dont au moins une est un alcyne est un mauvais diène, car il ne peut se positionner en conformation s-cis. La réaction nécessite une haute température.
Stéréochimie de la réaction
Cette réaction de cycloaddition [4+2] est sous contrôle orbitalaire, ce qui entraîne généralement la formation d'un stéréoisomère endo lorsque le diène est cyclique. On justifie fréquemment cette sélectivité par des considérations frontalières secondaires stabilisant l'approche endo :
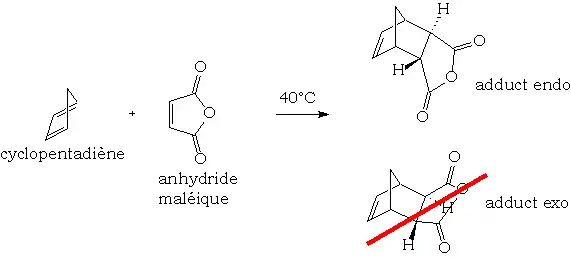
La réaction est renversable. Le composé endo est généralement obtenu le plus rapidement (conditions cinétiques). Si on laisse la réaction se prolonger un temps très long, l'équilibre sera alors en faveur du produit exo, plus stable thermodynamiquement.
Caractère renversable
Cette réaction est renversable. Les réactions inverses, dites de rétro-Diels-Alder, peuvent être utilisées pour préparer des composés. Par exemple, le craquage thermique du cyclohexène permet d'obtenir du butadiène et de l'éthène. Elles permettent aussi d'allumer ou d'éteindre des marqueurs (sondes fluorescents à base de tétrazines) utilisés en imagerie médicale ou biologique à l'intérieur de cellules vivantes.
Certains auteurs utilisent à tort le terme "réversible" à la place de "renversable" alors que toute transformation chimique est créatrice d'entropie.
En pratique
La réaction de Diels-Alder peut être problématique, par exemple dans le cadre du stockage du cyclopentadiène qui se dimérise lentement à température ambiante pour former un composé tricyclique, par réaction de Diels-Alder sur lui-même. Le composé obtenu, stable à la température ambiante (Teb = 140 °C), doit être distillé lentement pour récupérer le cyclopentadiène (Teb = 41 °C) par réaction de rétro-Diels-Alder.
Notes et références
- (de) O. Diels et K. Alder, « Synthesen in der hydroaromatischen Reihe. I. Mitteilung: Anlagerungen von Di-en kohlenwasserstoffen », Liebigs Ann. Chem, vol. 460, no 1, , p. 98–122 (ISSN 0075-4617, DOI 10.1002/jlac.19284600106).
- (de) O. Diels et K. Alder, « Synthesen in der hydroaromatischen Reihe. III. Mitteilung: Synthese von Terpenen, Camphern, hydroaromatischen und heterocyclischen Systemen », Liebigs Ann. Chem, vol. 470, no 1, , p. 62–103 (ISSN 0075-4617, DOI 10.1002/jlac.19294700106).
- (de) O. Diels et K. Alder, « Synthesen in der hydroaromatischen Reihe. IV. Mitteilung: Über die Anlagerung von Maleinsäure-anhydrid an arylierte Diene, Triene und Fulvene », Ber. Dtsch. Chem. Ges., vol. 62, no 8, , p. 2081–2087 (ISSN 0365-947X, DOI 10.1002/cber.19290620829).
- (de) O. Diels et K. Alder, « Synthesen in der hydroaromatischen Reihe. V. Mitteilung: Über Δ4-Tetrahydro-o-phthalsäure », Ber. Dtsch. Chem. Ges., vol. 62, no 8, , p. 2087–2090 (ISSN 0365-947X, DOI 10.1002/cber.19290620830).
- Seppe Terryn, Joost Brancart, Dirk Lefeber, Guy Van Assche & Bram Vanderborght (2017), Self-healing soft pneumatic robots | Science Robotics | 16 aout 2017: Vol. 2, Issue 9, eaan4268 |DOI: 10.1126/scirobotics.aan4268 | résumé
- Portail de la chimie