Orthosilicate de magnésium
L'orthosilicate de magnésium est le composé chimique de formule Mg2SiO4. C'est le sel de magnésium de l'acide orthosilicique.
| Orthosilicate de magnésium | |
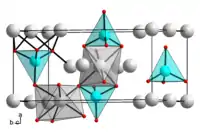
| |
| Strucure cristalline de l'orthosilicate de magnésium, à basse pression. __ Mg2+ __ Si4+ __ O2− |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.030.089 |
| PubChem | 66225 |
| SMILES | |
| InChI | |
| Apparence | solide blanc[1] |
| Propriétés chimiques | |
| Formule | Mg2SiO4 |
| Masse molaire[alpha 1] | 140,693 1 ± 0,002 7 g/mol Mg 34,55 %, O 45,49 %, Si 19,96 %, |
| Propriétés physiques | |
| T° fusion | 1 898 °C[1] |
| Solubilité | pratiquement insoluble dans l'eau[2] |
| Masse volumique | 3,22 g·cm-3[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés physiques
Solide
On connaît trois polymorphes de l'orthosilicate de magnésium, qui tous existent dans la nature (minéraux), sur Terre et dans les météorites :
- la forstérite (ou α-Mg2SiO4), le polymorphe de basse pression, orthorhombique ;
- la wadsleyite (ou β-Mg2SiO4), le polymorphe de haute pression, également orthorhombique ;
- la ringwoodite (ou γ-Mg2SiO4), le polymorphe de très haute pression, cubique.
Équilibres solide-liquide
À pression ordinaire, l'orthosilicate de magnésium solide (forstérite) fond à 1 898 ± 11 °C[3],[alpha 2].
En 1981, une étude expérimentale conclut que la fusion est congruente jusqu'à au moins 12,7 GPa[3]. Si la fusion reste congruente à plus haute pression, le point triple α-β-liq (forstérite-wadsleyite-liquide) est estimé par extrapolation à 2 600 °C, 20 GPa[3].
En 1993, une nouvelle étude du point de fusion de Mg2SiO4[5] conclut que la fusion cesse d'être congruente à 10,1 GPa (2 250 °C), et qu'à plus haute pression la réaction de fusion change en deux points invariants, à 15,6 GPa (2 310 °C) et 16,7 GPa (2 315 °C). Les réactions de fusion sont ainsi :
- P < 10,1 GPa : forstérite → liquide ;
- 10,1 < P < 15,6 GPa : forstérite → périclase (MgO) + liquide ;
- 15,6 < P < 16,7 GPa : forstérite → AnhB (Mg14Si5O24) + liquide ;
- P > 16,7 GPa : wadsleyite → AnhB + liquide.
Jusqu'à 16,5 GPa, la courbe de fusion expérimentale est bien représentée par une équation de Simon :
où P est exprimé en gigapascals (GPa) et T en kelvins (K)[5].
Équilibre liquide-vapeur
Il n'existe pas encore de données expérimentales ni de modèles théoriques concernant les propriétés de Mg2SiO4 à basse pression et haute température. En 2020, une série de calculs ab initio de dynamique moléculaire (DFTMD), basés sur la théorie de la fonctionnelle de la densité (DFT), ont couvert les états liquide et vapeur. Ils montrent[6] que :
- la vaporisation se fait de façon incongruente, et la composition chimique du liquide et de la vapeur coexistants varie en fonction de la température et de la densité globale (donc de la pression) : la vapeur est enrichie en silice et en oxygène, et appauvrie en magnésium ;
- le point critique liquide-vapeur se situe à Tc = 6 240 ± 200 K, Pc = 1,3 ± 0,2 kbar (130 ± 20 MPa) et ρc = 0,52 ± 0,03 g/cm3 (520 ± 30 kg/m3).
Synthèse
On peut préparer de l'orthosilicate de magnésium en faisant fondre à 1 900 °C un mélange stœchiométrique d'oxydes de magnésium et de silicium (deux MgO pour un SiO2).
Le procédé de Czochralski permet de synthétiser de grands monocristaux de forstérite, jusqu'à 25 mm de diamètre et 60 mm de long[7].
Notes et références
Notes
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Ce point de fusion a été établi pour la première fois en 1914[4] : 1 890 ± 20 °C, mais 1 895 °C avec la conversion de ces données dans l'échelle internationale de 1948[3].
Références
- Dale L. Perry, Handbook of Inorganic Compounds, Second Edition, CRC Press, , 581 p. (ISBN 978-1-4398-1462-8, lire en ligne)
- William M. Haynes, CRC Handbook of Chemistry and Physics, 94th Edition, CRC Press, , 2668 p. (ISBN 978-1-4665-7115-0, lire en ligne), p. 73
- (en) Eiji Ohtani et Mineo Kumazawa, « Melting of forsterite Mg2SiO4 up to 15 GPa », Physics of the Earth and Planetary Interiors, vol. 27, no 1, , p. 32-38 (DOI 10.1016/0031-9201(81)90084-4).
- (en) Norman Levi Bowen et Olaf Anderson, « The binary system MgO-SiO2 », American Journal of Science, 4e série, vol. 37, , p. 487-500.
- (en) Dean C. Presnall et Michael J. Walte, « Melting of Forsterite, Mg2SiO4, From 9.7 to 16.5 GPa », Journal of Geophysical Research, vol. 98, no B11, , p. 19777-19783 (DOI 10.1029/93JB01007).
- (en) Joshua P. Townsend, Gil Shohet et Kyle R. Cochrane, « Liquid‐Vapor Coexistence and Critical Point of Mg2SiO4 From Ab Initio Simulations », Geophysical Research Letters, vol. 47, no 17, , article no e2020GL089599 (DOI 10.1029/2020GL089599).
- (en) Humihiko Takei et Takaaki Kobayashi, « Growth and Properties of Mg2SiO4 Single Crystals », Journal of Crystal Growth, vol. 23, , p. 121-124.
- Portail de la chimie