Otarie à fourrure subantarctique
Arctocephalus tropicalis

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Mammalia |
| Ordre | Carnivora |
| Famille | Otariidae |
| Genre | Arctocephalus |
Répartition géographique

- colonie de reproduction
- individus isolés
- Distribution géographique théorique

LC : Préoccupation mineure
Statut CITES
L'otarie à fourrure subantarctique, ou otarie d'Amsterdam est un mammifère marin. Ses colonies de reproduction se trouvent dans les îles des océans Indien et Atlantique sud, au nord de la convergence antarctique. On peut estimer la population mondiale à 390 000 individus.
Les mâles mesurent jusqu'à 1,80 m mais continuent de grandir toute leur vie, tout comme la femelle, et pèsent jusqu'à 165 kg ; les femelles mesurent jusqu'à 1,45 m et pèsent jusqu'à 55 kg. L'âge maximal observé est de 11 ans pour les mâles, 23 ans pour les femelles.
Les mâles sont territoriaux pendant la période de reproduction et ils forment des harems. Les petits pèsent en moyenne 4,4 kg à la naissance, ils sont allaités pendant une durée d'environ 11 mois.
Le comportement de plongée des mâles n'a pas été étudié contrairement à celui des femelles. Les femelles sont nocturnes, elles plongent en général entre 5 et 50 mètres pour une durée comprise entre 1 min et 1 min 30 s. La plongée la plus profonde mesurée a atteint 208 mètres ; la plongée la plus longue mesurée a duré 6 min et 30 s. Les femelles trouvent leur nourriture à proximité des colonies de reproduction jusqu'à des zones de pêches très éloignées (de 600 à 1 800 km de la colonie), elles se nourrissent principalement de poissons lanternes et de céphalopodes.
Répartition et population
On observe pour cette espèce 3 principales colonies de reproduction, toutes situées au nord de la convergence antarctique[1] :
- 1. dans l'Atlantique sud, dans les îles de Gough et Tristan Da Cunha ;
- 2. dans l'océan Indien sur les îles du Prince-Édouard et l'archipel des Crozet ;
- 3. dans l'océan Indien sur l'île Amsterdam et l'île de Saint-Paul.
La population présente sur l'île de Gough a été estimée à plus de 200 000 animaux (dont 53 000 petits non sevrés) en 1992[2]. En 2006, la population d'otaries sur l'archipel du Prince-Édouard a été évaluée à environ 150 000 animaux[3]. Sur l'île de la Nouvelle-Amsterdam, le dernier comptage publié (1994) estime la population à 37000 animaux (30500 adultes et 6400 jeunes non sevrés)[4]. Les populations présentes sur les îles de Tristan Da Cunha, Crozet et Saint-Paul étant inférieures ou égales à 1000 animaux sur chaque île[2],[5], on peut estimer la population mondiale à environ 390 000 animaux.
L'otarie subantarctique se reproduit principalement sur trois territoires administrés par trois nations différentes.
| Principales zones de reproduction | Nombre d'individus | Administration |
|---|---|---|
| Île de Gough | 200 000 | |
| Îles du Prince-Édouard | 153 000 | |
| Île Amsterdam | 37 000 | |
| Population mondiale | 390 000 |
Si l'écrasante majorité des animaux est observée sur des zones de reproductions précises, certains ont été observés très loin de l'aire majoritaire de répartition. Ces observations peuvent paraître anecdotiques, toutefois elles indiquent une aire de répartition élargie qui nous renseigne sur les capacités de dispersion de cette espèce.
Des individus isolés sont parfois trouvés très au nord (jusqu'à la latitude 10° sud) de la répartition habituelle de cette espèce. En effet, de rares individus ont pu être observés à des latitudes tropicales dans l'océan Indien (île Rodrigues et île Maurice[6], île d'Anjouan[7] et Madagascar[8]) et l'Atlantique sud (Brésil[9], Angola[10]), mais également dans le Pacifique sud (archipel Juan Fernández)[11].
Des individus isolés ont également été observés à des latitudes intermédiaires, en dehors de l'aire normale de répartition, en Nouvelle-Zélande[12] et en Afrique du Sud[13].
La limite australe de la répartition de cette espèce semble être la latitude 60° sud, en effet en plusieurs occasions, des individus isolés ont été observés à la limite de l'océan Austral (Géorgie du Sud[14] et île Bouvet[15]). Cette limite correspond grossièrement à la limite nord de l'extension de la banquise antarctique pendant l'hiver austral.
| Lieu | Date | Observations d'individus isolés (Référence) |
|---|---|---|
| Brésil | 1977 | 1 individu sur une plage du Rio Grande do Sul[9] |
| Archipel Juan Fernández | 1984 | 2 individus[11] |
| Angola | 1985 | 2 individus à 1 km de l'embouchure du fleuve Couanza[10] |
| Comores | 1993 | 1 juvénile capturé sur l'île d'Anjouan[7] |
| Madagascar | 1996 | 1 subadulte à quelques kilomètres au nord de la ville de Manakara sur la côte est. L'animal affaibli fut nourri pendant un temps puis relâché[8] |
| Île Maurice | 2003 | 1 juvénile sur l'île Rodrigues, 2 individus sur l'île Maurice[6] |
| Géorgie du sud | 1979 | 5 individus[14] |
| Île Bouvet | 2006 | 3 individus[15] |
Aspect physique et proportions
Les mâles sont brun orangé à brun foncé sur le dos et brun clair sur le ventre ; ils possèdent une crête de poils dressés verticalement au niveau du front. Les mâles mesurent jusqu'à 1,80m et pèsent entre 70 et 165 kg[1],[16].
Les femelles sont gris marron sur le dos et brun clair sur la face ventrale. Les femelles ont une taille moyenne de 1,45m et pèsent entre 25 et 55 kg[16].
Chez les deux sexes, le museau est court et les vibrisses sont très longues[16].
À la naissance, les petits de l'otarie subantarctique mesurent en moyenne 60 cm et pèsent entre 4 et 4,4 kg[16]. Les petits sont de couleur noir profond de la naissance jusqu'à leur première mue ; à ce moment-là, ils acquièrent la fourrure des adultes.
On observe chez cette espèce un dimorphisme sexuel important, les mâles étant beaucoup plus gros que les femelles. Ce dimorphisme est une caractéristique observée chez toutes les espèces d'otaries et de lions de mer.
 mâle reproducteur blessé (cercle bleu)
mâle reproducteur blessé (cercle bleu) une femelle
une femelle petit âgé de plusieurs semaines
petit âgé de plusieurs semaines
Histoire naturelle
Reproduction et cycle de vie
Chez l'otarie subantarctique, la période de reproduction est relativement longue puisqu'elle se déroule sur une période de 11 mois, de fin novembre d'une année (n) à début novembre de l'année suivante (n+1)[17],[18],[19]. Accouplement, mise bas et allaitement ont lieu au niveau de colonies de reproduction, ces colonies sont les mêmes d'une année sur l'autre[20].
Formations et défenses des territoires par les mâles dominants
À la fin du mois de novembre (fin du printemps austral), les mâles sont les premiers à arriver sur les colonies de reproduction[21],[20]. C'est à ce moment que les grands mâles établissent leurs territoires sur lesquels ils accueilleront les femelles.
 Exemple de disposition des territoires défendus par des mâles sur une plage.
Exemple de disposition des territoires défendus par des mâles sur une plage. Les lignes correspondent aux limites des territoires, les points indiquent la localisation d'une confrontation.
Les lignes correspondent aux limites des territoires, les points indiquent la localisation d'une confrontation.
Dans un premier temps, tous les jeunes adultes et les juvéniles sont chassés de ces territoires[21]. Fréquemment, chez les espèces où un mâle constitue un harem de femelles, les mâles se mesurent les uns aux autres lors de confrontations directes[22] pour maintenir leur statut de dominant et leur territoire. Soit deux mâles se combattent violemment ; soit, le plus souvent, les mâles se livrent à des parades ritualisées destinées à décourager les rivaux potentiels[22]. Ces parades consistent à parcourir leurs petits territoires en émettant des vocalisations[23] et en se mesurant les uns contre les autres aux niveaux des limites de ce territoire[20],[23].






Ce sont les points au niveau desquels les mâles vont s'affronter qui vont définir les limites du territoire d'un mâle[20], ainsi que certains reliefs, comme des rochers plus gros que les autres[23].
Les mâles se mesurent les uns aux autres d'une façon très intense, ce sont de grandes démonstrations d'agressivité. Les deux mâles, impliqués dans un affrontement, se font face bruyamment, la mâchoire ouverte, prêt à attaquer (ou à fuir) si l'un des deux protagonistes franchit la frontière défendue. Ce type de face-à-face est très fréquent mais les affrontements physiques sont rares[23].
Lors du combat, les deux mâles essayent de se mordre à la gueule, au cou, aux nageoires antérieures et à toute partie qu'ils pourraient attraper. Le plus souvent, les deux mâles qui s'affrontent, s'attrapent réciproquement au niveau du cou, mais ne peuvent maintenir la prise à l'aide de leurs mâchoires. Ainsi, l'affrontement se termine rapidement par un retour au statu quo. Chaque mâle s'en sortant avec des plaies légères et quelques poils perdus, dispersés aux vents[23].
Mais, si l'un des deux mâles parvient à maintenir sa prise, il secoue la tête violemment de gauche à droite, utilisant la puissante musculature qu'il possède au niveau du cou pour infliger de profondes balafres. Les morsures au niveau de la gueule et des nageoires antérieures sont également très dangereuses, provoquant de profondes entailles[23].
Ainsi, chaque mâle qui établit un territoire en interdit l'accès à tout autre mâle et cela pendant toute la période des accouplements qui dure deux mois environ[23],[24]. La réussite de ce contrôle exclusif va dépendre de différents facteurs comme l'âge, la taille, la capacité à se battre du mâle mais également sa capacité à tenir un jeûne très long[25]. Car pendant toute la période où un mâle défend son territoire, il ne se nourrit pas. Ainsi, des durées maximales de jeûne de 60 à 70 jours ont été citées chez de nombreuses espèces d'otaries[25], il semble que les mâles de l'otarie subantarctique ne dérogent pas à cette règle[23].
Mise bas et accouplements
Les femelles arrivent sur les colonies un jour ou deux avant de mettre bas[24].

En choisissant de s'installer sur un territoire protégé par un mâle dominant, une femelle en retire trois avantages :
- 1. Les territoires sur lesquels les mâles ont choisi de s'installer sont les plus favorables pour mettre bas et élever leurs petits[20] : à proximité immédiate de la mer[23] (une femelle retrouvera ainsi plus rapidement son petit après un voyage en mer), ces territoires comportent des gros rochers sous lesquels les petits peuvent se cacher pour éviter d'être écrasés par les mâles lorsque ces derniers se déplacent[24].
- 2. Choisir le territoire défendu par un mâle dominant permet également à la femelle d'avoir l'assurance que ce dernier est en bonne condition physique[20]. En effet, un mâle qui possède un territoire convoité a dû, au préalable, vaincre des mâles plus petits, plus faibles ou moins acharnés que lui[22]. En choisissant un mâle dominant pour s'accoupler, la femelle favorise donc le succès reproducteur futur de sa progéniture car le petit issu de cet accouplement héritera des gènes qui ont permis au mâle d'atteindre le statut de reproducteur[22].
- 3. Sur ces territoires, les femelles ont également l'assurance d'être protégées du harcèlement de tous les mâles qui n'ont pu établir de territoire mais qui vont tout de même chercher à se reproduire[20].
La période de parturition commence à la fin du mois de novembre (fin du printemps austral) et se termine début janvier (milieu de l'été austral), la date médiane correspond à la mi-décembre[17],[18],[24]. Cette date médiane se définit comme étant le moment où ont eu lieu la moitié des naissances de toute la saison.
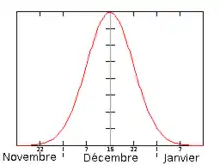
| Colonie de reproduction | Gough Island[17],[18] | Marion Island[18] | Amsterdam Island[24] |
|---|---|---|---|
| Médiane des mises bas |
L'allaitement du petit commence juste après la naissance. La femelle va rester auprès du nouveau-né pour l'allaiter pendant 8 ou 9 jours en moyenne, avant de partir en mer pour se nourrir et reconstituer ses réserves énergétiques[24].
L'œstrus a lieu 6 à 10 jours après la parturition. L'ovulation est spontanée et produit un seul ovule[17]. Ainsi, l'œstrus a lieu juste avant que la femelle ne parte en mer pour son premier voyage[24].
Succès reproducteur des mâles dominants : mitigé ?
On peut penser que les mâles ont un accès exclusif à la reproduction avec les femelles qui ont choisi leurs territoires pour mettre bas et élever leurs petits. En protégeant son territoire des autres mâles, un mâle s'assure qu'il sera le seul à proximité des femelles au moment de l'œstrus. Il sera donc le seul à pouvoir s'accoupler avec elles[20],[25].
Cependant, plusieurs études nuancent l'idée d'un accès exclusif à la reproduction pour les mâles détenteurs d'un territoire chez les espèces d'otariidées.
Gemmell et ses collaborateurs (2001) ont réalisé une étude de paternité à l'aide d'outils de biologie moléculaire sur l'otarie antarctique (Arctocephalus gazella)[26]. Les résultats de cette étude indiquent que 70 % des petits nés sur le site d'étude n'ont aucun lien génétique de parenté avec les mâles qui maintenaient un territoire sur la même colonie l'année précédente. Les auteurs suggèrent l'existence d'accouplements aquatiques avec des mâles patrouillant à proximité des colonies. Ces accouplements aquatiques étaient jusqu'à présent considérés comme anecdotiques pour cette espèce ; les conclusions de cette étude montrent que leur importance est beaucoup plus importante. (Prenez le temps de relire au moins une phrase entière : les conclusions de cette étude montrent que leur importance est beaucoup plus importante)
Francis et Boness (1991) ont étudié les comportements sociaux de l'otarie de Juan Fernandez (Arctocephalus philippii)[27]. Dans l'archipel de Juan Fernandez, la température de l'air atteint, dans l'après-midi, des températures trop élevées pour les otaries, qui sont des animaux adaptés pour plonger dans les eaux froides. En réponse à cette augmentation de température, une partie des femelles quittent les plages et les territoires protégés par les mâles pour aller se rafraichir dans l'eau. Ainsi 30 % des femelles passent l'après-midi à se rafraichir et à se toiletter à l'abri dans des baies protégées. À Juan Fernandez, on observe que les mâles établissent classiquement des territoires directement sur le rivage (39 %), sur des territoires sans accès direct à la mer (45 %) mais également (dans 16 % des cas) des territoires complètement aquatiques qui recouvrent les zones où les femelles viennent nager pour se rafraichir. Sur ces territoires aquatiques, Francis et Bones ont observé que les mâles réalisent avec succès autant d'accouplement avec des femelles que peuvent en réaliser les autres mâles sur les plages.
Ces deux études indiquent une grande plasticité des comportements reproducteurs chez les espèces d'otaries. Si la parturition se fait obligatoirement sur la terre ferme, l'étude de Francis et Boness (1991) montre que les accouplements se réalisent sans problème en milieu aquatique[27]. De plus, l'étude de Gemmell et collaborateurs (2001) semblent indiquer que ce comportement n'est pas réservé uniquement aux espèces s'accouplant sous des latitudes proches des tropiques mais également sous des latitudes plus froides[26]. Aucune étude recensant des accouplements aquatiques n'a été publiée pour l'otarie subantarctique. Cependant deux points importants font qu'il est réaliste d'envisager l'existence de tels accouplements : la présence d'importantes colonies de reproduction à des latitudes élevées[4],[2], avec les contraintes de thermorégulation qui en découlent ; et le fait que l'ovulation a lieu à peu près au même moment que le premier départ en mer des femelles.
Allaitement et voyages en mer

Chez l'otarie subantarctique l'allaitement s'étale sur une période de 10 à 11 mois[17],[18],[19]. Pendant cette période, les femelles vont alterner les périodes d'allaitement sur les colonies avec des voyages en mer pendant lesquelles les femelles se nourrissent pour reconstituer leurs réserves énergétiques[18],[19].
Reproduction et longévité
Bester a réalisé deux études très importantes qui ont permis de bien comprendre le développement de l'activité sexuelle chez cette espèce. Pour cela, il a dû se résoudre à prélever 123 mâles[21] et 89 femelles[17] dans les colonies de reproductions de l'île de Gough. Ce prélèvement a été réalisé sur une période d'un an entre et ; à cette période la population d'otarie subantarctique sur l'île de Gough était estimée à 200 000 individus[2].
Bester a prélevé des animaux de tous les groupes d'âges en se basant sur les caractéristiques morphologiques et sur la taille des animaux au moment de la capture. Ensuite, il a déterminé précisément l'âge des animaux en comptant les lignes de dentines sur des sections de dents. Enfin, il a comparé le développement des organes reproducteurs avec des dosages hormonaux effectués sur des échantillons de sang[21],[17].
Chez les femelles
Dans son étude publiée en 1995, Bester a étudié le développement des organes reproducteurs chez les femelles[17]. En examinant le nombre de femelles en gestation dans chaque tranche d'âge, il observe que la fécondité augmente très rapidement après la puberté pour se maintenir à un taux très élevé entre l'âge de 6 et 11 ans, puis la fécondité diminue fortement pour les classes d'âge supérieures. La femelle la plus âgée sur cet échantillon avait 23 ans.
| Tranche d'âge (en année) | 0 à 3 | 4 | 5 | 6 à 11 | 12 | 13 | 14 à 23 |
|---|---|---|---|---|---|---|---|
| Pourcentage de femelles en gestation | 0 | 42 | 78 | 92 à 100 | 78 | 67 | 25 |
Chez les mâles
Dans l'étude publiée en 1990, Bester a étudié l'apparition de la maturité sexuelle chez les mâles[21]. Il en a déduit que les mâles atteignent la puberté à l'âge de 4 ans et que leur pleine maturité sexuelle est atteinte à l'âge de 8 ans. Bester signale que les caractères sexuels secondaires sont pleinement développés à l'âge de 9 ans, et en se basant sur la taille des testicules, il déduit que les animaux sont pleinement adultes à 10-11 ans.
Sur cet échantillon de 123 animaux, qui se veut représentatif de la population mâle adulte, l'âge observé est compris entre 5 et 10 ans[21]. La longévité maximale observée sur cet échantillon est donc de 10-11 ans. Il est possible que les mâles soient capables d'atteindre des âges plus élevés, à moins qu'ils ne subissent une très forte mortalité après les quelques années de leur vie reproductive qui est très coûteuse à différent points de vue (coûts physiologiques du jeûne, coûts et conséquences des blessures occasionnées lors des combats)[25].
Il semble que ce soit également le cas chez l'otarie antarctique Arctocephalus gazella, qui est une espèce de taille similaire, et dont la durée de vie maximale observée est de 13 ans pour les mâles[25]. De même, chez l'otarie à fourrure du nord (Callorhinus ursinus), on observe un différence similaire de longévité entre les mâles et les femelles. Alors que l'âge maximal observé est de 22 ans pour les femelles, il est de 15 ans pour les mâles[28]. Cette différence est probablement due à l'augmentation du taux de mortalité constaté chez les mâles quand ils atteignent l'âge de 7-10 ans, aussi, c'est pendant cette tranche d'âge et qu'ils sont suffisamment forts pour défendre des territoires[29]. Cette défense des territoires est tellement exigeante en ressources chez cette espèce que les mâles ont en moyenne une vie reproductive limitée à une saison et demie par individu[28], contre 15 à 20 saisons pour les femelles[29].
Une maturation sexuelle différée
La comparaison des deux études indique que, si la puberté est atteinte au même moment dans les deux sexes (4 ans), le maximum de l'activité sexuelle est différent. Pour les femelles, la maturité sexuelle est atteinte entre 6 et 11 ans, alors que pour les mâles, la maturité sexuelle est atteinte à partir de l'âge de 10-11 ans.

Il semble donc que l'on peut expliquer cette différence par la concurrence féroce que se livrent les mâles pour acquérir et défendre un territoire où ils pourront établir un harem et accéder à la reproduction[29]. Il leur faut acquérir une taille suffisante pour pouvoir se mesurer à leurs aînés, ainsi qu'une certaine expérience (capacité à se battre et à jeûner) gagnée après plusieurs années d'essais plus ou moins fructueux[25].
Comportement de plongée des mâles
Il semble que le comportement de plongée des mâles n'ait jamais été étudié, mais si on fait la comparaison avec une autre espèce de taille voisine (Arctocephalus gazella), on peut émettre l'hypothèse qu'ils plongent entre 100 et 200, avec des profondeurs maximales de l'ordre de 400 mètres[30].
Comportement de plongée des femelles en période d'allaitement
Le comportement de plongée des femelles a été bien étudié. En effet, pendant la période d'allaitement, les femelles alternent des périodes à terre où elles allaitent leurs petits et des périodes en mer où elles se nourrissent pour reconstituer leurs réserves énergétiques[31],[32].
Il est donc possible de capturer les femelles quand elles sont à terre, de coller sur leur fourrure un enregistreur de plongée puis de récupérer cet enregistreur et les données qu'il contient quand la femelle revient de son voyage en mer. Ces enregistreurs de plongées sont équipés de capteur de pression et de température, ils permettent donc de connaître à quelle profondeur les animaux plongent, ainsi que la température de l'eau où ils évoluent. Des balises argos miniatures sont également utilisées. Ces balises permettent de connaître la position géographique précise de l'animal qui va être équipé[31],[32].
Georges et ses collaborateurs (2000) ont étudié le comportement de chasse des femelles pendant la lactation. Pour cela, ils ont utilisé des enregistreurs de plongées et des balises argos qu'ils ont déployé sur 29 animaux entre 1995 et 1997 sur l'île Amsterdam. Cette étude montre que les femelles se dirigent directement vers leurs zones de pêches. Un capteur de direction posé sur l'une des femelles a confirmé cette orientation en ligne droite de leurs parcours. Une des femelles a également été équipée d'un enregistreur de la vitesse de nage, l'enregistrement a montré que la femelle s'est très peu arrêtée pour plonger et se nourrir pendant le trajet. La femelle a donc nagé de jour comme de nuit parcourant 40 à 70 km par journée pour rejoindre la zone de pêche. Elle ne s'est reposée que 4 heures par journée et uniquement de jour[32]. Les auteurs en concluent donc que les otaries exploitent des zones de pêches qu'elles connaissent et qu'elles savent retrouver.
Beauplet et ses collaborateurs (2004) ont étudié la localisation des zones de pêches exploitées par les otaries qui se reproduisent à Amsterdam[33]. Ils ont ainsi équipé 41 femelles avec des balises argos et des enregistreurs de plongées en 1999 et en 2002. Leurs résultats montrent qu'une surface très importante de l'océan est exploitée autour de l'île Amsterdam mais les zones exploitées sont précises pour une saison donnée, la répartition des animaux n'est pas aléatoire. Si les femelles trouvent parfois leur nourriture à proximité de l'île, elles exploitent également des zones de pêches situées de 600 à 1 800 km de l'île Amsterdam. Ces zones de pêches sont principalement situées sur le front subtropical ; les auteurs ont observé que les zones de pêche correspondent à des secteurs où le dénivelé bathymétrique est important.


Dans une troisième étude, également publiée en 2000[31], Georges et ses collaborateurs ont décrit le comportement des femelles pendant les plongées. Les résultats obtenus montrent que 99 % des plongées ont lieu la nuit, les femelles chassent leurs proies en période nocturne uniquement. Parmi les 24880 plongées enregistrées au cours de cette étude, la majorité ont eu lieu entre 5 et 50 mètres de profondeur. La durée moyenne d'une plongée varie entre 1 minute et 1 minute 30, avec un intervalle de récupération moyen de 5 à 8 minutes entre chaque plongées. Soit une moyenne d'environ 9 à 10 plongées par heure de chasse. La plongée la plus profonde a atteint 208 mètres pour une durée de 3 minutes et 20 secondes. La plongée la plus longue a duré 6 minutes et 30 secondes pour une profondeur de 50 mètres[31]. Pendant que les femelles sont sur les zones de pêches, il semble qu'elles passent plus de temps à se reposer que pendant le trajet. Ainsi pour une femelle équipée avec un enregistreur de vitesse, Georges et ses collaborateurs ont pu évalué qu'elle a passé environ 10 heures chaque jour à ne rien faire[32].
Si les otaries femelles ne chassent que la nuit, c'est parce que leurs proies se réfugient dans les grandes profondeurs pendant la journée. En effet, les petits poissons et les crustacés pélagiques se nourrissent du plancton en surface. Mais pour échapper à leurs prédateurs qui chassent à vue, ils se réfugient dans les profondeurs pendant la journée et ne remontent se nourrir près de la surface que la nuit pendant laquelle leurs chances de survie sont beaucoup plus importantes. Perissinotto, McQuaid et Pakhomov l'ont montré dans deux études publiées en 1992[34] et 1994[35], et réalisées respectivement à proximité de l'archipel du Prince Édouard dans l'océan Indien et dans l'Atlantique au large de l'Afrique du Sud. À l'aide de sonars et de chaluts, ils ont recherché la position des poissons et crustacés pélagiques dans la colonne d'eau en journée et la nuit. Ils ont montré que les crustacés (du krill principalement) et les poissons (majoritairement représentés par les myctophidés) effectuent des migrations verticales nycthémérales. Ces animaux se réfugient pendant la journée à des profondeurs comprises entre 200 et 400 mètres ; la nuit ils remontent vers la surface pour se nourrir et on les trouve principalement entre 0 et 100 mètres de profondeur[35],[34].
Sur l'île de Gough (Atlantique Sud)
Dans une étude publiée en 1985[36], Bester et Laycock ont étudié le contenu des estomacs des animaux prélevés sur l'île de Gough entre et . Sur les 220 contenus d'estomacs inspectés, 60 % contenaient des restes de proies (becs de céphalopodes, os et otolithes de poissons).
La très grande majorité des restes de proies retrouvés correspondent à des becs de calamars (Ommastrephidae, Histioteuthidae, Onychoteuthidae), il semble donc que les otaries subantarctiques de l'île de Gough se nourrissent principalement de calamars pélagiques. 22 % des estomacs contenaient des pierres. Aussi, de façon anecdotique, il a également été retrouvés des algues marines (5 cas), des coquilles de gastéropodes (2 cas), des plumes de manchots (1 cas), et des restes de siphonophores (1 cas).
On peut émettre l'hypothèse que, comme pour les oiseaux[37], les pierres ingérées participent au processus de broyage mécanique de la digestion qui a lieu dans l'estomac. D'après des expériences menées par Needham (1997), sur des lions de mer d'Australie (Neophoca cinerea), il semble que les pierres agissent également comme un filtre qui retient les grosses particules non digérées (becs de calmars et chairs en cours de digestion) et ne laissent passer que la phase liquide du bol alimentaire[38].
Sur l'île de Marion (Iles du Prince Edouard, Océan Indien)
Klages et Bester ont publié en 1998[39] une étude sur le régime alimentaire des otaries subantarctiques des îles du Prince Édouard (ile de Marion). Pour cela, ils ont étudié le contenu de 245 crottes d'animaux adultes récoltées sur la colonie de Cape Davis entre et . Seuls les excréments frais ont été récoltés puis analysés. Dans ces excréments, les chercheurs ont observé les parties dures des proies qui résistent aux processus de la digestion comme les otolithes et les becs de céphalopodes. Pour identifier les proies de l'otarie, les chercheurs ont ensuite comparé ces restes avec des spécimens de références et des illustrations obtenues dans la littérature scientifique.
Les restes retrouvés sont presque exclusivement des otolithes de Myctophidae, aussi appelés poissons lanternes (ou lanternule) en raison des organes bioluminescents que l'on peut observer sur toute la longueur de leur ventre[40]. Moins de 1 % des otolithes proviennent d'autres familles de poissons et peu de becs de céphalopodes ont été retrouvés. À partir de la taille des otolithes, les chercheurs ont déterminé que la plupart des poissons mesuraient de 5 à 15 cm de long. Ils ont également déterminé que la masse moyenne des proies étaient de 5 grammes, les plus grosses proies pesant 20 à 30 grammes.
Effets du réchauffement climatique
L'espèce et en particulier les jeunes sont soumis à des changements significatifs du climat (température, nourriture)[41], moins manifestes qu'en arctique, mais qui semblent s'accélérer depuis la fin du XXe siècle[42]. Les données génétiques acquises sur trois générations d'otaries à fourrure de l'Antarctique montrent (sans doute en raison du dérèglement climatique) que les individus génétiquement plus diversifiés survivent mieux ou sont plus souvent choisis par les femelles[43] (ce qui pourrait être une des réponses adaptatives possibles au réchauffement[44],[45]) via l'évolution du métagénome de l'espèce[46], mais que la population globale est néanmoins en déclin[47]. Les relations entre l'épigénétique, la diversité génétique intraspécifique, hétérozygotie, la santé des membres d'une espèce (et l'évolution de cette espèce en particulier) sous l'effet d'un stress environnemental[48] tel que des changements globaux sont encore mal comprises[49]. L'étude de l'otarie à fourrure apportera peut-être des informations nouvelles éclairant ces relations.
Notes et références
- The Status of the Amsterdam Island fur seal, FAO, Rome (Italy). 10p. 1976
- ABUNDANCE AND TRENDS OF ANTARCTIC PINNIPED POPULATIONS, Report to the CCAMLR Scientific Committee from the SCAR Group of Specialists on Seals, june 1992.
- Population changes in subantarctic and antarctic fur seals at Marion Island, Hofmeyr, G.J.G., Bester, M.N., Makhado, A.B., Pistorius, P.A., South African Journal of Wildlife Research, 36(1), 55-68, 2006.
- Long term population changes of fur seals Arctocephalus gazella and Arctocephalus tropicalis on subantarctic (Crozet) and subtropical (St Paul and Amsterdam) islands and their possible relationship to El Nino Oscillation, Guinet, C., Jouventin, P., Georges, J.-Y., Antarctic science, Oxford, 6(4), 473-478, 1994.
- Roux, J. P., Subantarctic fur seal, Arctocephalus tropicalis, in french subantarctic territories. NOAA Technical Report NMFS 51 (june 1987). Status, Biology, and Ecology of fur seals. Proceedings of an International Symposium and Workshop Cambridge, England, 23-27, april 1984.
- Records of the Subantarctic fur seal Arctocephalus tropicalis from Rodrigues and Mauritius, Indian Ocean, David, J.H.M., Salmon, L., African Journal of Marine Science, 25, 203-405, 2003.
- A vagrant subantarctic fur seal Arctocephalus tropicalis found in the Comores, David, J.H.M., Mercer, J., Hunter, K., South African Journal of Zoology, 28 (1), 61-62, 1993.
- A record of the subantarctic fur seal, Arctocephalus tropicalis, from Madagascar, Indian Ocean, Guarrigue, C., Ross, G., Marine Mammal Science, 12 (4), 624-627, 1996
- Arctocephalus tropicalis, first record for Rio Grande do Sul coast (Pinnipedia, Otariidae), Castello, H.P., Pinedo, M.C., Atlantica, 2(2), 111-119, (1979)
- A record of the subantarctic fur seal Arctocephalus tropicalis in Angola, Carr, T., Carr, N., David, J.H.M., South African Journal of Zoology / South Africa tydskr dierkd, 20 (2) p77, (1985)
- Presence of Arctocephalus tropicalis (Gray 1872) at the Juan Fernandez archipelago, Chile, Torres, D., Aguayo, A., Acta Zoologica Fennica (1984)
- Records of subantartic fur seals in New Zealand, Taylor, R.H., New Zealand Journal of Marine and Freshwater Research, 24 (4), 499-502, (1990)
- Records of the subantarctic fur seal (Arctocephalus tropicalis) from South Africa with notes on its biology and some observations of captive animals, Shaughnessy, P.D., Ross, G.J.B.
- Fur seals Arctocephalus tropicalis and A. gazella crossing the Antarctic Convergence at South Georgia, Payne, M.R., Mammalia, 43(1), 93-98, (1979)
- Vagrant Subantarctic fur seals at Bouvetoeya, Hofmeyr, G.J.G., Bester, M.N., Kirkman, S.P., African Zoology, 41 (1), 145-146, (2006)
- FAO Species Identification Guide, Marine mammals of the world. Jefferson, T. A., Leatherwood, S., Webber, M. A., United Nations Environment Programme, Food and Agriculture Organization of the United Nations, Rome, 587p. 1993
- Reproduction in the female subantarctic fur seal, Arctocephalus tropicalis. Bester, M. N., Marine Mammal Science, 11 (3), 362-375, 1995.
- Pup growth and maternal attendance patterns in subantarctic fur seals. Kirkman, S. P., Bester, M. N., Hofmeyr, G.J.G., Pistorius, P.A., Makhado, A.B., African Zoology, 37 (1), 13-19, 2002.
- Maternal care in the subantarctic fur seals on Amsterdam island. Georges, J.Y., Guinet, C., Ecology, 81(2), 295-308, 2000.
- Marine Mammal Biology, an evolutionary approach. Edited by Hoelzel, A.R., Blackwell Science Ltd, 432p, 2002. Chapter 10, Life History and Reproductive Strategies, Boness, D.J., Clapham, P.J., Mesnick, R.C.
- Reproduction in the male subantarctic fur seal Arctocephalus tropicalis. Bester, M.N., Journal of Zoology, 222 (2), 177-185, 1990.
- Campbell, N. A., Biology, third edition, De Boeck University Press, 1190p, 1995. Partie IV : Les mécanismes de l'évolution, chapitre 21 : L'évolution des populations.
- Nicolas Servera, Observation personnelle. Terre Australes et Antarctiques Françaises. Archipel Crozet, Ile de la Possession, colonie de reproduction dite de « la Mare aux Eléphants », campagne d'été 2002-2003 (40e mission).
- Early mortality and perinatal growth in the subantarctic fur seal (Arctocephalus tropicalis) on Amsterdam Island. Georges, J.Y., Guinet, C., Journal of Zoology, London, 251, 277-287, 2000.
- McCann, T. S., Male fur seal Tenure. NOAA Technical Report NMFS 51 (june 1987). Status, Biology, and Ecology of fur seals. Proceedings of an International Symposium and Workshop Cambridge, England, 23-27 april 1984.
- Low reproductive success in territorial male Antarctic fur seals (Arctocephalus gazella) suggests the existence of alternative mating strategies. Gemmell, N. J., Burg, T. M., Boyd, I. L., Amos, W., Molecular Ecology, 10 (2), 451-460, 2001.
- Francis, J. M., Boness, D.J., The effect of thermorgulatory behaviour on the mating system of the Juan Fernandez fur seal Arctocephalus philippii, Behaviour, 119 (1-2), 104-126, 1991.
- Vladimirov, V.A., Age-specific reproductive behavior in northern fur seals on the Commander islands. NOAA Technical Report NMFS 51 (june 1987). Status, Biology, and Ecology of fur seals. Proceedings of an International Symposium and Workshop Cambridge, England, 113-120, april 1984.
- COSEWIC Commitee of the Status of Endangered Wildlife In Canada, Status Report on the northern fur seal Callorhinus ursinus in Canada, 2006.
- Green, K., Diving behaviour of antarctic fur seals Arctocephalus gazella Peters around Heard Island. Marine Mammal Research in the southern hemisphere volume 1 : status, ecology and medicine. Edited by Hindell, M., and Kemper, C., Surrey Beatty and sons, Chipping Norton, p97-104, 1997.
- Seasonal diving behaviour in lactating subantarctic fur seals on Amsterdam Island. Georges, J.Y., Tremblay, Y., Guinet, C., Polar Biology, 23, 59-69, 2000.
- Georges, J.Y., Bonadonna, F., Guinet, C., Foraging habitat and diving activity of lactating Subantarctic fur seals in relation to sea-surface temperatures at Amsterdam Island. Marine Ecology Progress Series, 196, 291-304, 2000.
- Beauplet, G., Dubroca, L., Guinet, C., Cherel, Y., Dabin, W., Gagne, C., Hindell, M. Foraging ecology of subantarctic fur seals Arctocephalus tropicalis breeding on Amsterdam Island : seasonal changes in relation to maternal characteristics and pup growth. Marine Ecology Progress Series, 273, 211-225, 2004.
- Perissinotto, R., McQuaid, C.D., Land-based predator impact on vertically migrating zooplankton and micronekton advected to a Southern Ocean archipelago. Marine Ecology Progress Series, 80, 15-27, 1992.
- Pakhomov, E. A., Perissinotto, R., McQuaid, C. D., Comparative structure of the macro-zooplancton / micronekton communities of the Subtropical and Antarctic Polar Fronts. Marine Ecology Progress Series, 111, 155-169, 1994.
- Cephalopod prey of the Sub-Antarctic fur seal, Arctocephalus tropicalis, at Gough Island. Bester, M. N., Laycock, P. A., SCAR Symposium on Antarctic Biology, Wilderness (South Africa), Antarctic Nutrient Cycles and food webs, 551-554, 1985.
- Physiologie animale, mécanismes et adaptations. Eckert, R., Randall, D., Burggren, W., French, K., DeBoeck Université, 1999.
- Needham, D.J., The role of stones in the sea lion stomach : investigations using contrast radiography and fluoroscopy. Marine Mammal Research in the southern hemisphere volume 1 : status, ecology and medicine. Edited by Hindell, M., and Kemper, C., Surrey Beatty and sons, Chipping Norton, p164-169, 1997.
- Fish prey of fur seals Arctocephalus spp. at subantarctic Marion Island. Klages, N. T. W., Bester, M. N., Marine Biology, 131 (3), 559 - 566, 1998.
- Poissons des îles Kerguelen et Crozet, Guide régional de l'océan Austral. Duhamel, G, Gasco, N., Davaine, P., Publications Scientifiques du Muséum d'Histoire Naturelle, Paris, Patrimoines naturels (63), 419p, 2005.
- Forcada, J., Trathan, P. N. T., Reid, K. & Murphy, E. J. The effects of global climate variability in pup production of antarctic fur seals. Ecology 86, 2408–2417 (2005)
- Meredith, M. P. & King, J. C. Rapid climate change in the ocean west of the Antarctic Peninsula during the second half of the 20th century. Geophys. Res. Lett. 32, L19604 (2005)
- Hoffman, J. I., Forcada, J., Trathan, P. N. & Amos, W. Female fur seals show active choice for males that are heterozygous and unrelated. Nature 445, 912–914 (2007)
- Parmesan, C. Ecological and evolutionary responses to recent climate change. Annu. Rev. Ecol. Evol. Syst. 37, 637–669 (2006)
- Hoffmann, A. A. & Sgro, C. M. Climate change and evolutionary adaptation. Nature 470, 479–485 (2011)
- Franks, S. J. & Hoffman, A. A. Genetics of climate change adaptation. Annu. Rev. Genet. 46, 185–208 (2012)
- Tim Coulson & Sonya Clegg (2014) Population biology: Fur seals signal their own decline ; Nature 511, 414–415 (24 juillet 2014) ; doi:10.1038/511414a (résumé)
- Hoffmann, A. A. & Hercus, M. J. (2000) Environmental stress as an evolutionary force. Bioscience 50, 217–226
- Szulkin, M., Bierne, N. & David, P. (2010) Heterozygosity-fitness correlations: a time for reappraisal. Evolution 64, 1202–1217
Liens externes
- (en) Référence Mammal Species of the World (3e éd., 2005) : Arctocephalus tropicalis
- (fr) Référence CITES : taxon Arctocephalus tropicalis (sur le site du ministère français de l'Écologie) (consulté le )
- (fr+en) Référence ITIS : Arctocephalus tropicalis (Gray, 1872)
- (en) Référence Animal Diversity Web : Arctocephalus tropicalis
- (en) Référence NCBI : Arctocephalus tropicalis (taxons inclus)
- (en) Référence UICN : espèce Arctocephalus tropicalis (Gray, 1872) (consulté le )
- (en) Référence CITES : espèce Arctocephalus tropicalis (Gray, 1872) (+ répartition sur Species+) (consulté le )
- Portail des mammifères