Oxétane
L'oxétane ou l'1,3-époxypropane est un composé organique hétérocyclique de formule brute C3H6O qui consiste en un éther cyclique à quatre atomes, trois de carbone et un d'oxygène.
| Oxétane | |
  |
|
| Identification | |
|---|---|
| Nom UICPA | oxétane |
| Synonymes |
oxyde de 1,3-propylène |
| No CAS | |
| No ECHA | 100.007.241 |
| No CE | 207-964-3 |
| No RTECS | RQ6825000 |
| PubChem | 10423 |
| ChEBI | 30965 |
| SMILES | |
| InChI | |
| Apparence | liquide clair à incolore avec une odeur agréable[1] |
| Propriétés chimiques | |
| Formule | C3H6O [Isomères] |
| Masse molaire[2] | 58,079 1 ± 0,003 1 g/mol C 62,04 %, H 10,41 %, O 27,55 %, |
| Propriétés physiques | |
| T° fusion | −97 °C [3] |
| T° ébullition | 48 °C [3] 48 °C à 750 mmHg[1] 50 °C à 760 mmHg[1] |
| Solubilité | miscible en toute proportion à l'eau ou à l'éthanol[1] |
| Masse volumique | 0,893 0 g·cm-3 à 25 °C [3],[1] |
| Point d’éclair | −37 °C [3] −20 °C[4] |
| Limites d’explosivité dans l’air | 2,4 - ? Vol.% [3] |
| Pression de vapeur saturante | 324 mmHg à 25 °C [5] |
| Thermochimie | |
| ΔfH0gaz | −80,54 kJ·mol-1 |
| ΔvapH° | 30,21 kJ·mol-1 [6] |
| Cp | 99,6 J·K-1·mol-1 (liquide,24,85 °C) 61,5 J·K-1·mol-1 (gaz,25 °C)[6] |
| PCI | −1 957,5 kJ·mol-1 (gaz) [6] |
| Propriétés optiques | |
| Indice de réfraction | 1.3905[7] |
| Précautions | |
| SGH[4] | |
  |
|
| NFPA 704[8] | |
| Transport[3] | |
| Écotoxicologie | |
| DL50 | 0,5 g·kg-1 (rat, s.c.) [5] |
| LogP | -0,14 [3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Plus généralement, le terme oxétane réfère aussi à tout composé organique qui contient un cycle oxétane.
Préparation
Une méthode de préparation bien connue et typique est la réaction de l'hydroxyde de potassium sur l'acétate de 3-chloropropyle à 150 °C[7]. Le rendement d'oxétane fait par cette voie est d'environ 40 % parce que cette synthèse peut évidemment conduire à un grand nombre de sous-produits.
D'autres réactions pour préparer de l'oxétane sont la réaction de Paternò-Büchi ou une cyclisation de diol qui peut aussi former un cycle oxétane.
Taxol
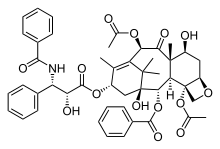
Le paclitaxel (Taxol) est un exemple d'un produit naturel contenant un cycle oxétane. Le Taxol est devenu un centre d'intérêt majeur pour de nombreux chercheurs en raison de sa structure inhabituelle et de ses propriétés d'anti-cancéreux[9]. Son cycle oxétane est une caractéristique importante qui sert dans son activité structurelle de fixation des microtubules.
On connaît cependant peu de chose sur la façon dont la réaction est catalysée naturellement, ce qui est un défi pour les scientifiques qui tentent de reproduire cette réaction[9].
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Oxetane » (voir la liste des auteurs).
- Fiche PubChem 10423
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « 1,3-Propylene oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 9 fövrier 2010 (JavaScript nécessaire)
- Fiche Sigma-Aldrich du composé Trimethylene oxide 97%, consultée le 26/06/2015.
- (en) « Oxétane », sur ChemIDplus, consulté le 9 février 2010
- (en) « Oxetane », sur NIST/WebBook, consulté le 9 février 2010
- C. R. Noller, "trimethylene oxide", Org. Synth., 1955, Coll. Vol. 3, p. 835.
- UCB Université du Colorado
- Willenbring, Dan, and Dean J. Tantillo, "Mechanistic possibilities for oxetane formation in the biosynthesis of Taxol’s D ring.", Russian Journal of General Chemistry, 2008, vol. 78(4), pp.723-731.
- Portail de la chimie

