Trioxyde de rhénium
Le trioxyde de rhénium ou oxyde de rhénium(VI) est un composé inorganique de formule ReO3. C'est un solide rouge ayant un éclat métallique, dont l'apparence ressemble à celle du cuivre. C'est le seul trioxyde stable des éléments du groupe 7 (Mn, Tc, Re).
| Trioxyde de rhénium | ||

| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | trioxorhénium | |
| Synonymes |
rhénia |
|
| No CAS | ||
| No ECHA | 100.013.845 | |
| No CE | 215-228-8 | |
| PubChem | 102110 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre ou cristaux rouge sombre à violet[1] | |
| Propriétés chimiques | ||
| Formule | ReO3 | |
| Masse molaire[2] | 234,205 ± 0,002 g/mol O 20,49 %, Re 79,51 %, |
|
| Susceptibilité magnétique | +16,0 × 10−6 cm3/mol[réf. nécessaire] | |
| Propriétés physiques | ||
| T° fusion | 400 °C (décomp.)[3] | |
| Masse volumique | 6,92 g cm−3[réf. nécessaire] | |
| Cristallographie | ||
| Système cristallin | cubique | |
| Symbole de Pearson | ||
| Classe cristalline ou groupe d’espace | (no 221) |
|
| Propriétés optiques | ||
| Indice de réfraction | 1,68[réf. nécessaire] | |
| Précautions | ||
| SGH[1] | ||
 |
||
| Unités du SI et CNTP, sauf indication contraire. | ||

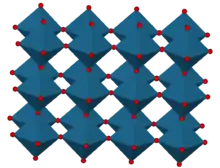
Préparation, structure
Le trioxyde de rhénium peut être produit en réduisant l'oxyde de rhénium(VII) avec le monoxyde de carbone[4] :
- Re2O7 + CO → 2 ReO3 + CO2
Re2O7 peut également être réduit par le dioxane[5].
Cet oxyde de rhénium cristallise avec une cellule élémentaire cubique primitive, groupe d'espace Pm3m (no 221) et un paramètre cristallin de 374,7 pm (3,747 Å)[6]. La structure de ReO3 est similaire à celle d'une pérovskite (ABO3), sans le gros cation A au centre de la cellule élémentaire. Chaque centre rhénium est entouré par un octaèdre défini par six centres oxygène. Ces octaèdres partagent leurs sommets pour former la structure tridimensionnelle. Le nombre de coordination de O vaut 2 car chaque atome d'oxygène a deux atomes Re voisins[7].
ReO3 présente une transition cristalline à 5,2 kbar et 300 K, le groupe d'espace devient Im3 (no 204) avec a = 741(2) pm[8].
Propriétés
Lors du chauffage à 400 °C sous vide, il subit une dismutation[5] :
- 3 ReO3 → Re2O7 + ReO2
ReO3 est un oxyde inhabituel car il présente une résistivité très faible. Il se comporte comme un métal car sa résistivité décroît quand la température décroît. À 300 K, sa résistivité vaut 100,0 nΩ m, tandis qu'à 100 K, elle baisse à 6,0 nΩ m, 17 fois moins qu'à 300 K[7].
Utilisation
Catalyseur d'hydrogénation
Le trioxyde de rhénium est utilisé en synthèse organique comme catalyseur pour la réduction des amides[9].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Rhenium trioxide » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé Rhenium(VI) oxide, consultée le 30 septembre 2019. + (pdf) fiche MSDS.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Rhenium(VI) oxide, 99.9% (metals basis) », sur Alfa Aesar (consulté le ).
- H. Nechamkin, C. F. Hiskey, "Rhenium(VI): Oxide (Rhenium Trioxide)" Inorganic Syntheses, 1950 Volume 3, pp. 186-188. DOI:10.1002/9780470132340.ch49
- G. Glemser "Rhenium (VI) Oxide" Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 2. p. 1482.
- https://www.chemtube3d.com/_reo3final/
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann, (ISBN 0080379419), p. 1047.
- J. E. Schirber, B. Morosin, R. W. Alkire, Allen C. Larson, Phillip J. Vergamini, Structure of ReO3 above the "compressibility collapse" transition, Physical review B, 1984, vol. 29(7), pp. 4150-4152.
- (en) Shigeo Nishimura, Handbook of Heterogeneous Catalytic Hydrogenation for Organic Synthesis, Newyork, Wiley-Interscience, , 408 p. (ISBN 9780471396987, lire en ligne)
- Portail de la chimie