Oxytrichlorure de vanadium
L’oxytrichlorure de vanadium est un composé chimique de formule VOCl3. Il s'agit d'un liquide jaune très oxydant utilisé comme réactif en synthèse organique[4]. Des impuretés de tétrachlorure de vanadium (en) VCl4 induisent souvent une coloration orange ou rouge[5]. Hygroscopique, il s'hydrolyse au contact de l'air en libérant du chlorure d'hydrogène. Il est soluble dans des solvants apolaires tels que le benzène, le dichlorométhane et l'hexane. La solution est diamagnétique du fait de l'état d'oxydation +5 du vanadium dans ce composé.
| Oxytrichlorure de vanadium | |
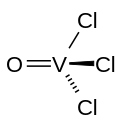
| |
| Structure de l'oxychlorure de vanadium | |
| Identification | |
|---|---|
| Synonymes |
trichlorure de vanadyle |
| No CAS | |
| No ECHA | 100.028.892 |
| No CE | 231-780-2 |
| No RTECS | YW2975000 |
| PubChem | 24410 |
| SMILES | |
| InChI | |
| Apparence | liquide jaune hygroscopique peu volatil[1] |
| Propriétés chimiques | |
| Formule | Cl3OV |
| Masse molaire[2] | 173,3 ± 0,006 g/mol Cl 61,37 %, O 9,23 %, V 29,39 %, |
| Propriétés physiques | |
| T° fusion | −77 °C[1] |
| T° ébullition | 126,7 °C[1] |
| Solubilité | se décomposé violemment au contact de l'eau |
| Masse volumique | 1,826 g/cm3[1] à 20 °C |
| Pression de vapeur saturante | 8,1 hPa[1] à 20 °C |
| Précautions | |
| SGH[1] | |
  Danger |
|
| NFPA 704[3] | |
| Transport[1] | |
| Écotoxicologie | |
| DL50 | 140 mg/kg[1] (souris, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
La molécule a une géométrie tétraédrique, avec un angle de liaison O–V–Cl de 111° et Cl–V–Cl de 108°. Les liaisons V–O et V–Cl ont une longueur respective de 157 et 214 pm. Il est chimiquement comparable au trichlorure de phosphoryle POCl3, mais celui-ci n'est pas oxydant.
Synthèse
On peut obtenir d'oxytrichlorure de vanadium par chloration de l'oxyde de vanadium(V) V2O5 à 600 °C[6] :
Il est également possible d'utiliser de l'oxyde de vanadium(III) V2O3[5] :
Une synthèse de laboratoire plus commune consiste en une chloration de V2O5 par du chlorure de thionyle SOCl2 :
Réactions
Hydrolyse et alcoolyse
L'oxytrichlorure de vanadium s'hydrolyse rapidement en donnant de l'oxyde de vanadium(V) V2O5 et de l'acide chlorhydrique HCl :
Le VOCl3 réagit avec les alcools notamment en présence d'un accepteur de protons pour donner des alcoolates, comme l'illustre la synthèse de l'isopropylate de vanadyle (en) VO(OCH(CH3)2 :
- VOCl3 + 3 HOCH(CH3)2 ⟶ VO(OCH(CH3)2 (en) + 3 HCl.
Interconversions vers d'autres composés V–O–Cl
L'oxytrichlorure est également utilisé pour produire l'oxydichlorure de vanadium (en) VOCl2 :
Il est possible d'obtenir du monochlorure de dioxovanadium (en) VO2Cl à l'aide d'une réaction atypique impliquant le monoxyde de dichlore Cl2O[7] :
À >180 °C, le VO2Cl se décompose en V2O5 et VOCl3 ; le VOCl2 se décompose également pour donner du VOCl3 ainsi que du VOCl.
Formation d'adduits
Le VOCl3 est un acide de Lewis fort, comme l'indique sa tendance à former des adduits avec diverses bases telles que l'acétonitrile et les amines. Lors de la formation des adduits, la coordinence du vanadium passe de 4 avec une géométrie tétraédrique à 6 avec une géométrie octaédrique :
Notes et références
- Entrée « Vandanyl trichloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 juillet 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Vanadium(V) trichloride oxide, V+5 28.5% min », sur Alfa Aesar (consulté le ).
- (en) Michael K. O'Brien et Benoit Vanasse, « Vanadyl Trichloride », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rv004, lire en ligne)
- (en) F. E. Brown, F. A. Griffitts, G. B. Heisig et L. A. Enberg, « Hypovanadous Oxide and Vanadium Oxytrichloride », Inorganic Syntheses, vol. 1, , p. 106-108 (DOI 10.1002/9780470132326.ch38, lire en ligne)
- (en) Arnold Frederik Holleman, Egon Wiberg et Nils Wiberg, Inorganic Chemistry, Academic Press, 2001. (ISBN 978-0123526519)
- (de) H. Oppermann, « Untersuchungen an Vanadinoxidchloriden und Vanadinchloriden. I. Gleichgewichte mit VOCl3, VO2Cl und VOCl2 », Zeitschrift für anorganische und allgemeine Chemie, vol. 351, nos 3-4, , p. 113-126 (DOI 10.1002/zaac.19673510302, lire en ligne)
- Portail de la chimie


