Pentaérythritol
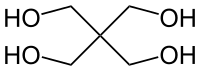
Le pentaérythritol est un composé organique de formule semi-développée C(CH2OH)4. Ce polyol blanc et cristallin avec un squelette néopentane est une brique polyvalente pour la préparation de nombreux composés multifonctionnalisés comme l'explosif PETN ou le tétraacrylate de pentaérythritol[4]. Les dérivés du pentaérythritol sont des composants des résines glycéro, tackifiantes, des vernis, des stabilisateurs du PVC, des esters de tallöl[5] et des antioxydants d'oléfines
| Pentaérythritol | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2,2-bis(hydroxyméthyl)propane-1,3-diol | |
| Synonymes |
2,2-bis(hydroxyméthyl)-1,3-propanediol |
|
| No CAS | ||
| No ECHA | 100.003.732 | |
| No CE | 204-104-9 | |
| No RTECS | RZ2490000 | |
| PubChem | 8285 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C5H12O4 [Isomères] |
|
| Masse molaire[1] | 136,146 4 ± 0,006 g/mol C 44,11 %, H 8,88 %, O 47,01 %, |
|
| Propriétés physiques | ||
| T° fusion | 253 à 258 °C[2] | |
| T° ébullition | 276 °C à 30 mmHg[2] | |
| Solubilité | 5.6 g/100 mL à 15 °C dans l'eau, soluble in méthanol, éthanol, glycérol, éthylène glycol, formamide, insoluble in acétone, benzène, paraffine, éther, CCl4 | |
| Point d’éclair | >150 °C[2] | |
| Pression de vapeur saturante | <1 mmHg à 20 °C[2] | |
| Thermochimie | ||
| Cp | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
Les esters du pentaérythritol sans halogène sont aussi une solution de remplacement des autres liquides de transformateurs électriques plus respectueuse de l'environnement en étant à la fois vraiment biodégradables et non dangereux dans l'eau. Ils se substituent avantageusement aux polychlorobiphényles (PCB) et même aux liquides à base de silicone ou aux hydrocarbures fluorés, comme fluides diélectriques dans les transformateurs. Leur faible volatilité et leur haut point éclair leur donne une excellente résistance à l'inflammation en cas de panne d'électricité majeure et de rupture de transformateur.
Synthèse
Le pentaérythritol peut être préparé par condensation d'acétaldéhyde et de formaldéhyde en milieu basique[6]. Le processus inclut des aldolisations successives suivie d'une réaction de Cannizzaro. Les impuretés produites sont le dipentaérythritol et le tripentaérythritol[7]:
- 2 CH3CHO + 8 CH2O + Ca(OH)2 → 2 C(CH2OH)4 + (HCOO)2Ca
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pentaerythritol » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Pentaerythritol sur Sigma-Aldrich
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 2, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-858-6)
- S. F. Marrian, The Chemical Reactions of Pentaerythritol and its Derivatives, Chemical Reviews, 1948, vol. 43(1), p. 149–202. DOI:10.1021/cr60134a004.
- définition tallöl sur Larousse.fr
- H. B. J. Schurink, Pentaerythritol, Org. Synth., coll. « vol. 1 », , p. 425
- M. S. Peters, J. A. Quinn, Pentaerythritol Production Yields, Industrial & Engineering Chemistry, 1955, vol. 47(9), p. 1710–1713. DOI:10.1021/ie50549a016.
- Portail de la chimie