Chlorure de niobium(V)
Le chlorure de niobium(V) est un composé minéral à base des éléments chlore Cl et niobium Nb, corps chimique de formule simplifiée NbCl5.
| Chlorure de niobium(V) | |
 |
|
| Identification | |
|---|---|
| Nom UICPA | Chlorure de niobium(V) |
| Synonymes |
pentachlorure de niobium, pentachlorure de dinobium |
| No CAS | |
| No ECHA | 100.030.042 |
| No RTECS | QU0350000 |
| PubChem | 24818 |
| SMILES | |
| InChI | |
| Apparence | cristaux jaunes à jaune-blanc brillant, odeur piquante, aspect déliquescent à l'air humide |
| Propriétés chimiques | |
| Formule | NbCl5 |
| Masse molaire[1] | 270,171 ± 0,01 g/mol Cl 65,61 %, Nb 34,39 %, |
| Propriétés physiques | |
| T° fusion | 208,3 °C[2], 204,7 °C [3]. |
| T° ébullition | 248,2 °C[2] |
| Solubilité | Décomposition violente dans l'eau[2] Soluble dans l'éthanol, l'HCl, le chloroforme et le tétrachlorométhane[4] |
| Masse volumique | 2,75 g·cm-3[2] |
| Point d’éclair | ininflammable |
| Thermochimie | |
| ΔfusH° | -797,47 kJ/mol (variation d'entropie 214,05 J.(K.mol)−1). |
| Cristallographie | |
| Système cristallin | Monoclinique |
| Volume | 2,75 g cm−3 |
| Précautions | |
| SGH[5] | |
  |
|
| NFPA 704[5] | |
| Transport[2] | |
| Écotoxicologie | |
| DL50 | 1 400 mg kg−1 (rat, oral)[6] |
| Composés apparentés | |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés physiques et chimiques, structure
Dans les conditions normales de température et de pression, il se présente sous la forme d'un solide cristallin de maille monoclinique et de couleur jaune. Il s'hydrolyse à l'air humide facilement en oxychlorures. Il se décompose dans l'eau froide. Il est soluble dans l'éthanol et dans l'acide chlorhydrique, ainsi que le chloroforme, tétrachlorure de carbone CCl4.
Les échantillons préparés sont souvent contaminés par de petites quantités d'oxychlorure de niobium (en) (NbOCl3). Il est tout de même possible de le purifier par sublimation[7].
La structure du pentachlorure de niobium expliquent ces principales propriétés physiques.
Structure moléculaire
_chloride_Modified.png.webp)
cristallographie par rayons X (données issues de Acta Cryst. (1991). C47, 2435-2437).
À l'état solide, deux unités de chlorure de niobium(V) s'associent par des ponts dichlore stabilisés pour former un dimère, dans une géométrie moléculaire bi-octaédrique grossièrement déformée, où chaque atome de niobium Nb est hexacoordiné, c'est-à-dire avec une coordination de six.
Les longueurs de liaisons sont les suivantes :
- liaison équatoriale entre niobium et chlore terminal : 225 pm
- liaison équatoriale entre niobium et chlore au niveau du pontage ou des ponts : 256 pm
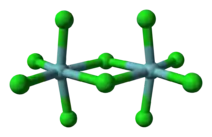 Modèle atomique simplifié du pentachlorure de niobium
Modèle atomique simplifié du pentachlorure de niobium - Liaison axiale entre niobium et chlore : 229,2 pm
L'angle entre un plan axial et équatorial vaut environ 83,7° et l'angle Nb-Cl-Nb vaut près de 101,3°. Il n'y a pas d'interaction métal-métal (entre les atomes de niobium) car ces centres métalliques sont trop éloignés (398,8 pm)[8].
Le bromure de niobium (NbBr5), le chlorure de tantale (TaCl5) et le bromure de tantale (TaBr5) possèdent une même structure ou géométrie moléculaire similaire, alors que l'iodure de niobium (NbI5) et l'iodure de tantale (TaI5) diffèrent par leurs structures moléculaires.
Préparation et production

Au laboratoire, NbCl5 est le plus souvent préparé par chloration du pentoxyde de niobium (Nb2O5), soit par réaction avec du chlorure de thionyle SOCl2, soit par chloration directe par Cl2 en présence de carbone à 300 °C[9]. Dans les deux cas, les réactions restent incomplètes et laissent inévitablement de l'oxychlorure NbOCl3 en petites quantités. Tout se passe comme si entre l'hydrolyse ou oxydation complète (pentaoxyde de niobium), et la chloration complète (pentachlorure de niobium), l'état le plus stable était représenté par des oxohalogénures.
Dans l'industrie, le chlorure de niobium(V) est préparé directement par chloration du niobium métallique porté à une température entre 300 et 350 °C, à pression atmosphérique selon la réaction suivante[10] :
- 2 Nb solide + 5 Cl2 gaz → 2 NbCl5 gaz, ensuite condensé après refroidissement
C'est la principale technique utilisée en industrie.
Utilisations
Il est souvent utilisé comme précurseur pour former d'autres composés du niobium[11].
NbCl5 est le principal précurseur pour former des composés organo-métalliques du type Nb-O− utilisés lors des procédés sol-gel. Il est aussi précurseur pour beaucoup d'autres composés.
En chimie organique, NbCl5, qui est un acide de Lewis, permet d'activer l'alcène ou la double liaison carbone-carbone lors des réactions entre "ène" et "ènophile", aussi bien dans les réactions générales "Alder-ène" que dans la classique réaction de Diels-Alder.
Le chlorure de niobium peut aussi générer des composés inorganiques azotés du type N-acyliminium à partir de pyrrolidines qui servent de substrat à des nucléophiles comme l'allyltrimethylsilane, l'indole ou encore l'éther d'énol silylé de benzophénone[12].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Niobium(V) chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 1er mai 2016 (JavaScript nécessaire)
- selon le Perry's Chemical Engineers' Handbook, sixth edition, 1984
- selon le Perry's (en), sixth edition, 1984
- Fiche Sigma-Aldrich du composé Niobium(V) chloride, consultée le .
- Hygiene and Sanitation, vol. 31(7-9), p. 328, 1966.
- F. Albert Cotton, Geoffrey Wilkinson, Advanced Inorganic Chemistry (4th ed.), New York: Wiley, 1980, (ISBN 0-471-02775-8)
- Cotton, F.A., P. A. Kibala, M. Matusz and R. B. W. Sandor (1991). "Structure of the Second Polymorph of Niobium Pentachloride". Acta Crystallogr. C 47 (11): 2435–2437. doi:10.1107/S0108270191000239.
- D. Brown "Niobium(V) Chloride and Hexachloroniobates(V)" Inorganic Syntheses, 1957 Volume 9, p. 88–92.doi:10.1002/9780470132401.ch24
- Joachim Eckert, Hermann C. Starck "Niobium and Niobium Compounds" Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_251
- Cotton, F. Albert; Wilkinson, Geoffrey (1980), Advanced Inorganic Chemistry (4th ed.), New York: Wiley, (ISBN 0-471-02775-8)
- Andrade, C. K. Z.; Rocha, R. O.; Russowsky, D.; & Godoy, M. N. (2005). "Studies on the Niobium Pentachloride-Mediated Nucleophilic Additions to an Enantiopure Cyclic N-acyliminium Ion Derived from (S)-malic acid" (PDF). J. Braz. Chem. Soc. 16 (3b): 535–539. doi:10.1590/S0103-50532005000400007.
- Portail de la chimie

