Pentafluorure d'iode
Le pentafluorure d'iode est un composé chimique de formule IF5. C'est un liquide jaune pâle dense (3 210 kg·m-3) préparé pour la première fois par Henri Moissan en 1891 en faisant brûler de l'iode solide dans du fluor[3]. C'est toujours cette réaction exothermique qui est utilisée, bien que ses conditions aient été améliorées depuis[4],[5] :
- I2 + 5 F2 → 2 IF5
| Pentafluorure d'iode | |
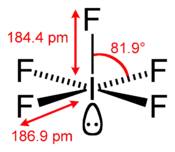  Structure du pentafluorure d'iode |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.029.108 |
| No CE | 232-019-7 |
| Propriétés chimiques | |
| Formule | IF5 |
| Masse molaire[1] | 221,896 49 ± 3,0E−5 g/mol F 42,81 %, I 57,19 %, |
| Propriétés physiques | |
| T° fusion | 9,43 °C |
| T° ébullition | 100,5 °C à 101,3 kPa |
| Solubilité | S'hydrolyse en libérant HF |
| Masse volumique | 3 207 kg·m-3 |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 12,943 ± 0,005 eV (gaz)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
C'est un agent fluorant puissant et très oxydant. Il réagit violemment à l'eau en formant de l'acide fluorhydrique HF.
La molécule IF5 a une géométrie pyramidale carrée, que la théorie VSEPR permet bien d'expliquer :
- l'atome d'iode est au centre de la molécule
- l'un des atomes de fluor est lié à l'iode par une liaison covalente
- la position diamétralement opposée à cet atome de fluor est occupée par un doublet non liant de l'atome d'iode
- les quatre derniers atomes de fluor s'organisent en deux alignements F-I-F orthogonaux formant la base de la pyramide, chaque aligmement F-I-F permettant une liaison à trois centres et quatre électrons
Les cinq atomes de fluor sont donc liés à l'iode par des liaisons de type différent, ce qui se traduit par des longueurs de liaison différentes :
- ~ 184,4 pm pour la liaison I-F covalente
- ~ 186,9 pm pour les liaisons I-F impliquées dans une liaison 3c-4e
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- (en) M. H. Moissan, « Nouvelles Recherches sur le Fluor », Annales de chimie et de physique, vol. 6, , p. 224–282 (lire en ligne)
- (en) Otto Ruff, Keim R., « "Das Jod-7-fluorid" (The iodine-7-fluoride) », Zeitschrift für Anorganische un Allgemeine Chemie, vol. 193, nos 1/2, , p. 176–186 (DOI 10.1002/zaac.19301930117)
- (en) Ruff O., Keim R., « Fluorierung von Verbindungen des Kohlenstoffs (Benzol und Tetrachlormethan mit Jod-5-fluorid, sowie Tetrachlormethan mit Fluor) », Zeitschrift für Anorganische un Allgemeine Chemie, vol. 201, no 1, , p. 245–258 (DOI 10.1002/zaac.19312010122)
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.