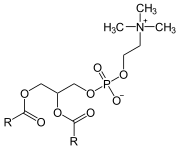
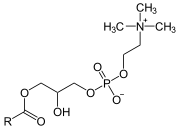
Phospholipase A2
Une phospholipase A2 (PLA2) est une hydrolase qui libère spécifiquement l'acide gras estérifiant l'hydroxyle du carbone 2 du glycérol d'un phosphoglycéride pour donner un lysophospholipide :
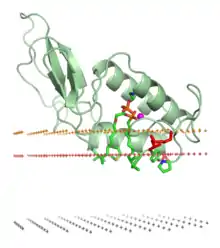
Les marques jaunes indiquent l'extérieur de la membrane cellulaire, tandis que les marques rouges indiquent le domaine aliphatique et les marques noires le plan médian de la bicouche lipidique.
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | Calcium |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Les phospholipases A2 se trouvent dans la plupart des tissus des mammifères ainsi que dans les venins d'insectes et de serpents[1]. Ces derniers contiennent de grandes quantités de mélittine, un peptide de 26 résidus d'acides aminés qui joue le rôle d'activateur des phospholipases A2.
Lorsque l'acide gras libéré de la position 2 du glycérol est l'acide arachidonique, la métabolisation de celui-ci par une cyclooxygénase ou une lipoxygénase conduisent à des eicosanoïdes, parmi lesquels des prostaglandines et des leucotriènes, qui sont des médiateurs de l'inflammation[2]. C'est l'une des raisons des réactions inflammatoires violentes qui accompagnent les morsures de serpents et les piqûres d'insectes[3]. Certaines isoformes des phospholipases A2 pourraient favoriser la genèse de l’athérome[4], d’autres seraient protectrices[5].
Il existe également une phospholipase A2 procaryotique qu’on trouve chez les bactéries et les mycètes.
Cibles thérapeutiques
Le varespladib est un inhibiteur de la phospholipase A2 testé chez les patients ayant un syndrome coronarien aigu mais qui s’est révélé être très décevant : on a relevé une augmentation du taux d’infarctus dans le groupe traité[6].
Le darapladib est un inhibiteur de la phospholipase A2 associée aux lipoprotéines (Lp-PLA2), en cours de test dans les maladies coronariennes.
Voir aussi
Les autres types de phospholipases sont la phospholipase A1, la phospholipase B, la phospholipase C et la phospholipase D.
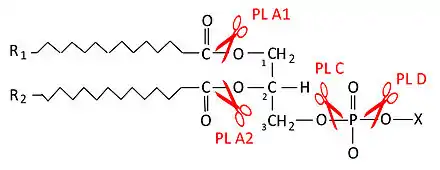
- PLA1 : phospholipase A1,
- PLA2 : phospholipase A2,
- PLC : phospholipase C,
- PLD : phospholipase D.
Notes et références
- (en) Nicolas JP, Lin Y, Lambeau G, Ghomashchi F, Lazdunski M, Gelb MH, « Localization of structural elements of bee venom phospholipase A2 involved in N-type receptor binding and neurotoxicity », J. Biol. Chem., vol. 272, no 11, , p. 7173–81 (PMID 9054413, DOI 10.1074/jbc.272.11.7173, lire en ligne)
- (en) Dennis EA, « Diversity of group types, regulation, and function of phospholipase A2 », J. Biol. Chem., vol. 269, no 18, , p. 13057–60 (PMID 8175726, lire en ligne)
- (en) Argiolas A, Pisano JJ, « Facilitation of phospholipase A2 activity by mastoparans, a new class of mast cell degranulating peptides from wasp venom », J. Biol. Chem., vol. 258, no 22, , p. 13697–702 (PMID 6643447, lire en ligne)
- Rosenson RS, Hurt-Camejo E, Phospholipase A2 enzymes and the risk of atherosclerosis, Eur Heart J, 2012;33:2899-2909
- Ait-Oufella H, Herbin O, Lahoute C et al. Group X secreted phospholipase A2 limits the development of atherosclerosis in LDL receptor-null mice, Arterioscler Thromb Vasc Biol, 2013;33:466-473
- Nicholls SJ, Kastelein JJ, Schwartz GG et al. Varespladib and cardiovascular events in patients with an acute coronary syndrome, The VISTA-16 randomized clinical trial, JAMA, 2014;311:252-262
- Portail de la biochimie
- Portail de la médecine