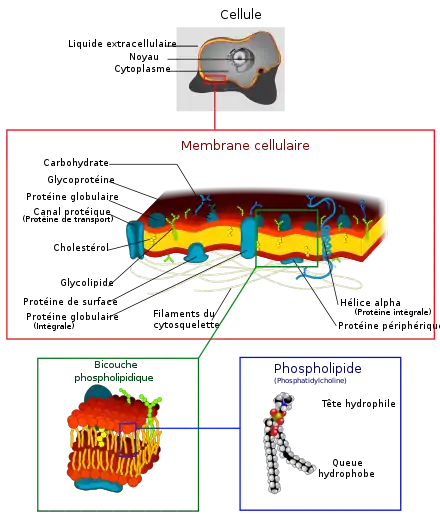
Membrane plasmique
La membrane plasmique, également appelée membrane cellulaire, membrane cytoplasmique, voire plasmalemme, est une membrane biologique séparant l'intérieur d'une cellule, appelé cytoplasme, de son environnement extérieur, c'est-à-dire du milieu extracellulaire. Cette membrane joue un rôle biologique fondamental en isolant la cellule de son environnement. Elle est constituée d'une bicouche lipidique comprenant des phospholipides et du cholestérol permettant d'ajuster la fluidité de l'ensemble en fonction de la température, ainsi que des protéines membranaires intégrales ou périphériques, les premières jouant généralement le rôle de transporteurs membranaires tandis que les secondes interviennent souvent dans les processus intercellulaires, l'interaction avec l'environnement, voire les changements de forme de la cellule[1].
La membrane plasmique contrôle les échanges de matière entre l'intérieur et l'extérieur de la cellule et de ses organites. Elle présente ainsi une perméabilité sélective aux ions et aux petites molécules[2]. Les membranes plasmiques interviennent par ailleurs dans une variété de processus cellulaires telles que l'adhérence cellulaire, la conductivité ionique et la signalisation cellulaire. Elles servent également de support à des structures extracellulaires comme la paroi cellulaire, le glycocalyx et le cytosquelette.
Constituants
Les membranes plasmiques contiennent tout un ensemble de molécules biologiques, essentiellement des lipides et des protéines. Leur composition n'est pas fixe. Elle se modifie constamment en fonction des changements dans l'environnement, et varie au cours du développement de la cellule. C'est par exemple le cas du taux de cholestérol dans la membrane des neurones humains, dont la variation permet de moduler la fluidité de la membrane au cours des différentes étapes du développement de ces cellules[3].
Des molécules peuvent être apportées dans la membrane plasmique, ou retirées de celle-ci, par plusieurs mécanismes. La fusion des vésicules intracellulaires avec la membrane plasmique (exocytose) excrète non seulement le contenu de la vésicule, mais intègre également les constituants de la membrane vésiculaire dans la membrane plasmique. Celle-ci peut former des bulles autour du matériau extracellulaire qui se referment pour former des vésicules (endocytose). Bien que la concentration des constituants de la membrane dans la phase aqueuse environnante reste toujours faible — les constituants membranaires stables sont peu solubles dans l'eau — il existe néanmoins un phénomène d'échange de molécules entre les phases lipidique et aqueuse définies par cette membrane.
Lipides
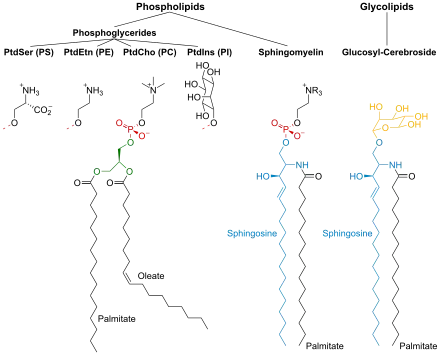
La membrane plasmique comprend trois classes de lipides amphiphiles : les phospholipides, les glycolipides et les stérols. La quantité de chacun dépend du type de cellule, mais, dans la majorité des cas, les phospholipides sont les plus abondants, représentant souvent plus de la moitié des lipides des membranes plasmiques[4],[5]. Les glycolipides ne représentent qu'une fraction d'environ 2 %, et les stérols constituent le reste. Dans le cas des globules rouges, les lipides représentent environ 30 % de la membrane plasmique. Cependant, pour la majorité des cellules d'eucaryotes, la masse des membranes plasmiques est constituée pour moitié de lipides et pour moitié de protéines.
Les chaînes aliphatiques des phospholipides et des glycolipides contiennent généralement un nombre pair d'atomes de carbone, le plus souvent compris entre 16 et 20. Les acides gras à 16 et 18 atomes de carbone sont les plus courants. Ces acides gras peuvent être saturés ou insaturés, la configuration des doubles liaisons étant presque toujours cis. La longueur et le degré d'insaturation des chaînes d'acides gras ont un effet profond sur la fluidité de la membrane, car les lipides insaturés en configuration cis forment un coude qui empêche les acides gras de cristalliser en s'alignant parallèlement les uns aux autres, diminuant ainsi la température de fusion (augmentant la fluidité) de la membrane[4],[5]. La capacité des êtres vivants à réguler la fluidité de leur membrane plasmique en modifiant leur composition lipidique est appelée adaptation homéovisqueuse.
La cohésion de la membrane est entièrement assurée par des interactions non covalentes entre les chaînes aliphatiques, dites « queues hydrophobes », formant une structure relativement fluide qui n'est pas fixée de manière rigide. Dans des conditions physiologiques, les molécules de phospholipides forment un cristal liquide dans la membrane plasmique. Cela signifie que les molécules lipidiques sont libres de diffuser latéralement dans le feuillet de la bicouche lipidique[4]. Cependant, l'échange de molécules de phospholipides entre les feuillets intracellulaires et extracellulaires de la bicouche est un processus bien plus lent. Les radeaux lipidiques et les cavéoles sont des exemples de microdomaines enrichis en cholestérol dans la membrane plasmique[5].
Dans les cellules animales, le cholestérol est normalement dispersé à divers degrés dans les membranes plasmiques, dans les espaces irréguliers entre les queues hydrophobes des lipides membranaires, contribuant à la rigidification et au renforcement mécanique de la membrane[2]. De plus, la quantité de cholestérol dans les membranes biologiques varie selon les organismes, les types de cellules et même dans les cellules individuelles. Le cholestérol, constituant majeur des membranes plasmiques animales, régule la fluidité de l'ensemble de la membrane, ce qui signifie que la concentration du cholestérol dans une membrane contrôle l'intensité des déplacements des divers constituants de la membrane plasmique. À température élevée, le cholestérol inhibe le mouvement des chaînes d'acide gras phospholipidiques, entraînant une réduction de la perméabilité aux petites molécules ainsi qu'une réduction de la fluidité de la membrane. Le cholestérol a l'effet inverse à température plus basse. La production de cholestérol, et donc sa concentration, augmente en réponse au froid. À basses températures, le cholestérol interfère entre les chaînes d'acides gras. Il agit comme un antigel qui maintient la fluidité de la membrane. Il est plus abondant chez les animaux adaptés aux climats froids que chez ceux adaptés aux climats chauds. Chez les plantes, qui sont dépourvues de cholestérol, des composés analogues appelés phytostérols remplissent la même fonction que le cholestérol[2].
Glucides
Les membranes plasmiques contiennent également des glucides, essentiellement sous forme de glycoprotéines, avec une petite fraction de glycolipides, tels que cérébrosides et gangliosides. Ces glucides jouent un rôle prépondérant dans la reconnaissance intercellulaire (en) chez les eucaryotes. Ils sont localisés sur la surface de la cellule, d'où ils permettent l'identification de la cellule et la transmission d'informations. Un virus qui se lie à une cellule hôte à l'aide de tels récepteurs peut y provoquer une infection[6]. La glycosylation se produit presque exclusivement sur la face extérieure de la membrane plasmique. Le glycocalyx est une structure importante des cellules, notamment celles de l'épithélium avec microvillosités, et pourrait être impliqué dans l'adhérence cellulaire, la migration des lymphocytes[6] et bien d'autres processus. L'ose terminal est un acide sialique et l'avant-dernier est un résidu de galactose, tandis que le squelette osidique est mis en forme dans l'appareil de Golgi. L'acide sialique porte une charge électrique négative, ce qui lui confère un rôle de barrière contre les particules chargées.
Protéines
La membrane plasmique contient une grande quantité de protéines, généralement environ 50 % du volume de la membrane. Ces protéines sont importantes pour la cellule car elles sont responsables de diverses activités biologiques. Environ un tiers des gènes des levures codent spécifiquement de telles protéines membranaires, et cette proportion est encore plus élevée dans les organismes multicellulaires[4]. Les protéines membranaires se répartissent en trois groupes principaux : les protéines intégrales, les protéines périphériques et les protéines à ancrage lipidique[2].
Les protéines intégrales sont des protéines transmembranaires amphiphiles. Ce sont par exemple des canaux ioniques, les pompes à protons et les récepteurs couplés aux protéines G. Les canaux ioniques permettent aux ions minéraux tels que les cations de sodium Na+, de potassium K+, de calcium Ca2+ ou l'anion chlorure Cl– de diffuser leur gradient électrochimique à travers la bicouche lipidique en franchissant les pores hydrophiles qui traversent la membrane. Les propriétés électriques de certaines cellules, comme les neurones, sont contrôlées par de tels canaux ioniques[2]. Les pompes à protons sont des pompes protéiques intégrées à la bicouche lipidique permettant aux protons de traverser la membrane en passant d'un feuillet à l'autre. Des processus tels que le transport d'électrons et la production d'ATP par la phosphorylation oxydative utilisent des pompes à protons. Un récepteur couplé aux protéines G est une chaîne polypeptidique unique qui traverse sept fois la bicouche lipidique et est réceptif à certaines molécules telles que des hormones et neurotransmetteurs. Les récepteurs couplés aux protéines G interviennent dans des processus tels que la signalisation cellulaire, la régulation de la production d'AMP cyclique et la régulation des canaux ioniques[2].
| Type | Description | Exemples |
|---|---|---|
| Protéines intégrales ou protéines transmembranaires |
S'étendent à travers la membrane et présentent un domaine cytosolique hydrophile, qui interagit avec les molécules internes, un domaine transmembranaire hydrophobe qui l'ancre dans la membrane plasmique et un domaine extracellulaire hydrophile qui interagit avec les molécules externes. Le domaine hydrophobe consiste en la combinaison d'une ou plusieurs hélices α et de motifs en feuillet β. | Canaux ioniques, pompes à protons, récepteurs coulpés aux protéines G. |
| Protéines à ancrage lipidique | Liées de manière covalente à une ou plusieurs molécules de lipides insérées de manière hydrophobe dans la membrane plasmique ce qui permet d'amarrer la protéine à cette membrane ; la protéine elle-même n'est pas en contact avec la membrane. | Protéines G. |
| Protéines membranaires périphériques | Liées à des protéines membranaires intégrales ou associées à des régions périphériques de la bicouche lipidique, ces protéines ont tendance à n'avoir que des interactions temporaires avec les membranes biologiques avant de s'en dissocier pour poursuivre leur action dans le cytoplasme. | Certaines enzymes, certaines hormones peptidiques. |
La membrane plasmique étant exposée à l'environnement extérieur, elle est un élément important de la communication intercellulaire. Par conséquent, la surface de cette membrane présente une grande variété de protéines réceptrices et de protéines d'identification, tels que des antigènes. Parmi les fonctions d'une membrane plasmique, on note le contact intercellulaire, la reconnaissance intercellulaire (en), le contact des cytosquelettes, la signalisation cellulaire, la réalisation de certains processus enzymatiques, et le transport membranaire.
La plupart des protéines membranaires doivent être insérées de manière dirigée dans la membrane[7]. À cette fin, une séquence signal N-terminale d'acides aminés oriente les protéines vers le réticulum endoplasmique, où elles sont insérées dans une bicouche lipidique. De là, les protéines sont transportées vers leur destination finale dans des vésicules à travers le système endomembranaire.
Étude à l'aide de liposomes
Les liposomes, ou vésicules lipidiques, sont des poches grossièrement sphériques délimitées par une bicouche lipidique[8]. Ces structures sont utilisées au laboratoire pour étudier les effets de diverses molécules en les injectant directement à l'intérieur des cellules ainsi que pour mieux comprendre la perméabilité de la membrane plasmique. On obtient des liposomes en mettant un lipide en suspension dans une solution aqueuse puis en agitant le mélange par sonication. En mesurant le taux d'efflux de l'intérieur du liposome vers la solution extérieure, il est possible de tester la perméabilité de la membrane pour différents composés. On peut ainsi produire des liposomes chargés d'ions ou de petites molécules présentes dans la solution. Il est également possible de solubiliser des protéines à l'aide de détergents pour les intégrer dans les membranes des liposomes. Cette méthode permet d'étudier les fonctions des protéines membranaires.
Architecture fonctionnelle de la membrane plasmique
Modèle de la mosaïque fluide
Le modèle de la mosaïque fluide (en) a été proposé en 1972[9] et reste d'actualité un demi-siècle plus tard[10]. Il décrit les membranes biologiques comme des liquides bidimensionnels de lipides et de protéines liposolubles diffusant latéralement entre deux phases aqueuses de manière plus ou moins fluide. Les protéines membranaires constituent une fraction importante de ces membranes et y introduisent diverses structures telles que des complexes protéiques (en), des « piquets » et des « clôtures » formés par le cytosquelette à base d'actine, voire des radeaux lipidiques.
Ce modèle met en évidence l'importance de la fluidité membranaire qui « est un excellent compromis pour la cellule ; une membrane trop rigide serait gênante pour la mobilité, alors qu'une membrane trop fluide ne permettrait pas l'organisation de la structure cellulaire ni le support structurel de la cellule. La fluidité membranaire autorise les interactions au sein de la membrane, tel que l'assemblage des protéines membranaires. Elle permet également le mouvement de composants membranaires responsables de processus cellulaires tels que le mouvement cellulaire, la croissance, la division, la sécrétion et la formation de jonctions cellulaires. La fluidité membranaire permet également à la bicouche lipidique de se refermer si elle est tordue ou piquée[11]. »
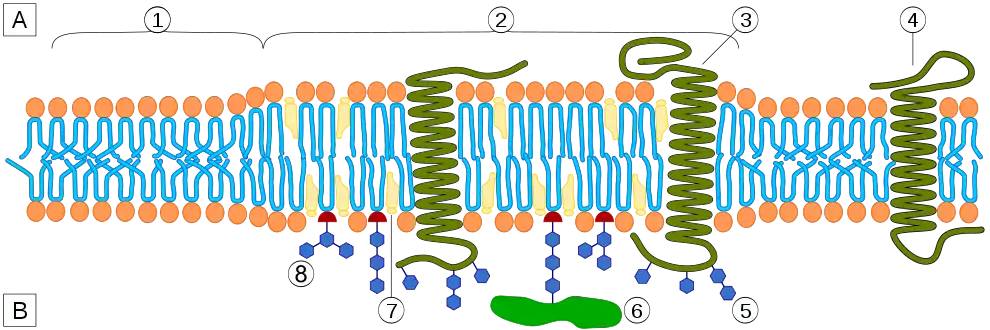 Membrane plasmique et structures protéiques : [A] cytosol ; [B] milieu extracellulaire ; (1) bicouche lipidique ; (2) radeau lipidique ; (3) radeau lipidique associé à des protéines transmembranaires ; (4) protéines transmembranaires ; (5) glycosylation de glycolipides et de glycoprotéines par modification post-traductionnelle ; (6) protéine à ancrage lipidique liée à une molécule de GPI ; (7) cholestérol ; (8) glycolipide.
Membrane plasmique et structures protéiques : [A] cytosol ; [B] milieu extracellulaire ; (1) bicouche lipidique ; (2) radeau lipidique ; (3) radeau lipidique associé à des protéines transmembranaires ; (4) protéines transmembranaires ; (5) glycosylation de glycolipides et de glycoprotéines par modification post-traductionnelle ; (6) protéine à ancrage lipidique liée à une molécule de GPI ; (7) cholestérol ; (8) glycolipide.
Bicouche lipidique
Les bicouches lipidiques se forment par auto-assemblage. La membrane plasmique consiste essentiellement en une fine couche de phospholipides amphiphiles qui s'organisent spontanément de telle sorte que les « queues » hydrophobes soient isolées du milieu aqueux environnant tandis que les « têtes » hydrophiles s'orientent pour les unes au contact du milieu extracellulaire et pour les autres au contact du cytosol. Cela conduit à la formation d'une bicouche lipidique continue, constituée de deux feuillets, qui tend à se refermer sur elle-même. L'effet hydrophobe est le principal moteur de ce processus. L'assemblage des molécules hydrophobes permet aux molécules d'eau d'interagir entre elles plus librement, ce qui accroît l'entropie du système. Cette interaction complexe peut inclure des interactions non covalentes telles que des liaisons de van der Waals, des liaisons ioniques et des liaisons hydrogène.
Les bicouches lipidiques sont généralement imperméables aux ions et aux molécules polaires. La disposition des têtes hydrophiles et des queues hydrophobes bloque la diffusion des solutés polaires à travers la membrane, comme les acides aminés, les acides nucléiques, les glucides, les protéines et les ions, mais permet généralement la diffusion passive de molécules hydrophobes. Cela permet aux cellules de contrôler le mouvement de ces substances à travers leur membrane plasmique à l'aide de complexes de protéines transmembranaires tels que les pores et les canaux. Les flippases et les scramblases concentrent la phosphatidylsérine, porteuse d'une charge électrique négative, dans le feuillet interne de la membrane, du côté du cytosol. Avec les acides sialiques, également chargés négativement, cela forme une barrière bloquant la diffusion des résidus chargés à travers la membrane.
La structure en mosaïque fluide de la bicouche lipide comprenant des protéines membranaires spécifiques permet d'expliquer la perméabilité sélective des membranes ainsi que les mécanismes de transport actif et de transport passif. De plus, les membranes des procaryotes, celles des mitochondries chez les eucaryotes et des chloroplastes chez les plantes permettent la phosphorylation oxydative par chimiosmose.
Composants chimiques
Les protéines trans-membranaires qui sont liées par un GPI peuvent être clivées par des enzymes appelées protéases. Ces protéases effectuent des coupures qui peuvent avoir lieu dans le milieu extracellulaire ou cytosolique (grâce aux protéines caspases). Cela a été découvert lors de l’apoptose (mort programmée de la cellule). C’est ce qui fait que nous n’avons pas des mains en forme de palmes).
Pour les cultures des cellules eucaryotes : Respecter les températures.
Échanges avec l’extérieur
Sur les membranes plasmiques des cellules, on a des lieux d’échange entre les deux milieux. On dit souvent que les cellules épithéliales sont polarisées : deux domaines particuliers : le pôle apical et le pôle basolatéral : distinction au niveau de la composition en protéines, etc. Le pôle apical constitue une zone d’interactions entre les protéines membranaires et le cytosquelette, il y a notamment des structures appelées des microvillosités : extensions cytoplasmiques (de diamètre : 0,1 µm). Au sein de ces microvillosités, on a des microfilaments d’actine (un des trois composants du cytosquelette) associés à des protéines : échanges avec le milieu extracellulaire.
Exemple : les cellules épithéliales du système intestinal ont à leur surface des microvillosités permettant l'absorption des aliments. Zone apicale : lumière de l’intestin.
La face basolatérale : face sur laquelle les cellules sont tournées vers le tissu conjonctif. Cette face sert au transfert vers les vaisseaux sanguins des aliments absorbés. On a des replis membranaires servant dans les échanges hydro-minéraux (cellules rénales, glandes salivaires). On a aussi dans certaines cellules des cils (système respiratoire) : extensions cytoplasmiques : microtubules et protéines associées. Au niveau des bronches, ce sont les battements de ces cils qui permettent l’évacuation des microbes sous forme de mucus.
Principales fonctions de la membrane plasmique
La membrane plasmique entoure le cytoplasme des cellules vivantes, séparant physiquement les composants intracellulaires du milieu extracellulaire. La membrane plasmique joue également un rôle dans l'ancrage du cytosquelette pour conférer une forme précise à la cellule, ainsi que dans la fixation à la matrice extracellulaire et aux autres cellules pour les maintenir ensemble et former des tissus. Les champignons, les bactéries, la plupart des archées et les plantes ont également une paroi cellulaire, qui offre un support mécanique à la cellule et empêche le passage de molécules plus grosses.
Comme toutes les membranes biologiques, la membrane plasmique présente une perméabilité sélective lui permettant de réguler ce qui entre et ce qui sort de la cellule, facilitant ainsi le transport des substances nécessaires à la cellule pour vivre. Le mouvement de ces substances à travers la membrane peut être soit « passif », se produisant sans apport d'énergie biochimique, soit « actif », nécessitant que la cellule fournisse de l'énergie pour assurer ce mouvement. La membrane maintient également un potentiel électrochimique de membrane. La membrane plasmique fonctionne ainsi comme un filtre sélectif qui ne permet qu'à certaines espèces chimiques d'entrer ou de sortir de la cellule. La cellule utilise différents types de mécanismes de transport impliquant des membranes biologiques :
- Osmose et diffusion passive : certaines substances (petites molécules, ions) telles que le dioxyde de carbone CO2 et l'oxygène O2 peuvent traverser la membrane plasmique par diffusion, qui est un processus de transport passif. La membrane agissant comme une barrière sélective pour certaines molécules et certains ions, ceux-ci peuvent se trouver à des concentrations différentes de part et d'autre de la membrane. La diffusion intervient lorsque de petites molécules ou des ions se déplacent librement du côté de la membrane où leur concenration est élevée vers le côté où leur concentration est faible afin d'équilibrer les deux côtés de la membrane. Il s'agit d'un processus de transport passif car il ne nécessite pas d'apport d'énergie et est propulsé par le gradient de concentration à travers la membrane[12]. Un tel gradient de concentration à travers une membrane semi-perméable crée un flux d'eau par osmose. L'osmose, dans les systèmes biologiques, implique un solvant qui se déplace à travers une membrane semi-perméable de manière semblable à la diffusion passive car le solvant suit le gradient de concentration et son déplacement ne nécessite aucun apport d'énergie. Bien que l'eau soit le solvant le plus courant dans la cellule, il peut également s'agir d'autres liquides ainsi que des fluides supercritiques[13] ;
- Canaux et transporteurs transmembranaires : les protéines transmembranaires s'étendent à travers la bicouche lipidique des membranes ; ils fonctionnent des deux côtés de la membrane pour permettre à des molécules et des ions de la traverser[14]. Les nutriments, tels que les oses et les acides aminés, doivent pénétrer dans la cellule et certains produits du métabolisme doivent quitter la cellule. Ces molécules peuvent diffuser passivement à travers des canaux protéiques tels que les aquaporines par diffusion facilitée ou sont pompées à travers la membrane par des transporteurs membranaires. Les protéines des canaux protéiques, également appelées perméases, sont généralement assez spécifiques, et elles ne reconnaissent et ne transportent qu'une variété limitée de substances chimiques, souvent restreinte à une seule substance. Les récepteurs de surface cellulaire sont un autre exemple de protéines transmembranaires, qui permet aux molécules de signalisation cellulaire de communiquer entre les cellules[14] ;
- Endocytose : l'endocytose est le processus par lequel les cellules absorbent des molécules voire des particules en les engloutissant. La membrane plasmique forme une petite dépression, dite invagination, dans laquelle la substance à transporter est capturée. Cette invagination est provoquée par des protéines situées du côté extérieur de la membrane plasmique qui agissent comme des récepteurs et conduisent à l'accumulation de protéines et de lipides du côté cytosolique de la membrane[15]. L'invagination se détache ensuite de la membrane à l'intérieur de la cellule, créant une vésicule contenant la substance capturée. L'endocytose est une voie d'internalisation des particules solides (phagocytose), des petites molécules et des ions (pinocytose), ainsi que des macromolécules. L'endocytose nécessite de l'énergie et est donc une forme de transport actif ;
- Exocytose : la membrane d'une vésicule peut être fusionnée avec la membrane plasmique, libérant son contenu dans le milieu extracellulaire. L'exocytose se produit dans diverses cellules pour éliminer les résidus non métabolisés de substances apportées par l'endocytose, pour sécréter des substances telles que les hormones et des enzymes et pour transporter une substance à travers une barrière cellulaire. Au cours de l'exocytose, la vacuole alimentaire non digérée contenant des déchets ou la vésicule sécrétoire bourgeonnée de l'appareil de Golgi est d'abord déplacée par le cytosquelette de l'intérieur de la cellule vers la surface. La membrane vésiculaire entre en contact avec la membrane plasmique. Les molécules lipidiques des deux bicouches se réorganisent et les deux membranes sont ainsi fusionnées. Un passage se forme dans la membrane fusionnée et les vésicules déchargent leur contenu à l'extérieur de la cellule.
Transports
Transport passif sans perméases
Correspond à ce qu’on appelle la diffusion simple : sans consommation d’énergie. Aucune protéine membranaire n’intervient. Les molécules (ex. : hormones lipophiles et liposolubles) sont prises dans la bicouche lipidique puis vont diffuser et repasser de l’autre côté de la membrane. Elle s’effectue selon le gradient de concentration (du milieu le plus concentré vers le moins concentré). Les particules qui diffusent à travers la membrane plasmique sous forme de diffusion simple sont les molécules liposolubles (ou hydrophobes) non polaires et les petites molécules polaires non chargées (comme l'eau, l'urée, etc.). Ce type de transport ne fait donc pas intervenir de phénomènes de saturation.
Transport passif avec perméases
On l'appelle la diffusion facilitée : transport passif, pas d'énergie avec perméases : nécessite une glycoprotéine transmembranaire : le transporteur passif. Canal ionique : complexe de protéines. Ce transport se déroule dans les deux sens selon le potentiel électrique établi à travers la membrane par les molécules chargées. Dans la diffusion facilitée, les molécules ne se dissolvent pas dans la bicouche, elles sont prises en charge par des protéines : permet de protéger les petites molécules de tout contact avec le cœur hydrophobe. La diffusion facilitée permet aux molécules polaires (sucres, acides aminés, ions…) chargées de traverser cette membrane plasmique. Exemple d’un système facilité : pour le glucose, la perméase va alterner entre deux conformations possibles : le site de fixation du glucose est tourné vers l’extérieur faisant basculer le transporteur poussant le site de fixation vers l’intérieur de la cellule libérant tout le glucose. Cette diffusion facilitée va donc créer un flux continu de glucose comme le milieu extracellulaire est plus concentré que le milieu intracellulaire. Ce glucose disparaît vite car il est métabolisé rapidement. Ainsi la concentration intra n’augmente pas et on a une arrivée permanente de glucose dans la cellule.
Autre exemple : Les canaux ioniques dépendent de la concentration et de la charge des ions : reposent sur différentes propriétés.
- Le passage est très rapide (1 million d’ions par seconde traversent un canal ouvert).
- Ces canaux sont très sélectifs car leur pores sont très étroits.
- Et ils sont intermittents. Il faut un signal (stimulus) pour l’ouverture.
Il existe deux types de canaux selon le type d’ouverture, les canaux ioniques ligands-dépendants, fixation d’un ligand sur le canal (un neurotransmetteur par exemple agissant sur le milieu extracellulaire, ou de l’ATP, etc., agissant sur le milieu intracellulaire). Le fonctionnement des canaux est contrôlé par le potentiel de membrane et ses variations. On distingue différents types de canaux qui sont potentiels dépendants : Na+, K+, Cl-, etc. Ce potentiel membranaire est défini par une équation, comprenant la charge des ions. Le potentiel membranaire est fixé par tous les ions de la membrane.
Chez le calamar, au repos cet axone est plus perméable aux K+ et Na+ qu’aux autres, quand on a un influx nerveux, la membrane se dépolarise. Ceci est dû à l’ouverture et la fermeture très rapide des canaux ioniques Na+ et K+. Cette dépolarisation successive des régions des membranes plasmiques permet la transmission rapide tout le long de l’axone.
Les hormones non lipidiques sont transportées à travers la paroi par un relais membranaire (récepteur spécifique).
Transports actifs avec perméase
Présentent deux caractéristiques : le transport est couplé avec un mécanisme qui va produire de l’énergie. Le transport fonctionne contre le gradient de concentration. Il peut y avoir consommation d’ATP, dans ce cas la perméase se nomme : Pompe Na, K/ATPase, véritable pompe. Leur rôle est de maintenir le gradient ionique à travers la membrane plasmique. 3 Na+ pour deux ions K+ : les ions Na+ commencent à se fixer à des sites de haute affinité : phosphorylation de l’ATP qui modifie la pompe (changement de conformation), simultanément les ions K+ se fixent à des sites accessibles à la surface cellulaire engendrant une hydrolyse des groupements phosphates liés à la membrane entraînant un changement de conformation, les zones d’affinités sont moins importantes : libération de K+ dans le cytoplasme. Cette pompe a plusieurs fonctions essentielles pour la cellule : ajuste la pression osmotique et le volume cellulaire.
Deuxième type de transport actif lié aussi à une ATPase : transporteur ABC. Formé de deux protomères. Chacun d’eux comportent six domaines transmembranaires. Ces transporteurs, présents dans les cellules normales ou cancéreuses, sont aussi appelés PGT. Dans les cellules du foie, elles permettent d’éliminer les substances toxiques, dans les cellules cancéreuses, ces transporteurs permettent de rejeter certain types de médicaments anti cancéreux (permet à la cellule cancéreuse de résister au traitement : chimiorésistance).
Couplage d’un transport actif et passif
Si les deux transports se déplacent dans le même sens, on parle de symport. À l'inverse si les transports s'effectuent dans des sens contraires on parle d'antiport.
Exemple : glucose et Na+ où l’absorption du glucose s’effectue sur un transporteur transportant en même temps deux ions Na+ et une molécule de glucose. Le flux d’ions Na+, fournit l’énergie nécessaire pour que la cellule importe le glucose alimentaire. Les ions K+ sont importés par Na+. Cet échangeur Na+ (passif) et H+ (actif) entraine le PH cytosolique.
Transports cytotiques
Les transports qui suivent sont qualifiés de transports cytotiques, ils ne sont donc ni actifs, ni passifs. Ces transports sont uniquement possibles par mouvements de membrane, il s'agit en fait d'un transport effectué par des vésicules de membrane.
- L'endocytose : transfert du milieu extra- vers le milieu intracellulaire. C’est l’inverse pour l’exocytose. Ces phénomènes ont lieu continuellement.
- La pinocytose : entrée d’un faible volume dans la membrane plasmique et ingéré dans la cellule, sur la membrane on a des revêtements glycoprotéiques piégeant les petites particules.
Notes et références
- (en) Tom Herrmann et Sandeep Sharma, « Physiology, Membrane », StatPearls, (PMID 30855799, lire en ligne)
- (en) B. Alberts, A. Johnson, J. Lewis et al. Molecular Biology of the Cell, 4e éd., Garland Science, New York, 2002. (ISBN 978-0-8153-3218-3)
- (en) Pakiza Noutsi, Enrico Gratton et Sahraoui Chaieb, « Assessment of Membrane Fluidity Fluctuations during Cellular Development Reveals Time and Cell Type Specificity », PLoS One, vol. 11, no 6, , article no e0158313 (PMID 27362860, PMCID 4928918, DOI 10.1371/journal.pone.0158313, Bibcode 2016PLoSO..1158313N)
- (en) H. Lodish, A. Berk, L. S. Zipursky, et al. « Biomembranes: Structural Organization and Basic Functions », Molecular Cell Biology, 4e éd., Scientific American Books, New York, 2000. (ISBN 978-0-7167-3136-8)
- (en) Geoffrey M. Cooper, « The Cell: A Molecular Approach. 2nd edition. », Sinauer Associates, (ISBN 0-87893-106-6, consulté le ).
- (en) Brian K. Brandley et Ronald L. Schnaar, « Cell‐Surface Carbohydrates in Cell Recognition and Response », Journal of Leukocyte Biology, vol. 40, no 1, , p. 97-111 (PMID 3011937, DOI 10.1002/jlb.40.1.97, lire en ligne)
- (en) Harvey Lodish, Arnold Berk, S Lawrence Zipursky, Paul Matsudaira, David Baltimore, and James Darnell., « Molecular Cell Biology, 4th edition : Section 17.6 – Post-Translational Modifications and Quality Control in the Rough ER », W. H. Freeman, (ISBN 0-7167-3136-3, consulté le ).
- (en) Harvey Lodish, Arnold Berk, S Lawrence Zipursky, Paul Matsudaira, David Baltimore et James Darnell, « Molecular Cell Biology, 4th edition : Section 5.3 – Biomembranes: Structural Organization and Basic Functions », W. H. Freeman, (ISBN 0-7167-3136-3, consulté le ).
- (en) Seymour J. Singer et Garth L. Nicolson, « The Fluid Mosaic Model of the Structure of Cell Membranes », Science, vol. 175, no 4023, , p. 720-731 (PMID 4333397, DOI 10.1126/science.175.4023.720, JSTOR 1733071, Bibcode 1972Sci...175..720S, lire en ligne)
- (en) Garth L. Nicolson, « The Fluid—Mosaic Model of Membrane Structure: Still relevant to understanding the structure, function and dynamics of biological membranes after more than 40 years », Biochimica et Biophysica Acta (BBA) - Biomembranes, vol. 1838, no 6, , p. 1451-1466 (PMID 24189436, DOI 10.1016/j.bbamem.2013.10.019, lire en ligne)
- Gerard J Tortora, Bryan Derrickson, Anatomie et physiologie, De Boeck supérieur, , p. 64.
- (en) Geoffrey M. Cooper, « Transport of Small Molecules », The Cell: A Molecular Approach, 2e éd., Sinauer Associates, Sunderland, 2000. (ISBN 0-87893-106-6)
- (en) Eric M. Kramer et David R. Myers, « Osmosis is not driven by water dilution », Trends in Plants Sciences, vol. 18, no 4, , p. 195-197 (PMID 23298880, DOI 10.1016/j.tplants.2012.12.001, lire en ligne)
- (en) B. Alberts, A. Johnson, J. Lewis, M. Raff, K. Roberts et P. Walter, « Membrane Proteins », Molecular Biology of the Cell, 4e éd., Garland Science, New York, 2002. (ISBN 0-8153-4072-9)
- (en) B. Alberts, A. Johnson, J. Lewis, M. Raff, K. Roberts et P. Walter, « Transport into the Cell from the Plasma Membrane: Endocytosis », Molecular Biology of the Cell, 4e éd., Garland Science, New York, 2002. (ISBN 0-8153-4072-9)
Voir aussi
- Portail de la biologie cellulaire et moléculaire