Réticulum endoplasmique
En biologie cellulaire, le réticulum endoplasmique (forme abrégée : RE) est un organite présent dans les cellules eucaryotes et lié à la membrane nucléaire. Il synthétise les protéines, produit des macromolécules et transfère des substances vers l'appareil de Golgi via des vésicules. C'est l'organite se situant à la base du système endomembranaire des cellules eucaryotes. Il faut tout de même préciser que les protéines synthétisées dans le RE Granuleux sortent immatures de celui-ci et subissent donc des lourdes modifications dans l'appareil de Golgi afin d'obtenir une protéine mature.
Pour les articles homonymes, voir RE.
Dans les neurones, le réticulum endoplasmique se nomme « corps de Nissl », et dans les hépatocytes, « corps de Berg ». Le terme « réticulum endoplasmique » est formé à partir du latin reticulum : « réseau » ; et du mot endoplasmique : « à l'intérieur du cytoplasme ».
Présentation générale
Le réticulum endoplasmique est une structure qu'on ne rencontre que chez les cellules Eucaryotes. Plus précisément, on dit que le RE est un réseau étendu et complexe d'un assemblage de saccules et tubules aplatis délimités par une seule membrane unitaire ; il n'existe pas chez les cellules procaryotes (archéobactéries et eubactéries) qui sont dépourvues d'organites.
Le RE est un sous-compartiment de la cellule. Il est composé d'une membrane (de composition différente de celle de la membrane plasmique) et d'une lumière. Ses fonctions s'expliquent par sa capacité à délimiter un volume du reste du cytoplasme.
Il constitue un élément essentiel du réseau membranaire interne des cellules Eucaryotes (système endomembranaire), en continuité avec la membrane nucléaire externe et en relation avec les autres compartiments, notamment les vésicules de l'appareil de Golgi.
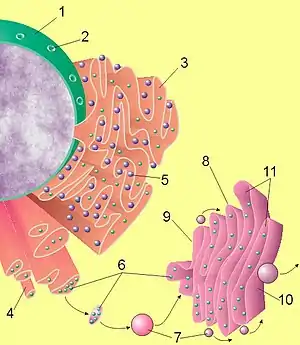 Image du noyau, du réticulum endoplasmique et de l'appareil de Golgi. |
|
Structure
Le réticulum endoplasmique est constitué d'un réseau membraneux étendu. La membrane sépare la lumière du réticulum du cytosol. Des parties de la membrane du réticulum sont en continuité avec la membrane externe du noyau, et la lumière du RE est en continuité avec l'espace intermembranaire du noyau.
Une partie du RE est couverte de ribosomes qui assemblent les acides aminés en chaînes protéiques suivant l'information venue du noyau. L'apparence rugueuse de ces parties au microscope électronique leur vaut la qualification de RE granuleux (REG ou RER). Les parties sans ribosomes sont appelées RE lisse (REL). Les ribosomes sur le REG insèrent la protéine synthétisée directement dans la lumière du RE, où elles acquièrent leur configuration avant de gagner l'appareil de Golgi.
La quantité de REL et de REG varie selon les cellules. De même la proportion de REG par rapport à celle de REL varie aussi selon l'état d'activité de la cellule, selon les besoins en protéosynthèse de la cellule.
Les ribosomes peuvent être séparés les uns des autres, ou être assemblés en amas et reliés par un filament d'ARN. Dans ce dernier cas ils forment les polysomes ou polyribosomes.
Les REG et REL ont des fonctions différentes mais ces deux éléments constituent des compartiments en constante évolution dynamique et de ce fait l'on peut passer de l'un à l'autre dans une même cellule.
Réticulum endoplasmique rugueux (ou granuleux)
Le réticulum endoplasmique rugueux (RER), ou granuleux (REG), assemble et transporte les protéines destinées aux membranes et à la sécrétion. Quelques minutes après la biosynthèse des protéines, la plupart gagnent l'appareil de Golgi dans des vésicules golgiennes. Au sein du REG les protéines peuvent être modifiées, repliées et leur qualité « contrôlée ».
Le REG est le site de la traduction et du repliement lors de la biosynthèse des protéines.
En microscopie électronique, on remarque que le REG porte à sa surface une multitude de petits granules. Ce sont des ribosomes en pleine synthèse protéique fixés à la surface externe du réticulum. Les protéines qu'ils synthétisent sont injectées dans la lumière du réticulum via un pore aqueux, nommé Sec61. Une fois dans la lumière, les protéines subissent une maturation, puis elles sont envoyées vers l'appareil de Golgi. Si des protéines sont mal repliées, elles sont éliminées par le protéasome.
Une fois dans le Golgi, elles peuvent subir une modification post-traductionnelle (clivage de précurseur, glycosylation, sulfatation ou encore phosphorylation), puis sont ensuite envoyées par des vésicules vers les lysosomes, la membrane plasmique ou le milieu extracellulaire (sécrétion). Elles peuvent aussi rester dans le Golgi, ou retourner dans le REG.
Réticulum endoplasmique lisse
Le réticulum endoplasmique lisse (REL) intervient dans plusieurs processus métaboliques. Il participe à la synthèse de lipides (phospholipides membranaires, cholestérol, stéroïdes...) et joue un rôle pour le début de la glycosylation, la détoxification des cellules et le stockage du calcium. Dans certains types cellulaires le REL spécialisé pour le stockage du calcium est appelé calciosome ou, dans les cellules musculaires, réticulum sarcoplasmique.
Ses fonctions sont très diversifiées. Il peut s'agir tout d'abord d'une zone de réticulum granuleux mais où ne s'exerce encore aucune synthèse. C'est aussi une zone de transit entre les régions de synthèse protéique et celles où elles sont excrétées. Mais d'autres endroits assurent la synthèse des lipides membranaires. Ces lipides seront intégrés à des vésicules d'exocytose qui fourniront leurs lipides à la membrane en fusionnant avec elle.
Une autre fonction très importante du réticulum endoplasmique lisse est de réguler le calcium intracellulaire. Le calcium est en effet un poison pour la plupart des processus métaboliques, la cellule en contient donc le minimum. Or ce calcium est utilisé comme signal par certains des récepteurs membranaires. Comme il y en a très peu dans la cellule, il suffit de peu d'ions pour augmenter la concentration dans des proportions élevées. Il permet entre autres de déclencher la contraction musculaire, le potentiel d'action ou l'exocytose et même la fusion des pronuclei lors de la fécondation. La cellule doit donc maintenir une concentration intracellulaire de calcium très basse, tout en s'assurant qu'il y en a assez pour le signal calcique, et ensuite évacuer le calcium du signal le plus vite possible pour permettre l'arrivée d'un nouveau signal, tout en évitant que la concentration augmente trop et atteigne le seuil létal. Certaines zones du réticulum lisse participent à cette régulation en constituant une réserve de calcium pour le signal et en récupérant le calcium cytoplasmique, puis en évacuant l'excès de calcium vers le milieu extérieur.
Fonctions
Le RE assure de multiples fonctions.
- Stockage et concentration de molécules. Il le fait par endocytose, par pinocytose, ou à partir de substances élaborées par la cellule. On note par exemple l'accumulation dans les vacuoles du RE des plasmocytes, d'immunoglobulines.
- Rôle de détoxification, avec la transformation de molécules toxiques en molécules atoxiques, en partie grâce au cytochrome P450. Cela a surtout lieu dans le rein et le foie.
- Rôle dans le métabolisme du calcium. Le calcium est stocké dans le RE. La régulation du calcium avec l'Inositol-tris-phosphate (IP3) notamment, joue un rôle dans le contrôle de la prolifération cellulaire, dans l'apoptose, et le métabolisme cellulaire.
- Sécrétion d'H+ et Cl- par les cellules bordantes de l'estomac et de ces boyaux.
- Production de biomembrane : le REG produit des vésicules (dites de 'transition'), qui engendrent l'appareil de Golgi, ce dernier produira des vésicules de sécrétion, à l'origine de l'exocytose. La membrane de ces vésicules sera en fin de compte incorporée à la membrane plasmique, ainsi régénérée en permanence.
Facilitation du repliement des protéines végétales
Le repliement correct des chaînes protéiques est assuré par les protéines suivantes du RE.
- Protéine disulfure isomérase
- Famille des Hsp70 et Hsp60
- Calnexine (contre les interactions hydrophobes)
- Calreticuline (contre les interactions hydrophobes)
- Peptidylprolyl isomérase
- ERp57 (Endoplasmic Reticulum Protein 57kDa), contre les ponts disulfure, involontaire
Seules les protéines correctement repliées sont transportées du REG vers le Golgi, et ayant un signal d'adressage.
Transport des protéines
La glycosylation d’une protéine est l’ensemble des phénomènes qui assurent la transformation d’une protéine en une glycoprotéine.
Transport des protéines synthétisées dans le cytosol
Ce mécanisme de transport des protéines se réalise en même temps que la traduction des ARNm aux niveaux des ribosomes. Dans le cytosol, un peptide signal d'importation est reconnu par une ribonucléoprotéine située dans le réticulum endoplasmique, la particule de reconnaissance du signal (SRP) qui fonctionne avec l'hydrolyse de la guanosine triphosphate (GTPase). Ce peptide signal est constitué de séquences d'acides aminés hydrophobes qui sont proches de l'extrémité N-terminale. Ainsi, la SRP se fixe sur ce peptide signal et la grosse sous-unité du ribosome, ce qui provoque l'arrêt temporaire de la traduction. La SRP est reconnue par son récepteur situé sur la face cytosolique du RE et le complexe formé de la protéine à transporter, la SRP et la grosse sous-unité du ribosome se fixe sur le translocon ou complexe de translocation, dont l'hétérotrimère Sec61 forme le canal du translocon appelé aussi pore aqueux. À la suite de la fixation du complexe au translocon, la SRP se détache et la grosse sous-unité du ribosome obture la face cytosolique du translocon sans empêcher l'association du peptide signal à site spécifique du translocon. Le pore aqueux s'ouvre à la lumière du RE, et la chaîne polypeptidique (protéine à transloquer) fixée de par ses segments hydrophobes à une protéine chaperonne résidente soluble, la BiP, peut progresser vers celle-ci.
Transports des protéines entre le RE et le Golgi
Cette séquence est enlevée lorsque le polypeptide arrive à destination. Les protéines sont transportées dans des vésicules qui circulent le long du cytosquelette.
Les protéines sont transportées dans des vésicules formées par différents types de revêtement selon leur destination : il existe COP-I et COP-II, formées respectivement d'ARF et de Sar1, qui sont des GTPases monomériques actives quand elles sont liées au GTP et inactives quand elles sont liées aux GDP. Pour ce qui est des protéines d'excrétion, elles seront envoyées d'abord vers le CIREG (compartiment intermédiaire réticulum endoplasmique-golgi) par des vésicules COP II. Ensuite, elles seront exportées dans le Golgi par des vésicules COP II (antérograde). Les vésicules de COP I, quant à elles, sont à l'origine du flux rétrograde du Golgi au RE. Le reste de la glycolysation, notamment la O-Glycolysation, sera effectuée dans l'appareil de Golgi.
Glycosylation des protéines
Les protéines synthétisées de manière classique par les cytoribosomes ne sont pas glycosylées. Ce phénomène concerne seulement les protéines synthétisées au niveau du RE. Il existe deux types de glycosylation : la O-glycosylation et la N-glycosylation. La N est la plus fréquente et l'asparagine est l'acide aminé de la protéine qui sera glycosylée. Ce type de glycosylation débute dans le RE pour se terminer dans le Golgi.
On commence à construire un polysaccharide unique pour toutes les protéines que l’on va ensuite transférer sur la chaîne polypeptidique en croissance. Cet ajout a lieu pendant la synthèse de la protéine, dans la lumière du REG.
Synthèse du polysaccharide
Le dolichol est un acide gras synthétisé dans le cytoplasme. Il s’insère dans la membrane du RE, et on le retrouve dans la cavité.
Puis, on ajoute un à un les sucres sur le dolichol phosphate : 2 N-acétylglucosamines, 9 mannoses et 3 glucoses. Tous ces sucres proviennent du cytosol par transport actif et sont sous forme active liée à des nucléotides.
Transfert du polysaccharide sur la protéine en croissance
Le polysaccharide se fixe toujours sur le même acide aminé de la protéine en croissance : l’Asparagine (Asn).À noter que le polysaccharide ne peut se fixer que si la protéine présente après l'Asparagine une Sérine ou une Thréonine. Pendant la synthèse, des protéines chaperons GRP interviennent dans le repliement des protéines néosynthétisées. Elles les accompagnent jusqu’à l’appareil de Golgi. En leur absence, les protéines ne peuvent être emmenées au Golgi, elles restent alors dans le RE et sont dégradées.
Récapitulatif des différents types de RE
- Réticulum endoplasmique rugueux (présence de ribosome à la surface, production de protéine)
- Réticulum endoplasmique lisse (absence de ribosome à la surface)
- Calciosome (contient une forte concentration de calcium)
- Réticulum sarcoplasmique (calciosome des cellules musculaires, localisation particulière par rapport au sarcomère)
- Calciosome (contient une forte concentration de calcium)