Ponératoxine
La ponératoxine est un peptide neurotoxique paralysant produit par la fourmi Paraponera clavata, surnommée la fourmi « balle de fusil ». Elle bloque l'inactivation des canaux sodiques voltage-dépendants et empêche ainsi la transmission synaptique dans le système nerveux central[1]. La ponératoxine agit sur les canaux sodiques voltage-dépendants situé dans les muscles squelettiques, provoquant une paralysie, et sur les fibres nociceptives, provoquant des douleurs. Elle est classée + 4 sur l'indice de douleur par piqûre de Schmidt, la note la plus élevée dans ce système : des vagues de douleur peuvent se produire jusqu'à douze heures après une seule piqûre.
| Ponératoxine | ||
 Structure 3D de la ponératoxine | ||
| Caractéristiques générales | ||
|---|---|---|
Elle est étudiée pour la fabrication de biopesticides[1],[2].
Mécanisme d'action
La ponératoxine perturbe le fonctionnement des canaux sodiques voltage-dépendants chez les vertébrés et les invertébrés[1]. Elle provoque des activations répétitives et une prolongation des potentiels d'action, en particulier dans le système nerveux central des insectes[2]. L'augmentation de la durée du signal transmis par les nerfs serait le facteur déterminant l'intensité de la douleur[3][réf. à confirmer].
Stockée dans un état inactif dans le réservoir de venin en raison des conditions acides qui y règnent, la molécule devient toxique à la suite d'un processus à deux conditions : la combinaison de la liaison de la ponératoxine à une membrane cellulaire (afin d'agir sur un canal sodique voltage-dépendant) et son exposition aux conditions basiques du site cible. Ces deux modifications simultanées cause un changement conformationnel de la ponératoxine qui la rend active[1].
Catterall et al. ont émis l'hypothèse que certaines neurotoxines polypeptidiques qui modifient les canaux voltage-dépendants fonctionnent via un mécanisme de « piégeage du capteur de tension ». L'hypothèse stipule que les neurotoxines similaires à la ponératoxine, telles que les toxines alpha-scorpion, agissent sur les canaux sodiques via la liaison au site récepteur 3 des canaux, ce qui affecte normalement la capacité des canaux à s'inactiver. Par conséquent, les neurotoxines du site récepteur 3 affectent souvent les canaux sodiques en ralentissant ou en bloquant l'inactivation. Normalement, la région du canal où se trouve le site récepteur de neurotoxine 3 subit un changement conformationnel d'un mouvement vers l'extérieur pour conduire à l'inactivation. Des neurotoxines du site récepteur 3 sont proposées pour empêcher ce changement conformationnel via une interaction avec des résidus d'acides aminés acides et hydrophobes sur ce site[4].
Lorsque des fibres musculaires squelettiques de grenouille ont été exposées à la ponératoxine, il a été constaté que la ponératoxine affectait principalement les canaux sodiques dépendant de la tension en diminuant le courant de sodium de pointe et en induisant également un courant de sodium lent. Cette combinaison a entraîné une activation des canaux sodiques à des potentiels très négatifs et une désactivation très lente, un phénomène couramment observé dans les tissus excitables[5]. La ponératoxine est considérée comme un agoniste à action lente des muscles lisses[6].
Structure
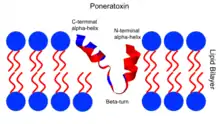
Le peptide de ponératoxine est stocké dans un peptide inactif à 25 résidus (séquence d'acides aminés FLPLLILGSLLMTPPVIQAIHDAQR) dans le réservoir de venin de Paraponera clavata. La structure secondaire est caractérisée par un motif hélice-coude-hélice : deux hélices alpha reliées par un coude bêta.
Les deux hélices alpha sont formées par les résidus 3–9 à l'extrémité N-terminale et les résidus 17–24 à l'extrémité C-terminale, et elles sont reliées par un coude β aux résidus 11–16. Sur le plan tridimensionnel, cette structure présente une forme en V préférentielle avec les deux hélices subissant des interactions lâches non covalentes l'une avec l'autre[1]. Ceci est remarquable en raison de sa similitude structurelle avec d'autres peptides qui interagissent avec la membrane, et indique que la ponératoxine interagira également avec la membrane et affectera ainsi les canaux sodiques voltage-dépendants intégrés[7],[8]. De plus, la structure du peptide passe d'une pelote aléatoire à l'hélice-coude-hélice structurée lorsqu'elle est introduite dans un environnement de bicouche lipidique, ce qui indique que ce motif est important pour interagir avec la membrane[1].
Les deux hélices alpha, cependant, ont des caractéristiques nettement différentes. L'hélice alpha N-terminale est apolaire, contenant un noyau hydrophobe central avec des résidus hydrophiles à chaque extrémité, et n'est pas chargée. Sa structure est similaire à celle d'un peptide signal transmembranaire et implique qu'il s'ancrera à la membrane en enfouissant le noyau hydrophobe dans la bicouche[1]. En particulier, le résidu phénylalanine volumineux et très hydrophobe est important pour interagir avec les bicouches lipidiques non chargées, telles que celles composées de phosphatidylcholine[8]. L'hélice alpha C-terminale est amphipathique avec un côté affichant des résidus polaires et chargés, et l'autre affichant des résidus non polaires, ce qui entraîne l'insertion dans la membrane plasmique[9]. Plus précisément, l'arginine chargée positivement et les résidus d'alanine non polaires se sont tous deux révélés essentiels pour la puissance de la ponératoxine[8]. Voir le schéma, où les régions hydrophobes (rouges) et hydrophiles (bleues) de la ponératoxine et la bicouche lipidique s'alignent, démontrant que la structure évolue pour s'insérer dans la membrane, ce qui favorisera l'interaction avec les canaux sodiques voltage-dépendants.
Toxicologie
Il est généralement admis qu'une piqûre de fourmi balle de fusil se rapproche de la sensation de se faire tirer dessus par une arme à feu. Justin Schmidt, un entomologiste qui a développé l'échelle de douleur par piqûre, considère la piqûre d'une fourmi balle de fusil comme étant la piqûre d'insecte la plus douloureuse qu'il ait connue[10]. La douleur causée par les piqûres de Paraponera clavata peut durer plusieurs heures, voire jusqu'à 24 heures. L'intense douleur et sa durée sont dues aux effets de la ponératoxine. En plus de la douleur intense, les symptômes des piqûres de fourmis balles (ainsi que des piqûres d'autres fourmis du genre Paraponera ou du genre Dinoponera) sont de la fièvre, des sueurs froides, des nausées, des vomissements, une lymphadénopathie et des arythmies cardiaques.
Des tests de toxicité ont montré que la LT50 de la ponératoxine, administrée par vectorisation virale aux larves de S. frugiperda, était de 131 heures après l'injection. Une dose de 105 pfu de ponératoxine était suffisante pour tuer les larves de S. frugiperda, et une dose de 10 ng pouvait les paralyser[1]. Sur la base de ces expériences, les scientifiques pensent que la ponératoxine peut constituer un bon candidat comme insecticide en raison de sa neurotoxicité pour les autres insectes, qui la rend capable d'immobiliser ou même de tuer les insectes infectés[1]. La conception d'un virus recombinant, par ingénierie, d'un baculovirus qui exprime la ponératoxine, a été proposée pour servir de pesticide[1].
Voir aussi
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Poneratoxin » (voir la liste des auteurs).
- (en) Ewa Szolajska,Jaroslaw Poznanski,Miguel López Ferber,Joanna Michalik,Evelyne Gout,Pascal Fender, « Poneratoxin, a neurotoxin from ant venom », European Journal of Biochemistry, (lire en ligne
 )
) - (en) Axel Touchard, Samira Aili, Eduardo Fox et Pierre Escoubas, « The Biochemical Toxin Arsenal from Ant Venoms », Toxins, vol. 8, no 1, , p. 30 (ISSN 2072-6651, PMID 26805882, PMCID PMC4728552, DOI 10.3390/toxins8010030, lire en ligne, consulté le )
- (en-US) Cody Sullivan, « This ant's sting is so bad it feels like getting shot — some call it the worst pain known to man », sur Business Insider (consulté le )
- (en) William A. Catterall, Sandrine Cestèle, Vladimir Yarov-Yarovoy et Frank H. Yu, « Voltage-gated ion channels and gating modifier toxins », Toxicon, vol. 49, no 2, , p. 124–141 (DOI 10.1016/j.toxicon.2006.09.022, lire en ligne, consulté le )
- (en) Alain Duval, Claire O. Malécot, Marcel Pelhate et Tom Piek, « Poneratoxin, a new toxin from an ant venom, reveals an interconversion between two gating modes of the Na channels in frog skeletal muscle fibres », Pflügers Archiv, vol. 420, no 3, , p. 239–247 (ISSN 1432-2013, DOI 10.1007/BF00374453, lire en ligne, consulté le )
- (en) Tom Piek, Alain Duval, Bernard Hue et Henk Karst, « Poneratoxin, a novel peptide neurotoxin from the venom of the ant, paraponera clavata », Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, vol. 99, no 3, , p. 487–495 (ISSN 0306-4492, DOI 10.1016/0742-8413(91)90276-Y, lire en ligne, consulté le )
- (en) Guangshun Wang, James T. Sparrow et Robert J. Cushley, « The Helix-Hinge-Helix Structural Motif in Human Apolipoprotein A-I Determined by NMR Spectroscopy , », Biochemistry, vol. 36, no 44, , p. 13657–13666 (ISSN 0006-2960 et 1520-4995, DOI 10.1021/bi971151q, lire en ligne, consulté le )
- (en) Stephen R. Johnson, Hillary G. Rikli, Justin O. Schmidt et M. Steven Evans, « A reexamination of poneratoxin from the venom of the bullet ant Paraponera clavata », Peptides, vol. 98, , p. 51–62 (DOI 10.1016/j.peptides.2016.05.012, lire en ligne, consulté le )
- (en) Guillaume Drin et Bruno Antonny, « Amphipathic helices and membrane curvature », FEBS Letters, vol. 584, no 9, , p. 1840–1847 (DOI 10.1016/j.febslet.2009.10.022, lire en ligne, consulté le )
- (en) Kevin Loria, « A man who has been stung more than 1,000 times reveals the one bug you really want to avoid »
 , sur businessinsider.com, (consulté le )
, sur businessinsider.com, (consulté le )
- Portail de la biochimie