Réaction de Kulinkovich-Szymoniak
La réaction de Kulinkovich-Szymoniak est une réaction de cyclopropanation des nitriles, conduisant à des cyclopropylamines primaires.
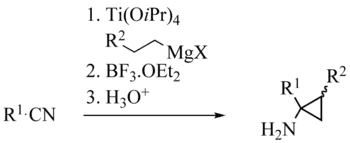
Découverte
La réaction de Kulinkovich- Szymoniak fut décrite pour la première fois en 2001 par Bertus et Szymoniak[1]. Il s'agit d'une extension de la réaction de Kulinkovich. Elle est apparentée à la réaction de Kulinkovich-de Meijere qui conduit elle aussi à des aminocyclopropanes, mais ne permet pas d'accéder directement à des cyclopropylamines primaires[2]. Ces deux transformations peuvent donc être considérées comme complémentaires.
Mécanisme
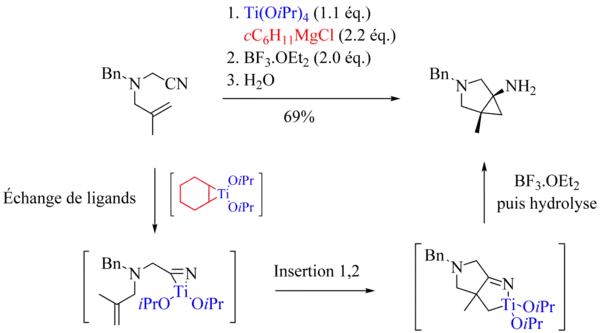
Tout comme celui de la réaction de Kulinkovich, le mécanisme de la réaction de Kulinkovich-Szymoniak fait tout d'abord intervenir la formation d'un titanacyclopropane 1. Celui-ci subit alors une insertion 1,2 du groupe nitrile pour conduire à un azatitanacyclopentène 2. Ce complexe est en général assez stable. Le plus souvent, l'ajout d'un acide de Lewis tel que l'éthérate de trifluoroborane est nécessaire pour déclencher la contraction de cycle conduisant à l'aminocyclopropane désiré 3 après hydrolyse.
Cas particulier des nitriles comportant un hétéroatome en α
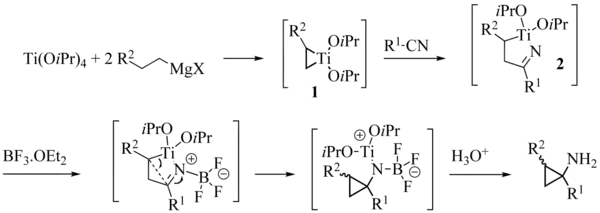
Dans certains cas, de bons rendements peuvent être obtenus sans que l'ajout d'un acide de Lewis soit nécessaire, notamment à partir de nitriles comportant un hétéroatome en position α. Ce phénomène peut s'expliquer en invoquant une chélation de l'intermédiaire 4 par un atome de magnésium ou de titane, fournissant une activation suffisante pour permettre la fermeture du cyclopropane[3].
Cas des cyanoesters
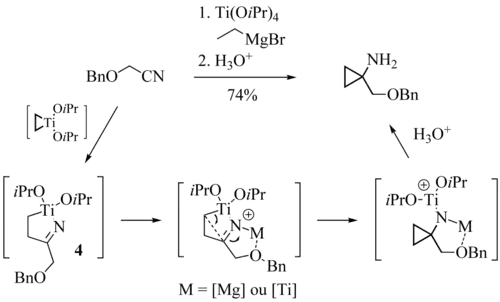
La fonction nitrile est beaucoup plus réactive que la fonction ester vis-à-vis des titanacyclopropanes[4],[5]. Dans les conditions de la réaction de Kulinkovich-Szymoniak, les cyanoesters commencent donc par subir une attaque de l'espèce organométallique sur le groupe nitrile. Lorsque la fonction ester est située à une distance convenable, une cyclisation s'opère pour conduire à un spiro-lactame (4). Dans ce cas, une quantité catalytique de tétraisopropyloxytitane suffit à l'obtention de bons rendements[6]. Les cyanocarbonates réagissent de manière analogue aux cyanoesters.
Réactions de Kulinkovich-Szymoniak intramoléculaires
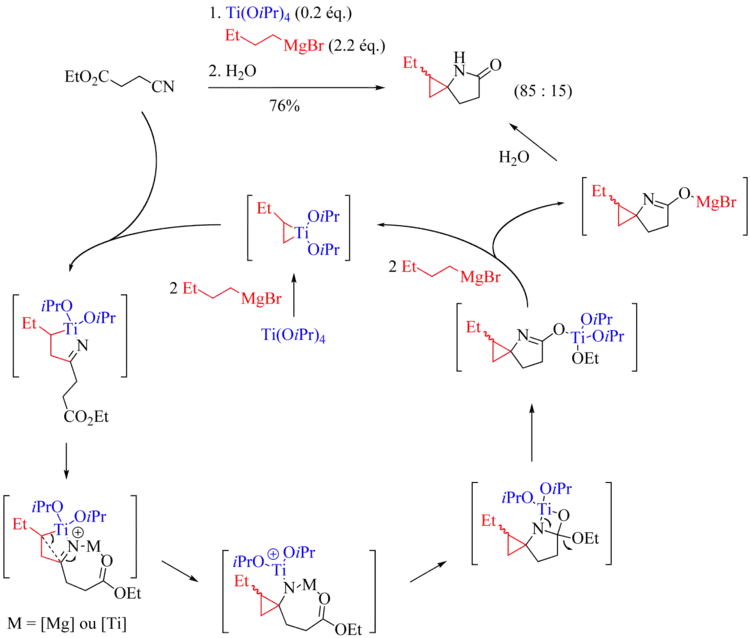
Contrairement au cas des réactions de Kulinkovich et de Kulinkovich-de Meijere, il n'existe actuellement aucune méthode générale permettant de réaliser des réactions de Kulinkovich-Szymoniak avec échange de ligands, c'est-à-dire couplant un nitrile et une oléfine. Selon toute vraisemblance, cela peut s'expliquer par la très grande réactivité des nitriles vis-à-vis des titanacyclopropanes[5]. Néanmoins, dans le cas particulier des réactions intramoléculaires, l'équipe de Bertus et Szymoniak a réussi à mettre au point une méthode conduisant efficacement aux aminocyclopropanes bicycliques attendus[7]. L'emploi d'halogénure de cyclohexylmagnésium est primordial.
Réactions apparentées
La réaction de Kulinkovich-Szymoniak est apparentée à d'autres transformations :
- ;a réaction de Kulinkovich, conduisant à des cyclopropanols à partir d'esters carboxyliques.
- la réaction de Kulinkovich-de Meijere, conduisant à des aminocyclopropanes à partir d'amides.
Sources d'informations complémentaires
Il existe un article récapitulatif consacré à cette réaction :
- P. Bertus, J. Szymoniak, Synlett, 2007, 1346–1356.
On peut également se référer à l'article suivant, qui décrit les méthodes de synthèse d'aminocyclopropanes faisant appel à la chimie du titane :
- A. de Meijere, S. I. Kozhushkov, A. I. Savchenko, J. Organomet. Chem., 2004, 689, 2033–2055.
La réaction de Kulinkovich-Szymoniak est également abordée dans un article de fond récent :
- A. Wolan et Y. Six, Tetrahedron, 2010, 66, 15–61.
Notes et références
- P. Bertus et J. Szymoniak, « New and easy route to primary cyclopropylamines from nitriles », Chem. Commun., , p. 1792-1793 (DOI 10.1039/b105293b)
- V. Chaplinski, A. de Meijere, Angew. Chem. Int. Ed. Engl., 1996, 35, 413-414.
- P. Bertus, J. Szymoniak, J. Org. Chem., 2002, 67, 3965-3968.
- P. Bertus, J. Szymoniak, Synlett, 2003, 265-267.
- F. Cadoret, Y. Six, Tetrahedron Lett., 2007, 48, 5491-5495.
- C. Laroche, D. Harakat, P. Bertus, J. Szymoniak, Org. Biomol. Chem., 2005, 3, 3482-3487.
- C. Laroche, P. Bertus, J. Szymoniak, Tetrahedron Lett., 2003, 44, 2485-2487.
- Portail de la chimie