Récepteur NMDA
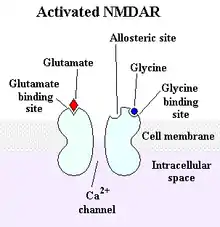
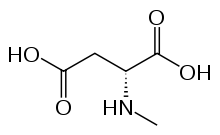
Les récepteurs NMDA (récepteur au N-méthyl-D-aspartate) sont des récepteurs ionotropes activés dans des conditions physiologiques par le glutamate et la glycine[1] qui sont essentiels à la mémoire et à la plasticité synaptique. Ce sont les seuls récepteurs au glutamate à être spécifiquement activés par l'agoniste pharmacologique N-méthyl-D-aspartate (NMDA). Ils sont perméables aux cations monovalents (sodium, potassium) et au calcium. En raison de la perméabilité au sodium et au potassium, le potentiel de réversion des NMDAR est autour de 0 mV. L'entrée de calcium dans le neurone via les récepteurs de NMDA serait un mécanisme d'induction de la plasticité synaptique. Les récepteurs NMDA sont bloqués par l'ion magnésium qui occupe l'entrée du pore, et qui peut être libéré en cas d'inversion de potentiel électrochimique. La glycine et le glutamate sont nécessaires à l'activation des récepteurs NMDA.
Structure
Les récepteurs NMDA sont des tétramères[2], formés de deux sous-unités NR1 et de deux sous-unités NR2 (NR2A, NR2B, NR2C ou NR2D). Les sous-unités NR1 sont obligatoires, tandis que les sous-unités NR2 spécifient les propriétés électrophysiologiques des récepteurs NMDA, tel leur sensibilité au glutamate, leur perméabilité au calcium, l'inhibition du magnésium. Les sous-unités NR2 spécifient également leurs interactions avec les protéines intracellulaires. Les sites de liaison de la glycine sont localisés sur les sous-unités NR1, tandis que les sites de liaison du glutamate sont situés sur les sous-unités NR2.
Expression
Dans l'embryon, NR2D est exprimée en premier, puis NR2B et NR2C s'expriment [réf. souhaitée]. NR2A commence à être exprimée autour de la naissance. NR2D est principalement exprimée dans les zones germinales et les nouveaux neurones. NR2C est presque exclusivement exprimée dans le cervelet. NR2A et NR2B se retrouvent dans toutes les régions du cerveau, particulièrement celles impliquées dans l'apprentissage et la mémoire. On les retrouve en abondance dans l'hippocampe et le cortex [réf. souhaitée].
Au cours du développement on observe dans la synapse glutamatergique un remplacement des récepteurs comprenant la sous-unité NR2B par ceux contenant NR2A, le mécanisme passe probablement par une perte de localisation des sous-unités NR2B, à la suite du changement de composition des molécules d'échafaudage présentes d'une part à la synapse et d'autre part dans les zones extrasynaptiques, le niveau d'expression de NR2B étant constant. La reelin peut affecter l'expression de NR2B.
Rôle
Les récepteurs NMDA sont les récepteurs principalement postsynaptiques responsables de la phase lente des potentiels post-synaptiques excitateurs (PPSE). Les récepteurs NMDA sont considérés comme des détecteurs de coïncidence lors des phénomènes de sommation (en) des potentiels post-synaptiques. En effet, les récepteurs NMDA doivent, pour s'ouvrir, être stimulés par l'arrivée du glutamate pré-synaptique, mais aussi par une dépolarisation post-synaptique (normalement causée par l'activation des récepteurs AMPA sensibles au glutamate et plus rapides que les NMDAR). La liaison du glutamate force un changement conformationnel par ajustement induit du récepteur qui ouvre le pore, mais celui-ci ne peut se libérer de l'ion magnésium qui le bloque que s'il y a une dépolarisation qui le repousse.
L'entrée de calcium est aussi responsable de l'induction de modifications de l'intensité de la force de transmission synaptique, nommément la plasticité synaptique. En particulier l'activation de la CAM kinase 2 par le calcium est requise pour la potentialisation à long terme. La cascade enzymatique de second messager ERK/MAPK, responsable de l'activation de la synthèse de nouvelles protéines nécessaires à la fonction des synapses lors de l'induction de la potentialisation à long terme, est elle aussi activée par les récepteurs NMDA.
La stimulation du récepteur peut également favoriser la croissance d'une tumeur ainsi que son côté invasif[3], ce qui pourrait constituer une cible thérapeutique[4].
Ils jouent un rôle probable favorisant lors d'une hypertension artérielle pulmonaire[5].
NR2B et l'intelligence
Les récepteurs NMDA jouent un rôle dans le fonctionnement des synapses et le remodelage de ces dernières[6].
L'équipe de Joe Z. Tsien a montré en 1999 qu'il était possible d'augmenter significativement l'intelligence et la mémoire de rats de laboratoire uniquement en augmentant l'expression de l'unité NR2B. L'effet inverse a été observé en diminuant l'expression du gène codant NR2B[7],[8]. L'expérience a été indépendamment reproduite en 2009[9]. Tsien a montré ultérieurement que l'augmentation de l'expression du gène de NR2B améliorait également la mémoire des rats âgés[10].
Dans une recherche neuroradiologique sur le volume des lobes temporaux de personnes atteintes de la maladie d'Alzheimer, seulement deux polymorphismes sur 546 314 polymorphismes possibles (à base unique) ont été corrélés avec une dégénérescence de ces régions du cerveau (et avec des tests généraux des fonctions cognitives). De ces deux polymorphismes, un correspondait au gène GRIN2B, qui code l'unité NR2B[11].
L'excitotoxicité
Les signaux glutamatergiques captés via les récepteurs NMDA régulent la consolidation des souvenirs mais leur vigueur peut également causer la mort du neurone si l'excitation n'est pas contrôlée. L'excitotoxicité désigne le phénomène d'autodestruction d'un neurone excité qui ne retrouve pas son homéostasie mais, au contraire, devient de plus en plus excitable à chaque excitation. Ainsi, alors que des stimulants glutamatergiques pourraient sembler indiqués dans la maladie d'Alzheimer, par exemple, c'est plutôt la mémantine, un agent bloquant les récepteurs NMDA, qui intéresse plusieurs gériatres. Cette situation paradoxale se résume ainsi : « trop peu d'activation, c'est mauvais ; trop, c'est encore pire »[12]. Elle est observée dans un nombre grandissant de neuropathologies.
En médecine
Certaines substances psychotropes agissent directement sur les récepteurs NMDA, en particulier la kétamine, un anesthésique qui altère la capacité des neurones à sommer correctement les signaux qu'ils reçoivent puisque les récepteurs NMDA, responsables de cette fonction, sont perturbés. Certaines drogues qui bloquent les récepteurs NMDA dans l'amygdale bloquent aussi le conditionnement classique[réf. souhaitée].
Certaines encéphalites auto-immunes sont dues à la présence d'anticorps anti récepteurs NMDA[13].
Notes et références
- (en) Lehmann J, Colpaert F, Canton H., « Glutamate and glycine co-activate while polyamines merely modulate the NMDA receptor complex », Prog Neuropsychopharmacol Biol Psychiatry., vol. 15, no 2, , p. 183-90 (PMID 1678540)
- Paoletti P, Bellone C, Zhou Q, NMDA receptor subunit diversity: impact on receptor properties, synaptic plasticity and disease, Nat Rev Neurosci, 2013;14:383–400
- Li L, Hanahan D, Hijacking the neuronal NMDAR signaling circuit to promote tumor growth and invasion, Cell, 2013;153:86–100
- Takano T, Lin JH, Arcuino G, Gao Q, Yang J, Nedergaard M, Glutamate release promotes growth of malignant gliomas, Nat Med, 2001;7:1010–1015
- Dumas SJ, Bru-Mercier G, Courboulin A et al. NMDA-type glutamate receptor activation promotes vascular remodeling and pulmonary arterial hypertension, Circulation, 2018;137:2371–2389
- Lau CG, Zukin RS, NMDA receptor trafficking in synaptic plasticity and neuropsychiatric disorders, Nat Rev Neurosci, 2007;8:413–426
- Making Smart Mice - Lab-bred "Doogie" mice learn faster and remember more than their field-born brethren. Kristin Leutwyler. Scientific American.
- (en) Tang YP, Shimizu E, Dube GR, Rampon C, Kerchner GA, Zhuo M, Liu G, Tsien JZ., « Genetic enhancement of learning and memory in mice », Nature, vol. 401, no 6748, , p. 63-7. (PMID 10485705)
- Rat Made Supersmart -- Similar Boost Unsafe in Humans? Matt Kaplan. National Geographic News
- (en) Cao X, Cui Z, Feng R, Tang YP, Qin Z, Mei B, Tsien JZ., « Maintenance of superior learning and memory function in NR2B transgenic mice during ageing », Eur J Neurosci., vol. 25, no 6, , p. 1815-22. (PMID 17432968)
- (en) Stein JL, Hua X, Morra JH, Lee S, Hibar DP, Ho AJ, Leow AD, Toga AW, Sul JH, Kang HM, Eskin E, Saykin AJ, Shen L, Foroud T, Pankratz N, Huentelman MJ, Craig DW, Gerber JD, Allen AN, Corneveaux JJ, Stephan DA, Webster J, DeChairo BM, Potkin SG, Jack CR Jr, Weiner MW, Thompson PM; Alzheimer's Disease Neuroimaging Initiative., « Genome-wide analysis reveals novel genes influencing temporal lobe structure with relevance to neurodegeneration in Alzheimer's disease », Neuroimage., vol. 51, no 2, , p. 542-54. (PMID 20197096, DOI 10.1016/j.neuroimage.2010.02.068, lire en ligne)
- (en) Parsons CG, Stöffler A, Danysz W., « Memantine: a NMDA receptor antagonist that improves memory by restoration of homeostasis in the glutamatergic system--too little activation is bad, too much is even worse », Neuropharmacology., vol. 53, no 6, , p. 699-723 (PMID 17904591)
- (en) Dalmau J, Lancaster E, Martinez-Hernandez E, Rosenfeld MR, Balice-Gordon R, « Clinical experience and laboratory investigations in patients with anti-NMDAR encephalitis », Lancet Neurol. 2011;10:63-74.
Voir aussi
- Récepteur AMPA
- Récepteur kaïnate
- Synapse
- Encéphalite limbique avec anticorps anti-récepteur N-méthyl-D-aspartate
- Portail des neurosciences
- Portail de la médecine
- Portail de la biologie cellulaire et moléculaire